柳穿鱼黄素促进肝癌小鼠肿瘤中CD8+ T 细胞浸润的实验性观察
2022-09-23郭丹风张铭张笑丹于潇李豪郭文治郑州大学第一附属医院肝胆胰外科河南省消化器官移植重点实验室河南郑州450052
郭丹风,张铭,张笑丹,于潇,李豪,郭文治(郑州大学第一附属医院肝胆胰外科,河南省消化器官移植重点实验室,河南 郑州 450052)
肝癌是临床上最常见的恶性肿瘤之一,严重危害人类生命健康[1]。最新公布的数据显示:肝癌的全球发病率和病死率分别位居恶性肿瘤第6 位和第4 位[2],83%的肝癌病例发生在处于经济转型期的国家,其中中国的肝癌病例占全球的50%以上[3]。因此,提高肝癌治愈率、降低肝癌发病率及病死率是亟待解决的临床问题。免疫状态改变参与肝癌发生发展的过程[4]。寻找能够通过调节肝癌肿瘤微环境中免疫细胞的应答状态发挥抗肿瘤作用的药物具有重要临床应用价值。
柳穿鱼黄素(pectolinarigenin,Pec)属于黄酮类化合物,可影响细胞增殖、凋亡、过敏反应、抗感染等过程[5-8]。近年来关于柳穿鱼黄素在肿瘤中的作用也得到了密切关注[9-10]。Wu 等[11]研究发现柳穿鱼黄素通过抑制PI3K/AKT/mTOR/ERK 信号通路抑制HCC 增殖,促进细胞凋亡。此外,柳穿鱼黄素还可通过抑制ERK 信号通路抑制肝癌细胞耐药株的增殖、侵袭和迁移[12]。已有研究多聚焦于柳穿鱼黄素直接抑制肝癌细胞生物学行为的作用观察,关于柳穿鱼黄素对肝癌微环境中细胞免疫应答的调控作用尚未阐明。
本课题拟通过构建肝癌荷瘤小鼠,给予柳穿鱼黄素处理后,分析荷瘤小鼠体内T 淋巴细胞亚型的变化,并探讨其对T 淋巴细胞功能的影响,为其作为肝癌治疗的抗肿瘤药物提供理论基础。
1 资料与方法
1.1材料:Hepa 1-6 细胞株来自本实验室留存;柳穿鱼黄素购自北京索莱宝科技有限公司;胎牛血清购自美国Gibco 公司;DMEM 高糖培养基、胰酶及细胞冻存液均购自苏州新赛美生物科技有限公司;TRIzol 总RNA 提取试剂盒、逆转录试剂盒购自南京诺唯赞医疗科技有限公司;2×SYBR Green qPCR 扩增试剂盒购自美国Bimake 生物科技有限公司;Anti-CD16/CD32 抗体(Cat.14-0161-85)购自美国Invitrogen 公司。流式抗体Fixable viability dye(FVD)-PB450(Cat. 65-0863-14)购自美国Thermo公司。流式抗体anti-mouse CD3-FITC(Cat. 100203)及anti-mouse CD4-PECy7(Cat. 100422)购 自 美 国Biolegend 公司。流式抗体anti-mouse CD8a-PE(Cat.561095)购自美国BD bioscience 公司。
1.2实验方法
1.2.1细胞培养:Hepa 1-6 细胞为本中心留存。Hepa 1-6 细胞在含5 % CO2,37℃的培养箱中培养,培养基为含10%胎牛血清的DMEM 高糖培养基。当细胞处于对数生长期,细胞密度大于90%时,进行传代。用0.25%胰蛋白酶消化,当多数细胞形态变圆时,应即加入3 倍体积的含10%胎牛血清的DMEM 液终止消化。低速离心后,吹打细胞沉淀制成细胞悬液,按1 ∶3 进行传代。待培养细胞总量达到实验需求时,收集细胞,细胞计数仪进行计数后,调整细胞浓度为3×106个/ml,按照每只小鼠100 μl 的剂量进行皮下荷瘤接种。
1.2.2构建皮下移植瘤模型:SPF 级C57BL/6N 雌鼠10 只,8 周龄,体重18 ~20 g,购买于北京斯贝福生物技术有限公司。小鼠饲养于郑州大学第一附属医院河南省消化器官移植重点实验室SPF 级动物房,适应性饲养7 d 后,进行荷瘤。皮下荷瘤鼠源肝癌细胞Hepa 1-6,3×105个/100 μl。荷瘤后,小鼠随分为2 组,每组5 只。柳穿鱼黄素处理组(Pec 组)小鼠经腹腔注射给予Pec(使用剂量20 mg/kg),对照组(Ctrl 组)小鼠经腹腔注射给予等量的生理盐水。隔天给药,连续给药7 次。
每2 d 进行小鼠体重称量及肿瘤大小的测量。使用游标卡尺测量移植瘤的生长情况,记录小鼠肿瘤长径(a) 与垂直径(b),根据公式a×b2/2 计算肿瘤体积,并绘制肿瘤体积增长曲线。荷瘤第21 d,获取小鼠脾脏及肿瘤引流淋巴结,流式细胞术检测CD4+T 细胞和CD8+T 细胞的比例变化。剥离小鼠肿瘤,称重后冻存于-80℃,提取RNA,利用 实 时 荧 光 定 量PCR(real time quantitative PCR,RT-qPCR)检测相关因子(IFN-γ、Granzyme B、CXCL10及CXCR3) 的表达情况。动物实验重复3次。
1.2.3 流式细胞术:颈椎脱臼法处死2 组实验小鼠,取脾脏及肿瘤区域引流淋巴结(肿瘤侧腋窝及腹股沟淋巴结),置于PBS 中。研磨后过滤,滤液离心1500 rpm×5 min。加入2 ml 红细胞裂解液处理5 min,加3 倍体积PBS 进行中和, 离心1500 rpm×5 min,细胞沉淀以PBS 重悬。每种样本取1×106个细胞进行表面染色。每管加1 μl anti-CD16/CD32 抗体,以封闭细胞表面Fc 受体,于4℃作用10 min。分别加入下列5 种荧光素标记的流式抗体(终浓度均为1 μg/ml),包括Fixable viability dye (FVD)-PB450、anti-mouse CD3-FITC、anti-mouse CD4-PECy7、anti-mouse CD8a-PE,4℃避光孵育30 min。加2 ml 预冷PBS 中和染色,离心1500 rpm×5 min,重复2 次。弃上清,加200 μl PBS 重悬细胞,上流式细胞仪进行检测。流式数据采用FlowJo 软件进行作图分析。
1.2.4 免疫组化:新鲜肿瘤组织经福尔马林固定后送武汉赛维尔公司进行免疫组化染色,检测CD8 抗原表达情况。以Image-pro plus 6.0 (Media Cybernetics, Inc., Rockville, MD, USA)软件分析单位面积内CD8 阳性细胞数量。具体分析方法如下:每组内每张切片随机挑选至少3 个200 倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对3 个200 倍视野内阳性细胞进行计数。计算组织面积,求出每平方毫米阳性细胞的数量。
1.2.5 RT-qPCR:Trizol 法提取组织RNA,逆转录成cDNA。采用2×SYBR Green qPCR(Bimake)进行定量PCR 扩增。本文中涉及的小鼠基因及相应的引物序列如下(表1)。

表1 小鼠基因及相应的引物序列
1.3 统计学方法:应用Graphpad prism 8.0 软件对数据进行统计学处理,所有数据用均数±标准差(±s)表示,采用t 检验或者单因素方差分析(One-way ANOVA analysis)。P <0.05 为差异有统计学意义。
2 结 果
2.1 柳穿鱼黄素有效抑制小鼠肝癌进展:两组小鼠体重变化曲线基本重合,说明实验使用的柳穿鱼黄素剂量在安全范围内,不影响小鼠的基本生理状态,见图1A(P >0.05)。肿瘤体积增长曲线结果显示Pec 组小鼠肿瘤体积明显减小(P <0.05),见图1B。荷瘤21 d 后完整剥除肿瘤组织进行称重,发现Pec 组小鼠肿瘤重量明显减轻(P <0.05),见图1C。以上结果证实,柳穿鱼黄素具有显著抑制肝癌进展的作用。

图1 两组小鼠皮下移植瘤模型构建情况
2.2 柳穿鱼黄素处理后小鼠体内CD8+T 淋巴细胞比例增加:流式细胞术结果显示,与对照组相比,Pec 组小鼠脾脏中,CD8+T 淋巴细胞比例显著增加(P <0.05),而CD4+T 淋巴细胞比例减少(P <0.05),见图2A、B。在荷瘤小鼠的肿瘤区域引流淋巴结中也得到一致结果,见图2C、D。以上结果提示柳穿鱼黄素可能调控肝癌荷瘤小鼠体内T淋巴细胞含量进而影响肝癌进程。
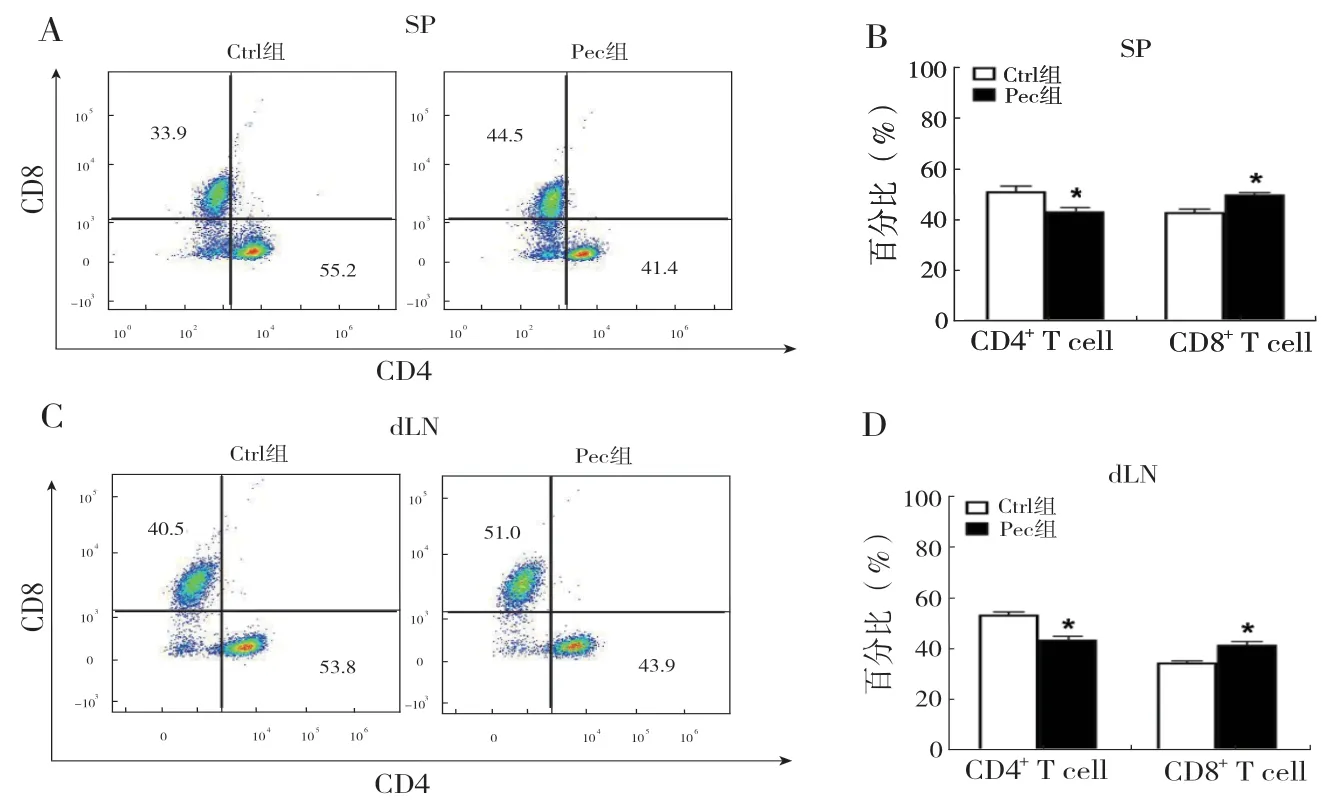
图2 两组小鼠体内CD4+、CD8+ T 淋巴细胞比例情况
2.3 柳穿鱼黄素处理后肿瘤组织中CD8+T 淋巴细胞浸润增多:对荷瘤小鼠肿瘤组织的流式分析结果显示,与Ctrl 组相比,Pec 组小鼠肿瘤组织内CD45+CD8+T 淋巴细胞比例显著增多(P <0.05),见图3A、B。免疫组化结果同样证实肿瘤组织内提示CD8+T 淋巴细胞数量增加(P <0.05),见图3C、3D。以上结果说明柳穿鱼黄素可促进肝癌荷瘤小鼠体内CD8+T 淋巴细胞浸润。
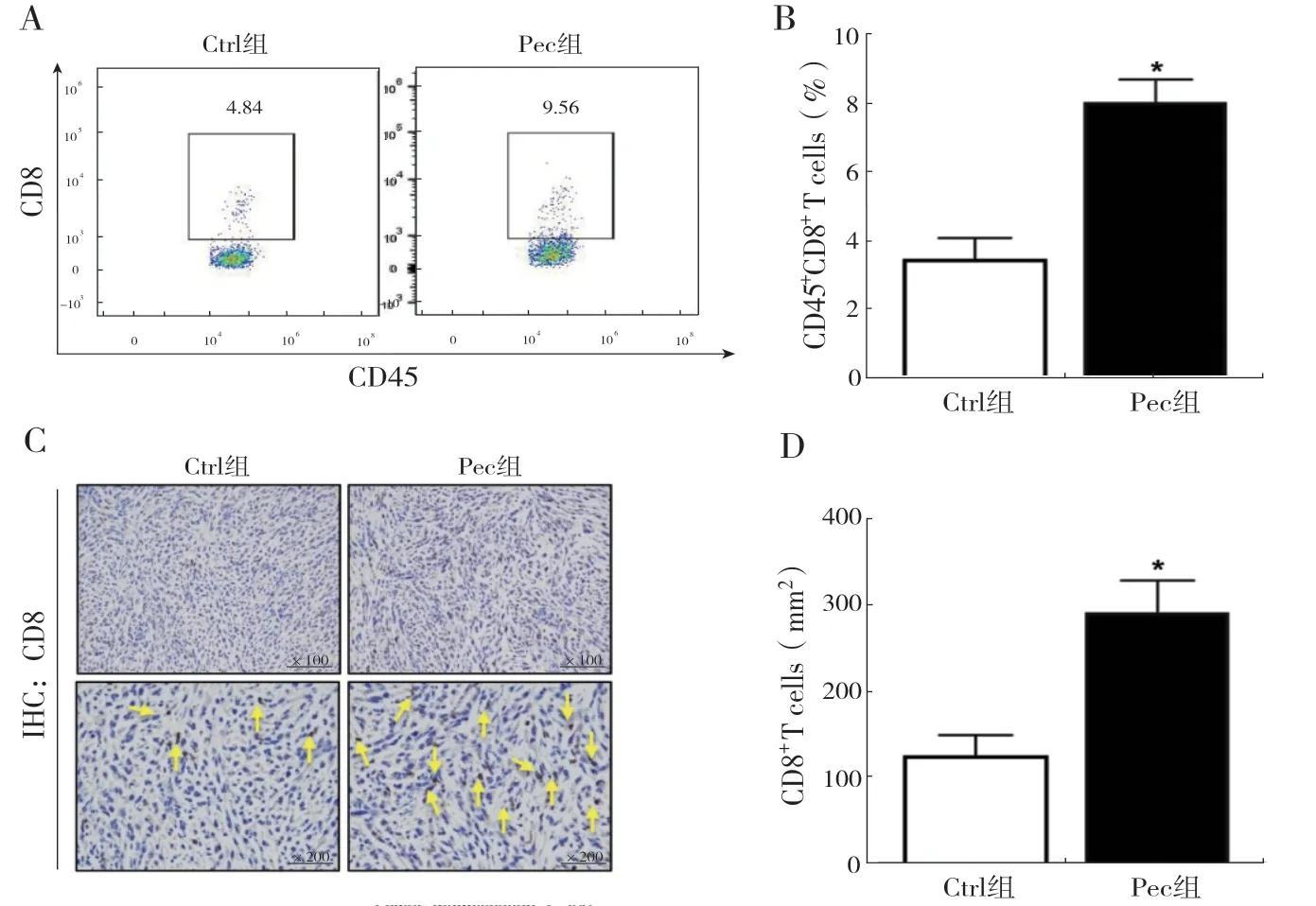
图3 两组小鼠肿瘤组织中CD8+ T 淋巴细胞含量
2.4 柳穿鱼黄素处理增强CD8+T 淋巴细胞相关效应分子的表达水平:RT-qPCR 结果显示,在Pec组小鼠肿瘤组织中,IFN-γ、Granzyme B 的表达水平显著高于对照组(P <0.05),见图4A、4B。同时,与CD8+T 淋巴细胞趋化密切相关的因子CXCL10 及受体CXCR3 表达水平同样显著升高(P <0.05),见图4C、D。以上结果提示,柳穿鱼黄素促进肝癌荷瘤小鼠体内CD8+T 淋巴细胞在肿瘤组织中的浸润,同时增强CD8+T 细胞效应分子的分泌水平,进而发挥抑制肝癌进展的作用。

图4 两组小鼠肿瘤组织中各效应分子的表达情况
3 讨 论
肝癌是一种消化系统常见的恶性肿瘤,因其易转移和易复发,肝癌患者预后较差[13-17]。目前,肝癌的治疗主要包括外科手术、放化疗、靶向免疫治疗及中药辅助治疗等[18]。其中,靶向免疫治疗是肿瘤治疗和免疫学研究的热点,但是肝癌微环境存在的免疫抑制现象是导致肝癌免疫治疗效果差的主要因素[19]。肿瘤免疫抑制微环境能极大程度的抑制机体抗肿瘤CD8+T 细胞的活化,从而导致肿瘤的免疫逃逸[20]。而中药因其具有诱导肝癌细胞凋亡、抑制癌细胞增殖、抑制新生血管生成及抗肿瘤免疫调节等多重作用,受到研究学者的关注[21]。因此,寻找能够有效提高肝癌患者体内抗肿瘤CD8+T 细胞浸润及功能的方法,对提高肝癌免疫治疗的效果具有重要意义。
柳穿鱼黄素是一种从中药中提取的天然黄酮类化合物,具有抗炎活性、抗病毒和抗肿瘤的作用[22-23]。在本研究中,我们使用了不影响小鼠正常生理状态的安全剂量的柳穿鱼黄素处理肝癌荷瘤小鼠后,小鼠肿瘤体积显著减少,肿瘤重量明显减轻,证实了其对肝癌的抗肿瘤作用。分析荷瘤小鼠外周脾脏及肿瘤区域的腋窝及腹股沟引流淋巴结,我们发现柳穿鱼黄素处理组小鼠体内CD8+T 细胞比例升高。同时,在肿瘤组织中流式分析和免疫组化结果显示肿瘤组织内浸润CD8+T 细胞数目增多。以上结果说明柳穿鱼黄素可增加肝癌荷瘤小鼠体内CD8+T 细胞的浸润。
CD8+T 细胞活化后通过释放具有杀伤作用的细胞因子包括IFN-γ、颗粒酶B 等发挥细胞毒作用[24]。同时,趋化因子CXCL10 通过与其受体CXCR3 结合,可招募CD8+T 细胞进入癌组织,直接杀伤肿瘤细胞,有效提高患者总生存率[25-26]。我们发现柳穿鱼黄素处理后,肿瘤组织中IFN-γ、颗粒酶B 等细胞因子及与CD8+T 细胞趋化密切相关的趋化因子CXCL10 及其受体CXCR3 表达水平均显著上升。
综上所述,柳穿鱼黄素可增加肝癌荷瘤小鼠体内CD8+T 细胞的浸润,并增强其效应因子IFN-γ的表达水平,进而发挥抑制肝癌进展的抗肿瘤作用。同时,我们研究发现,柳穿鱼黄素处理后小鼠体内CD4+T 细胞比例下降,但其具体机制有待进一步研究明确。此外,除了T 淋巴细胞外,B 淋巴细胞和NK 细胞等其他免疫细胞亚型也可以参与抗肿瘤免疫应答过程,并影响IFN-γ 细胞因子的分泌。我们将在未来深入研究柳穿鱼黄素与抗肿瘤免疫应答过程密切相关的其他免疫细胞亚群,包括B淋巴细胞、NK 细胞等的调控关系,全面分析柳穿鱼黄素对免疫应答过程中的免疫细胞功能的影响。
