低表达NIPBL抑制骨髓间充质干细胞成骨并促进β连环蛋白磷酸化
2022-09-23张惠荣马雯晴董丽丽杨眷娣
刘 辉,张惠荣,马雯晴,董丽丽,杨眷娣
(1.石河子大学医学院,新疆 石河子 832000;2.石河子大学第一附属医院儿科,新疆 石河子 832000)
德朗热综合征(CDLS)是一种累及多系统的罕见病,具有显著遗传异质性,临床表现轻重不一[1],典型病例有特殊面容、严重生长迟滞及肢体畸形等特点。目前发现[2],至少有7 个基因(NIPBL基因、锚蛋白重复域11基因、SMC3 基因、RAD21 基因、SMC1A 基因、溴结构域蛋白4基因、组蛋白去乙酰化酶8基因和)与 CDLS相关,其中最常见的为NIPBL基因,起到调控黏连蛋白的作用[3]。许多组织均有NIPBL的表达,其中在颅骨、前肢、鳃弓中表达最丰富,这与其出生后主要骨骼畸形高度一致[4]。有研究证实,CDLS患儿中骨骼畸形最主要的原因是NIPBL基因沉默[5]。
骨髓间充质干细胞是常见的“种子细胞”,是成骨前体细胞的主要来源,在一定的诱导条件下可以分化为成骨细胞[6]。前期课题组已成功验证NIPBL基因突变小鼠肢芽中成骨标志蛋白下调[7],然而在成骨分化过程受到多种因子及信号通路的影响[8],其中Wnt/β-catenin信号通路在成骨过程中发挥重要作用[9]。本研究主要探讨NIPBL沉默的小鼠骨髓间充质干细胞在成骨诱导后Wnt/β-catenin信号通路中的p-β-catenin蛋白、β-catenin 蛋白以及Lrp-5 mRNA的表达情况,从NIPBL基因调控骨骼生长发育的角度揭示CdLS的发病机制,为临床CDLS的治疗和干预提供新的思路。
1 材料和方法
1.1材料和仪器:小鼠骨髓间充质干细胞细胞株采购自中国科学院上海细胞库。主要仪器和试剂:DMEM培养基(低糖)、0.25%胰蛋白消化酶(Gibco/BRL)、胎牛血清(Hyclone公司);TrizolTM (Invitrogen公司);Rt-PCR相关试剂采购于赛默飞公司;慢病毒(上海吉玛公司);成骨诱导液、茜素红染料(美国Sigma公司);β-catenin及磷酸化β-catenin单克隆抗体、HRP标记山羊抗兔IgG二抗(美国Abcam公司);上海生工设计合成所有引物;二氧化碳培养箱(美国Thermo公司);倒置相差显微镜(日本Nicon公司);紫外分光光度计(美国Thermo公司);罗氏LightCycler96实时荧光PCR仪器。
1.2方法
1.2.1细胞培养:用含10%胎牛血清的DMEM培养基培养BMSCs,并置于5%CO2的37℃细胞培养箱,按1∶2进行传代,当细胞密度达70%~80%时。
1.2.2细胞转染:转染前12 h,将骨髓间充质干细胞(15×104个/孔)接种于6孔板中。用携带shRNA-NIPBL-/+、空载体慢病毒转染BMSCs,细胞中加入慢病毒(体积=感染复数×细胞数/慢病毒滴度)和5 μg/ml(polybrene)聚凝胺。培养12 h后用新鲜培养基换液。感染3 d后,用含2 μg/ml嘌呤霉素的新鲜培养基进行稳转细胞的筛选。接下来,每2天更换一次含有嘌呤霉素的培养基,直到对照细胞完全死亡。用绿色荧光蛋白(GFP)作为检测感染效率的标志物。在荧光显微镜下观察直到GFP表达的病毒转染效率达到85%以上,并扩大培养用于后续实验。
1.2.3实时荧光定量聚合酶链反应(qRT-PCR)检测BMSCs的NIPBL mRNA水平:首先建立分组,即空白组、空载体组、NIPBL沉默组,用Trizol试剂从骨髓间充质干细胞中提取总RNA,按照说明书逆转录合成cDNA。参数设置如下:42℃,60 min,70℃,5 min,4℃。此外,使用特异引物将cDNA用作扩增模板。见表1。根据制造商的说明,使用罗氏LightCycler96实时荧光PCR仪进行qRT-PCR。实验参数为:95℃保温2 min,95℃ 5 s,60℃ 20 s,循环30次,熔解阶段。用2-ΔΔCt法计算NIPBL mRNA的相对表达水平,以β-actin作为对照。
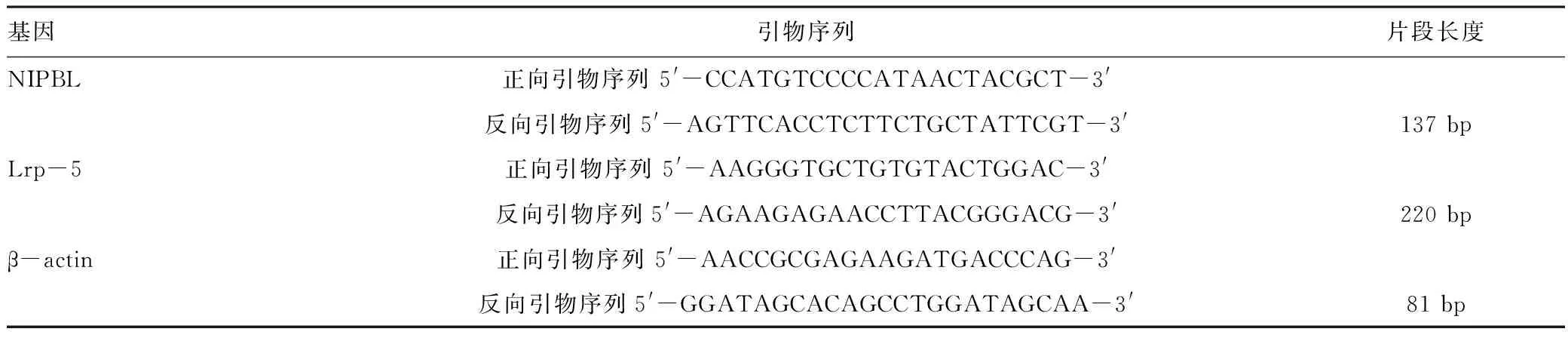
表1 RT-qPCR 引物序列
1.2.4成骨诱导:胰酶消化三组骨髓间充质干细胞,将细胞接种于6孔板并调整细胞密度为10×104/cm2继续培养,当密度达60%时用改用成骨诱导培养液培养,每间隔3 d全量换液,分别在第7天、第21天观察细胞形态。
1.2.5茜素红染色:成骨诱导第21天,移液器转移走6孔板中的成骨诱导液,并用PBS清洗3次,多聚甲醛2 ml固定细胞30 min后用PBS再次清洗3次,茜素红按1 ml/孔缓慢加入,静置30 min后吸去茜素红染料,PBS冲洗3次,显微镜下观察钙结节形成情况。
1.2.6qRT-PCR检测成骨诱导后Lrp-5 mRNA的表达:用Trizol试剂提取三组骨髓间充质干细胞总RNA,按照说明书逆转录合成cDNA。参数设置如下:42℃,60 min,70℃,5 min,4℃。此外,使用特异引物将cDNA用作扩增模板(表1)。根据制造商的说明,使用罗氏LightCycler96实时荧光PCR仪进行qRT-PCR。实验参数为:95℃保温2 min,95℃ 5 s,60℃ 20 s循环30 s,循环40次,熔解阶段。用2-ΔΔCt法计算Lrp-5 mRNA相对表达水平,以β-actin作为对照。
1.2.7Western印迹检测β-catenin蛋白的表达:将空白组、空载体组、NIPBL沉默组分别在相同条件下成骨诱导21 d,用RIPA裂解缓冲液提取三组细胞的总蛋白,总蛋白浓度用BCA法进行测定,使三组蛋白浓度一致。经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转至聚偏氟乙烯膜,用5%脱脂牛奶封闭的PVDF膜在5%BSA中室温孵育2 h,Tris-HCl缓冲盐+Tween(TBST)洗涤液漂洗4次。加入一抗,4℃孵育过夜,再漂洗4次,加入辣根过氧化物酶(HRP)标记的二抗体,室温孵育2 h,漂洗4次。用化学发光检测底物电化学发光(ECL)工作液显色,采用Image J图像分析系统对蛋白显影图进行灰度值分析,以GAPDH为内参,分析并比较三组β-catenin蛋白、p-β-catenin蛋白相对表达水平。
1.3统计学分析:使用Graphpad Prism9.0进行统计学分析,若各组间计量资料方差齐性且服从正态分布,采用单因素方差分析;若不服从正态分布或方差不齐,则选用秩和检验,P<0.05代表差异有统计学意义。
2 结果
2.1NIPBL基因沉默的骨髓间充质干细胞模型的建立及验证:分别用阴性空载体、NIPBL+/-慢病毒转染骨髓间充质干细胞,嘌呤霉素筛选后在荧光显微镜下观察转染效率。见图1。

注:a:空载体阴性慢病毒(GFP-BMSCs)转染BMSCs;b:NIPBL沉默组慢病毒(NIPBL-BMSCs)转染BMSCs图1 阴性空载体、NIPBL+/-慢病毒转染BMSCs
qRT-PCR验证NIPBL低表达,结果表明,BMSCs空白对照组和慢病毒阴性对照组NIPBL mRNA的表达量相当,两者差异无统计学意义(P>0.05)。沉默组NIPBL mRNA的表达与BMSCs空白对照组和慢病毒阴性对照组相比显著降低,差异有统计学意义(P<0.001)。见图2。
注:①P<0.001图2 RT-PCR检测BMSCs NIPBL mRNA水平
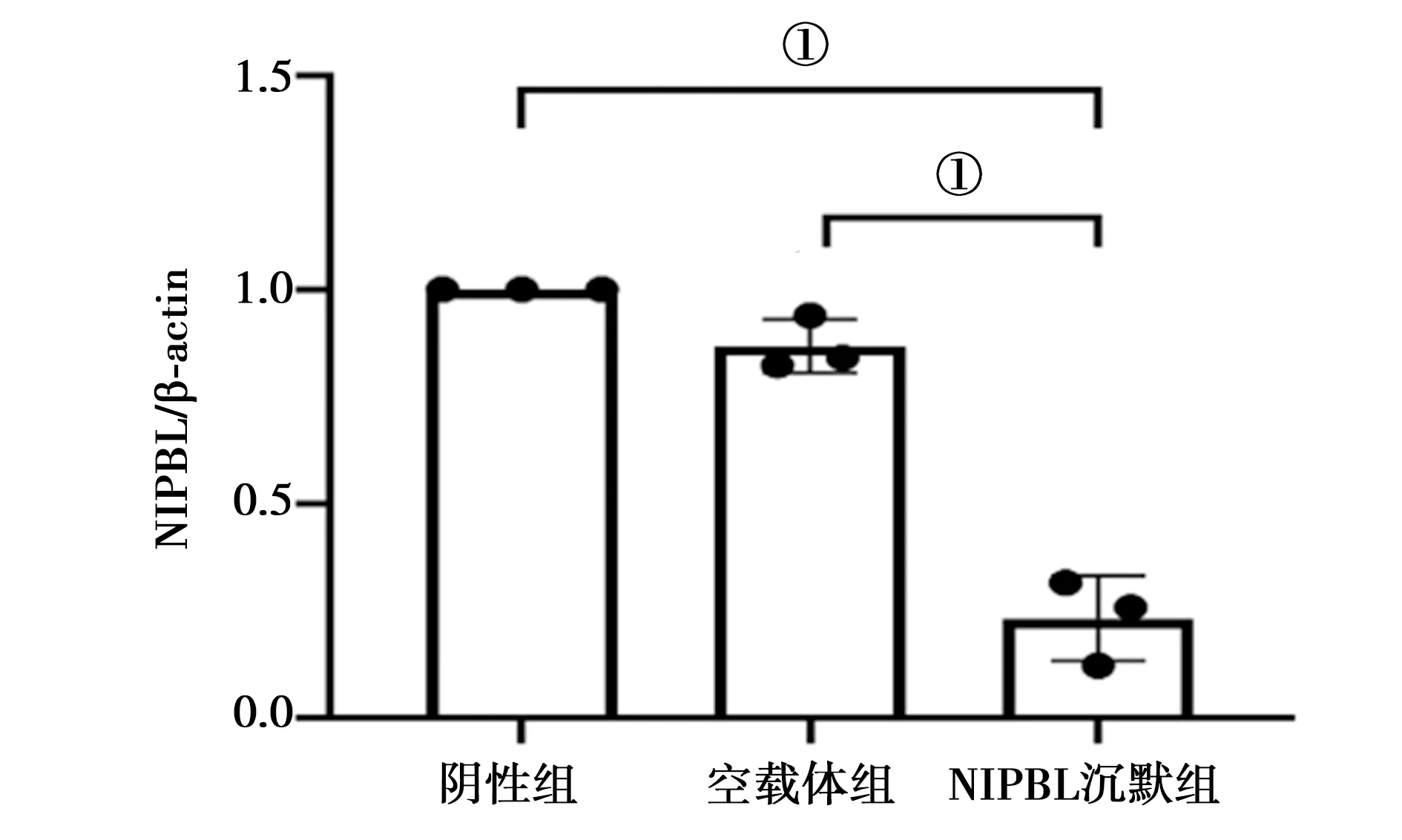
2.2三组小鼠骨髓间充质干细胞成骨诱导过程中形态学变化及诱导21 d钙颗粒的比较:三组细胞成骨诱导7 d时细胞逐渐变为不规则形,层次增加,贴合紧密,可见少量细胞结节;成骨诱导第21天三组细胞形态呈逐渐趋于圆形,有“鹅卵石” 样改变,但NIPBL沉默组细胞颗粒量较低;茜素红染色后显微镜下观察发现NIPBL沉默组的钙结节数量明显低于空白组、阴性组。见图3。
注:a空白组成骨诱导7 d、21 d及茜素红染色;b空载体组成骨诱导7 d、21 d及茜素红染色;c NIPBL沉默组成骨诱导7 d、21 d及茜素红染色图3 空白组、空载体组及NIPBL沉默组成骨诱导过程中细胞形态变化及茜素红染色
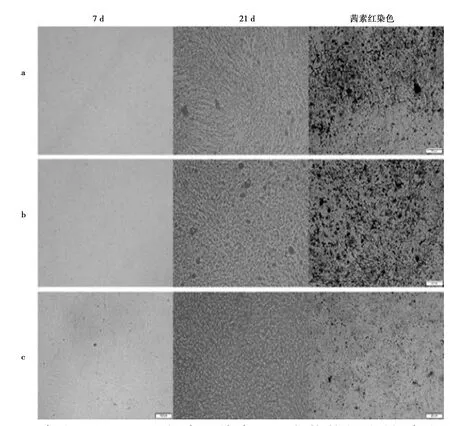
2.3沉默NIPBL基因可促进骨髓间充质干细胞β-catenin蛋白的磷酸化:NIPBL沉默组与空载体组、空白组比较,NIPBL沉默使磷酸化β-catenin水平显著升高(P<0.001)。但β-catenin总蛋白表达量显著下降,差异有统计学意义(P<0.001)。见图4。
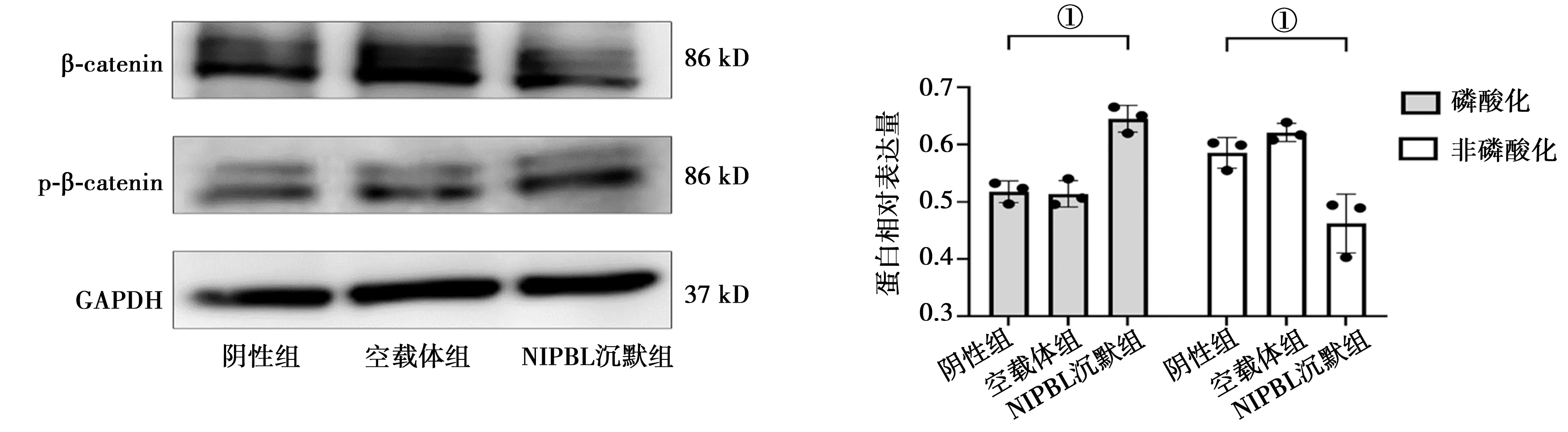
注:①P<0.001图4 三组骨髓间充质干细胞成骨诱导21 d时β-catenin、p-β-catenin蛋白的表达
2.4Wnt/β-catenin通路因子Lrp-5在三组间的表达情况:空白组和空载体组Lrp-5 mRNA的表达量相当,差异无统计学意义(P>0.05)。NIPBL沉默组的mRNA的表达与BMSCs空白对照组和慢病毒阴性对照组相比显著降低,差异有统计学意义(P<0.001)。见图5。

注:①P<0.001图5 RT-PCR检测骨髓间充质干细胞成骨诱导21 d时 Lrp-5 mRNA水平
3 讨论
CDLS是一种累及多系统尤以骨骼发育障碍最为显著的遗传性疾病并且影响儿童性格形成及心理健康发展,常表现为注意力缺陷、焦虑、自闭等[10]。CDLS在胎儿期间就开始发病[11],新生儿CDLS的患病率为1∶10 000~30 000,但这很可能是低估了,因为较轻的病例可能无法识别[12],因此对疾病的治疗往往出现滞后,而且需要长期多学科联合协作治疗,这将明显增加家庭的经济负担。
NIPBL突变是导致CDLS发病最为重要的机制,它通过影响Cohesin复合物在DNA上的附着和脱落,Cohesin复合物与染色质相互作用来维持染色体以及蛋白复合物的稳定结构,从而介导姐妹染色单体聚集和细胞远距离染色质相互作用,最终影响基因组修复和基因表达[13-15]。Maninder Kaur等[16]应用微滴式数字PCR技术发现与轻度患者和对照组相比,重度CDLS患者的NIPBL的表达水平较低,并且突变类型较严重患者的NIPBL水平也同样较低。前期本课题组已证实NIPBL+/-小鼠胚胎时期(E17.5 d~E18.5 d)要比野生型同胞小鼠身长缩短 18%~19%,但它们的胎盘尺寸大小无明显差异;同时,通过测量小鼠长骨及指骨发现骨长度缩短,而且有不同程度的骨化滞后。在剔除NIPBL 基因的小鼠胚胎的肢芽内软骨细胞区域被严重破坏,这均说明小鼠骨骼发育异常主要是由于NIPBL 突变导致[17]。本研究则进一步从细胞层面证实了NIPBL沉默的骨髓间充质干细胞的成骨分化能力明显降低,与成体形态学的研究结论一致。
Wnt通路通过调节细胞增殖、分化以及维持成体干细胞多能状态,参与动物发育和维持组织内稳态平衡[18],其中调节干细胞成骨分化是最为重要的作用之一[19]。β-catenin是Wnt/β-catenin通路的重要信号转导分子,通过进入细胞核内来调节基因转录,从而使各种靶激活因子表达,如果没有信号的刺激,β-catenin则通过磷酸化方式被降解[20]。本实验发现,NIPBL沉默会降低β-catenin蛋白的表达,增加β-catenin蛋白的磷酸化水平。同时Wnt/β-catenin通路的共受体Lrp-5 mRNA的表达量也下降。
综上,NIPBL沉默使β-catenin蛋白水平降低,但是β-catenin磷酸化蛋白的积累和总蛋白的降低只能间接表明β-catenin被抑制,本研究缺少NIPBL沉默而使β-catenin核转位的直接证据,β-catenin必须通过核转位来调控下游信号,从而发挥作用[21]。同时,Wnt/β-catenin通路的共受体Lrp-5 表达也有明显下降,因此本实验只能说明沉默NIPBL介导Wnt/β-catenin通路降低β-catenin的稳定性来抑制成骨形成。从NIPBL基因沉默导致骨骼发育异常为切入点,为德朗热综合征找到可能的治疗靶点,进而为CDLS骨骼发育异常的预防、治疗提供新的理论依据。
