响应面法优化二氢杨梅素口服纳米粒的制备工艺研究*
2022-09-23陆建媚黄理清麦琬婷覃裕翠苏晓丹张传政钟华帅曾勇珠黄秋洁
陆建媚,黄理清,麦琬婷,覃裕翠,苏晓丹,张传政,钟华帅,曾勇珠,黄秋洁,叶 勇,3△
(1.广西医科大学药学院,南宁 530021;2.广西中医药大学药学院,南宁 530001;3.广西生物活性分子研究与评价重点实验室,南宁 530321)
口服纳米制剂是现代生物医学技术领域的研究热点之一[1]。与传统的药物释放方法相比,纳米载体可以保护药物不受环境污染[2]。研究发现,二氢杨梅素(DMY)在抗肿瘤方面效果明显而且具备潜力开发为肝癌辅助用药[3]。口服纳米载药系统给药可以保护药物不受胃肠道生理环境所破坏,同时纳米粒(NPs)还能够快速穿透消化道的黏液层,促进肠上皮细胞的内吞,有利于克服口服吸收的多重屏障[4]。因此,为提高DMY 抗肝癌活性、提高其在胃肠道中的稳定性和进一步提高生物利用度,研究DMY口服缓释的纳米给药制剂。
近年来壳聚糖(CS)[5-8]和果胶(PEC)[9-10]作为一种天然安全的载体材料在口服NPs的研究中越来越受到关注。在本研究中,以DMY为模型药物,通过CS 质子化的-NH3+与PEC 质子化的-COO-,用三聚磷酸钠(STPP)为离子交换剂,发生离子交联,形成聚电解质复合物。该复合物可以抵抗胃液及小肠中蛋白酶的水解作用,负载载体的DMY 到达肠道后释放且黏附于结肠黏膜表面。使药物在结肠转运和停留的时间较长,减少了DMY 过早释放药效和临床疗效差的问题;提高了DMY的稳定性,进而提高DMY的生物利用度。
1 仪器与材料
1.1 仪器 1260 Infinity 高效液相色谱仪(安捷伦);Nano ZSMPT-2 纳米粒度电位仪(英国Malvern公司);JY92-IIDN 超声波细胞粉碎机(900 W,宁波新芝生物科技股份有限公司);B13-3型智能恒温定时磁力搅拌器(上海司乐仪器有限公司);DZF-300真空干燥箱(郑州长城科工贸有限公司);pH 计、十万分之一电子天平(梅特勒-托利多仪器有限公司);低速台式离心机(上海菲恰尔分析仪器有限公司)。
1.2 材料 DMY 对照品(成都瑞芬思生物科技有限公司,批号:Q-006-181218),DMY(长沙上禾生物科技有限公司);CS(上海阿拉丁生化科技股份有限公司,批号:L2004257);PEC(上海阿拉丁生化科技股份有限公司,批号:SLCG1374);氢氧化钠(成都市新都区木兰镇工业开发区,批号:20120202);无水乙醇(成都市科隆化学品有限公司,批号:2021091002);乙腈(赛默飞世尔科技有限公司,批号:206482);甲醇(赛默飞世尔科技有限公司,批号:204135);磷酸(重庆川东化工集团有限公司,批号:2021110801);三乙胺(天津市大茂化学试剂厂,批号:20210217);冰乙酸(成都市科隆化学品有限公司,批号:2017041301);盐酸(廉江市爱廉化试剂有限公司,批号:2020092201)。
2 方 法
2.1 色谱条件 Kromasil C18 色谱柱(250 mm×4.6 mm,5.0 μm);流动相∶乙腈—0.2%磷酸三乙胺(22∶78);流速:1.0 mL/min;柱温:25 ℃;检测波长:291 nm;进样量:20 μL。
2.2 溶液制备(1)对照品溶液的制备:精密称取1 mg DMY 对照品,置于5 mL 量瓶中,甲醇溶解并定容,得质量浓度为200 μg/mL 对照品溶液。(2)供试品CS-DMY-PEC-NPs的制备:精密量取CS-DMYPEC-NPs溶液1~5 mL,甲醇定容至刻度线,得供试品溶液。(3)阴性对照品CS-PEC-NPs的制备:取CSPEC-NPs 按供试品溶液配制方法制备阴性对照溶液。
2.3 专属性考察 分别将DMY 对照品溶液、CSDMY-PEC-NPs 溶液和CS-PEC-NPs 阴性对照溶液按“2.1 项”下方法进样测定,记录进样色谱图,结果表明,DMY 在供试品溶液和对照品溶液中出峰位置一致,样品中其他成分对DMY含量测定无干扰,见图1。
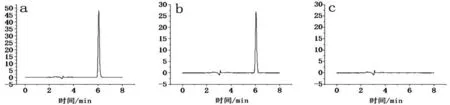
图1 HPLC色谱图
2.4 线性关系考察 精密称取DMY 1.00 mg,置于5 mL 容量瓶中,加入适量的甲醇溶解并定容,得200 μg/mL 的对照品母液,从母液中精密吸取适量的对照品溶液分别配置成1 μg/mL、2 μg/mL、4 μg/mL、8 μg/mL、16 μg/mL 系列质量浓度的溶液。在“2.1 项”色谱条件下进样,该色谱条件下,出峰时间约为6.5 min,以峰面积为纵坐标(Y),浓度为横坐标(X)进行线性回归,得回归方程为Y=43.808X-14.681(r=0.999 6),表明DMY在1~16 μg/mL线性关系良好。
2.5 精密度考察 低、中、高(2 μg/mL、6 μg/mL、12 μg/mL)3个浓度的DMY原料药溶液,在“2.1项”色谱条件下进样分析,每一浓度进样6次,记录峰面积,测得日内精密度(RSD)分别为1.04%、0.75%和1.44%;日间RSD分别为1.08%、0.99%、0.59%(n=6,连续6 d)。
2.6 重复性考察 按照“2.1 项”方法平行制备6 份样品溶液,进样记录峰面积,计算得CS-DMY-PECNPs的峰面积RSD值为2.38%,所以重复性良好。
2.7 NPs 的制备(1)CS-PEC-NPs 的制备:采用离子凝胶法制备,将PEC 和STPP 用纯水配制,用2%的醋酸配制CS并调至一定pH。随后在磁力搅拌锅中按照1 mL/min的速度匀速将STPP溶液和PEC溶液依次加入CS 溶液中,滴加完毕后搅拌30 min,通过离心收集NPs,实验重复3 次。(2)CS-DMY-PECNPs 的制备:载体溶液配制同上,称取适量DMY 溶解于无水乙醇中,在磁力搅拌锅中按照1 mL/min的速度匀速将STPP溶液、DMY溶液和PEC依次加入CS 溶液中,滴加完毕后搅拌30 min,通过离心收集NPs,实验重复3次。
2.8 CS-DMY-PEC-NPs包封率、载药量的测定
采用低速离心法测定CS-DMY-PEC-NPs 的包封率和载药量。将“2.7 项”制备的样品,在4 000 r/min离心20 min,取上清液,HLPC检测,计算游离浓度,结果为未被包封DMY质量,离心后沉淀物真空干燥后的重量为载药系统总质量。包封率=(DMY质量-未被包封DMY 质量)/DMY 总质量×100%,载药量=(DMY 质量-未被包封DMY 质量)/载药系统总质量×100%。
2.9 CS-DMY-PEC-NPs 粒径、聚合物分散性指数(PDI)和电位的测定 取“2.8 项”下离心后沉淀物真空烘干的样品,在酸性条件下重新分散后稀释至一定倍数,过膜后测定其粒径、PDI和电位。
2.10 单因素分析 在预实验的基础上,分别对CSDMY-PEC-NPs 的制备过程中影响包封率的6 个主要影响因素:不同的质量比(CS∶STPP∶DMY∶PEC)、PEC浓度、CS的pH值、CS浓度、TPP浓度、离心转速等进行逐一考察。
2.11 质量比考察 固定PEC、STPP、DMY 浓度为1 mg/mL,分别考察CS∶STPP∶DMY∶PEC 的质量比(2.1∶1∶1∶1、2.8∶1∶1∶1、3.5∶1∶1∶1、4.2∶1∶1∶1)对CS-DMY-PEC-NPs包封率、载药量和粒径的影响。
2.12 PEC 浓度考察 固定CS∶STPP∶DMY∶PEC的质量比为2.8∶1∶1∶1,STPP、DMY 浓度1.0 mg/mL,CS 浓度1.4 mg/mL,分别考察PEC 浓度1.0 mg/mL、2.0 mg/mL、3.0 mg/mL 和4.0 mg/mL 对CSDMY-PEC-NPs包封率、载药量和粒径的影响。
2.13 CS的pH值考察 固定CS∶STPP∶DMY∶PEC的质量比为2.8∶1∶1∶1,STPP、DMY 浓度1.0 mg/mL,CS 浓度1.4 mg/mL,分别考察CS 溶液的pH 值3.5、4.0、4.5 和5.0 对CS-DMY-PEC-NPs 包封率、载药量和粒径的影响。
2.14 CS 浓度考察 固定CS∶STPP∶DMY∶PEC 的质 量 比 为2.8∶1∶1∶1,PEC、STPP 和DMY 浓 度1.0 mg/mL,分别考察CS 浓度0.5 mg/mL、1.0 mg/mL、1.5 mg/mL 和2.0 mg/mL 对CS-DMY-PEC-NPs包封率、载药量和粒径的影响。
2.15 STPP 浓度考察 固定CS∶STPP∶DMY∶PEC的质量比为2.8∶1∶1∶1,PEC、DMY浓度1.0 mg/mL,CS 浓度1.4 mg/mL,分别考察STPP 浓度0.25 mg/mL、0.5 mg/mL、1.0 mg/mL 和1.5 mg/mL 对CSDMY-PEC-NPs包封率、载药量和粒径的影响。
2.16 离心转速考察 固定CS∶STPP∶DMY∶PEC的质量比为2.8∶1∶1∶1,PEC、STPP、DMY 浓度1.0 mg/mL,CS 浓度1.4 mg/mL,分别考察离心转速1 000 r/min、2 000 r/min、3 000 r/min 和4 000 r/min对CS-DMY-PEC-NPs包封率、载药量和粒径的影响。2.17 最优处方实验设计 根据响应面法,结合前期处方筛查单因素考察结果,选取对NPs 性质影响最大的3个因素进行响应面考察,获取最优处方。
3 结果
3.1 质量比的考察结果 结合粒径、包封率和载药量分析,CS∶STPP∶DMY∶PEC 的质量比2.8∶1∶1∶1是最佳条件,见表1。
表1 CS∶STPP∶DMY∶PEC的质量比对CS-DMY-PEC-NPs各指标的影响,n=3

表1 CS∶STPP∶DMY∶PEC的质量比对CS-DMY-PEC-NPs各指标的影响,n=3
3.2 PEC浓度的考察结果 结合粒径、包封率和载药量分析,PEC浓度1.0 mg/mL是最佳条件,见表2。
表2 PEC浓度对CS-DMY-PEC-NPs各指标的影响,n=3
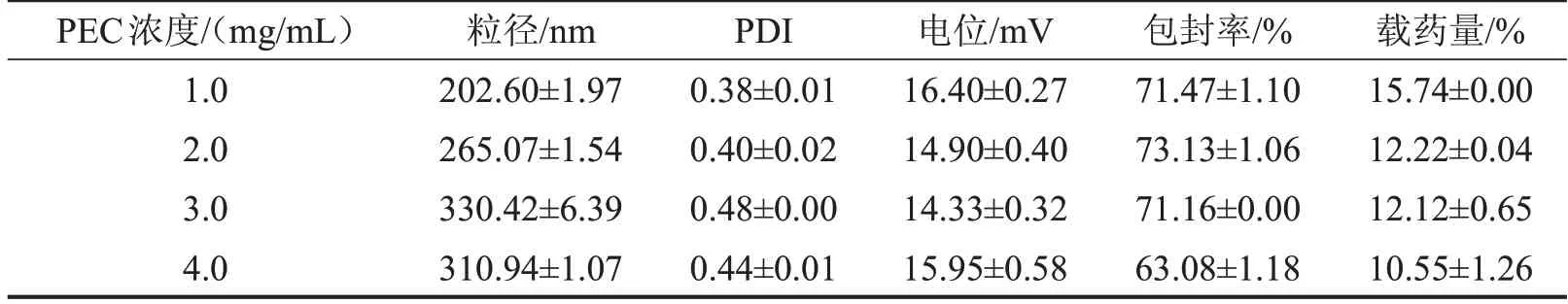
表2 PEC浓度对CS-DMY-PEC-NPs各指标的影响,n=3
3.3 CS的pH值的考察结果 结合粒径、包封率和载药量分析,pH值4.5是最佳条件,见表3。
表3 CS的pH值对CS-DMY-PEC-NPs各指标的影响,n=3

表3 CS的pH值对CS-DMY-PEC-NPs各指标的影响,n=3
3.4 CS 浓度的考察结果 结合粒径、包封率和载药量分析,CS浓度1.0 mg/mL是最佳条件,见表4。
表4 CS浓度对CS-DMY-PEC-NPs各指标的影响,n=3
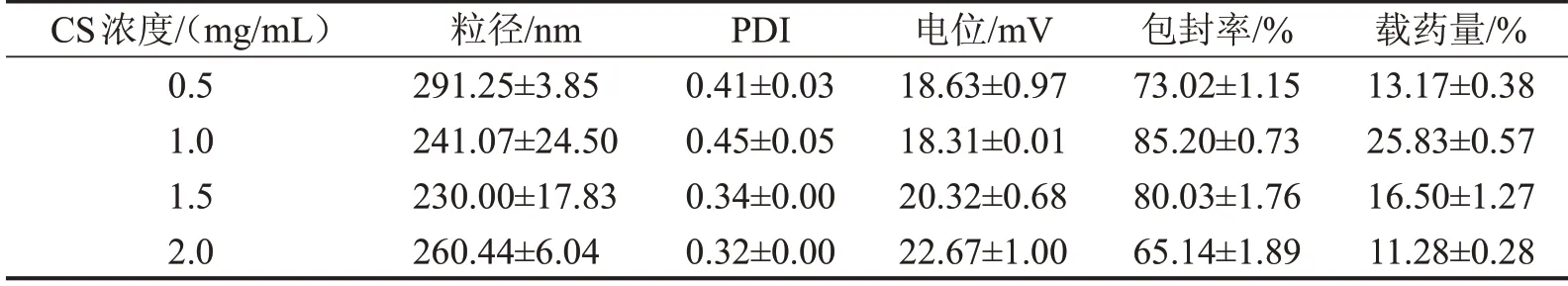
表4 CS浓度对CS-DMY-PEC-NPs各指标的影响,n=3
3.5 STPP 浓度的考察结果 结合粒径、包封率和载药量分析,STPP 浓度1.0 mg/mL 时是最佳条件,见表5。
表5 STPP浓度对CS-DMY-PEC-NPs各指标的影响,n=3
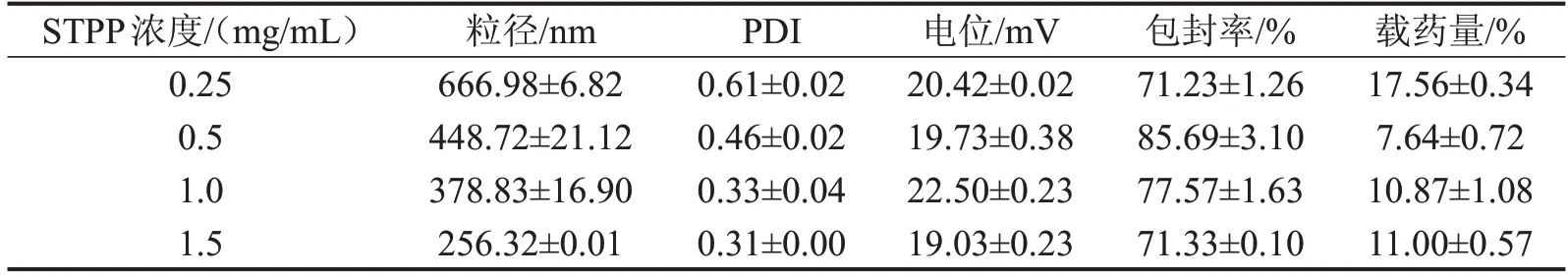
表5 STPP浓度对CS-DMY-PEC-NPs各指标的影响,n=3
3.6 离心转速的考察结果 结合粒径、包封率和载药量分析,离心转速2 000 r/min是最佳条件,见表6。
表6 离心转速对CS-DMY-PEC-NPs各指标的影响,n=3
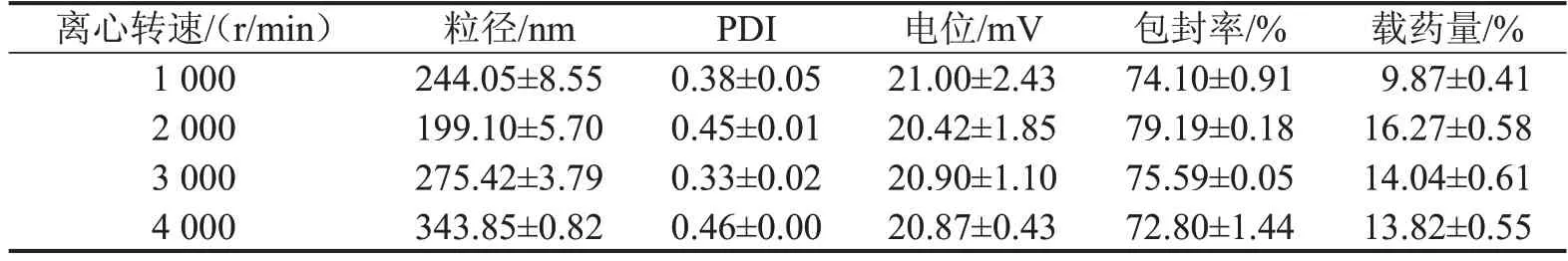
表6 离心转速对CS-DMY-PEC-NPs各指标的影响,n=3
3.7 响应面法得出最优处方 采用响应面法,以PEC 浓度(X1)、CS 的pH 值(X2)、离心转速(X3)为考察因素,在单因素考察的基础上,确定取值范围,PEC 浓度2.0~4.0 mg/mL,CS 的pH 值3.5~4.0,离心转速2 000~4 000 r/min。以包封率(Y1)、载药量(Y2)、粒径(Y3)为指标,按照“2.7项”下方法制备CSDMY-PEC-NPs,获取最适宜的纳米给药系统。因素水平见表7,实验设计见表8。

表7 响应面法试验因子水平
本试验有3个函数指标,所以将包封率、载药量和粒径归一化处理得出总评归一值(OD)值,并以OD 值为CS-DMY-PEC-NPs 的响应指标。从图2 中可以看出OD值三维响应面均为曲面。说明PEC浓度、CS的pH值、离心转速三者用量与OD值之间为非线性关系。计算过程:(1)包封率(d1)和载药量(d2)越大越好,dmax=(Mi-Mmin)/(Mmax-Mmin);粒径(d3)越小越好,dmax=(Mmax-Mi)/(Mmax-Mmin)(Mi 表示测量值,Mmin 表示最小值,Mmax表示最大值)。(2)各指标归一值算几何平均数,得总评归一OD 值,计算公式为(k 为指标数),见表8。
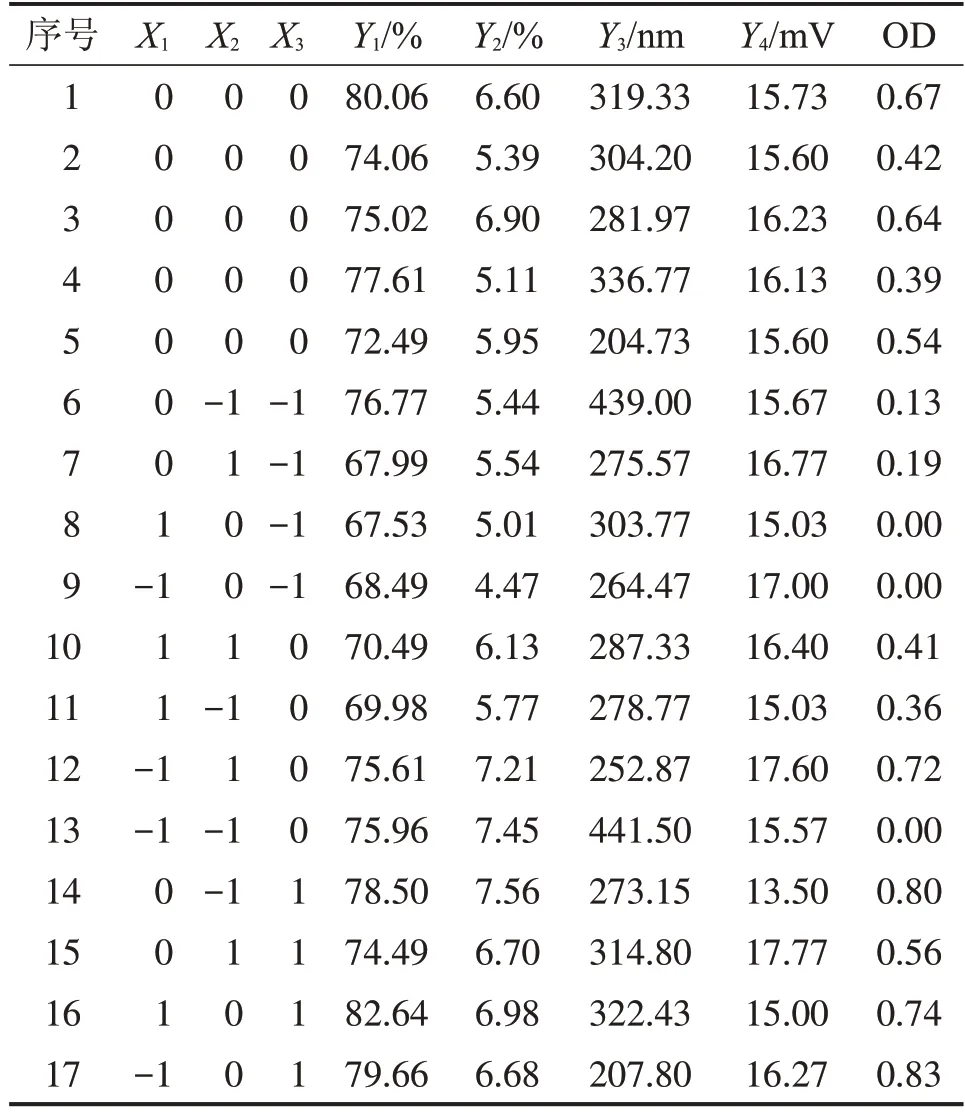
表8 CS-DMY-PEC-NPs的实验设计因素及结果
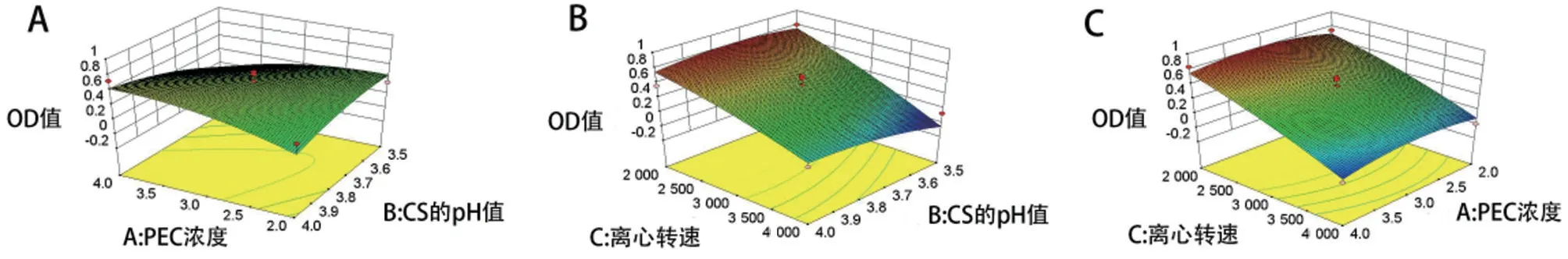
图2 CS-DMY-PEC-NPs处方优化中各因素交互作用的响应面图
采用Design-Expert 8.0.6.1 软件,以OD 值为因变量对各因素进行二项式拟合分析,拟合方程为:OD=0.53-0.005X1+0.074X2+0.33X3-0.17X1X2-0.022X1X3-0.075X2X3-0.094X12-0.066X22-0.046X32(R2=0.837 6,Radj2=0.628 7,P=0.040 3),二项式方程拟合时用相关系数R2表示,由拟合方程式得知此模型的拟合度较高,能很好地反映3 个考察因素与评价指标之间的关系。模型的确定系数为Radj2值,OD值Radj2值为0.628 7,表明响应值的变化有62.87%来源于3 个自变量的影响,方程的因变量与全体自变量间具有显著的线性关系。
对于响应指标OD值进行方差结果分析,从表9方差分析的显著性检验可知,模型P小于0.05 说明模型显著,表明单独或相互作用项之间没有显著差异。拟失项大于0.05,说明未知因素对模型干扰很小。
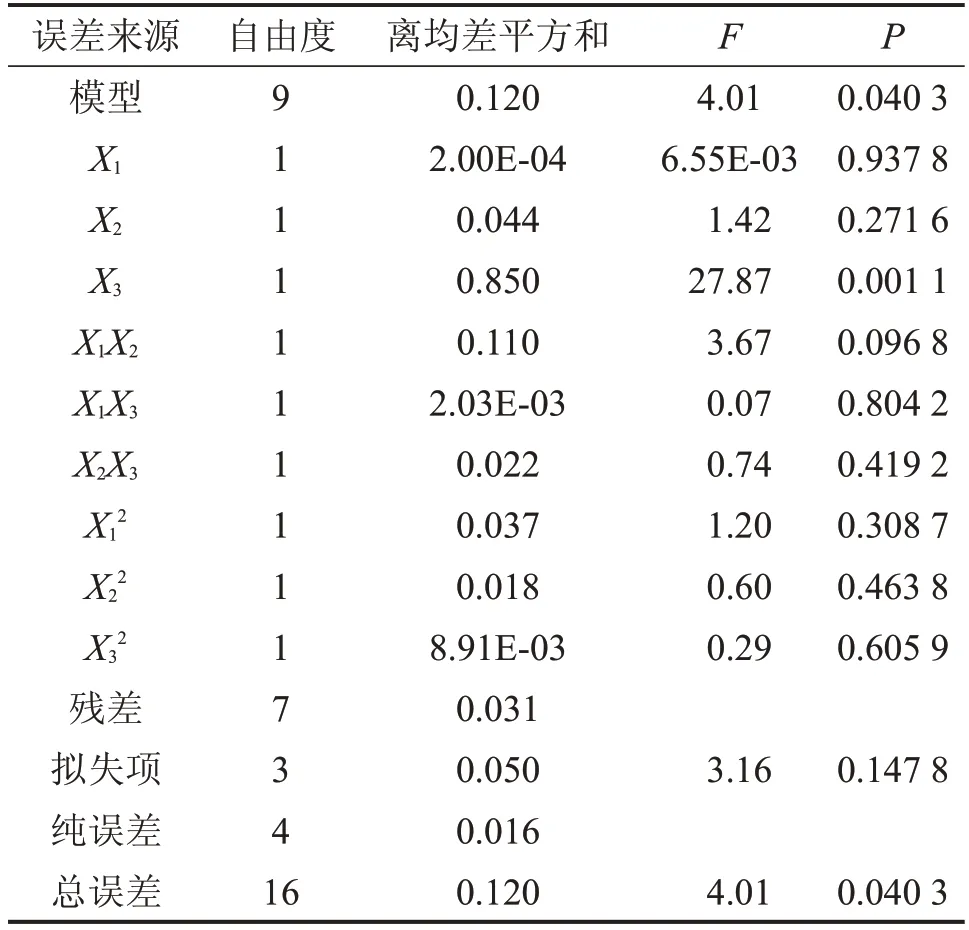
表9 OD值方差分析结果
3.8 工艺验证 平行制备并测定3 份CS-DMYPEC-NPs最优处方的包封率、载药量、粒径,并与预测值相比较,计算实际值与预测值的偏差,偏差=(预测值-实测值)/预测值×100%,见表10,实测值与预测值在误差范围内。实测包封率、载药量和粒径大小与预测值较为接近,证明应用响应面优化CSDMY-PEC-NPs 处方具有良好的预测性,可靠性较高。CS-DMY-PEC-NPs粒径分布图见图3。

图3 CS-DMY-PEC-NPs粒径图

表10 预测值与实测值的比较
4 讨论
离子凝胶法通过STPP 上带负电荷PO-Na-与CS上带正电荷质子化的-NH3+发生分子间和分子内交联而形成NPs[11],该法操作简单、作用时间短、工艺条件易得且所用试剂无毒[12],所以用该法研究制备的CS-DMY-PEC-NPs 没有毒副作用。本实验应用该法可在室温条件下制备出粒径大小均一、稳定的NPs。
响应面法可以建立二次多项式方程,利用多项式近似把因子与研究结果关系函数化,既可以保证实验准确度,还可以研究多种因素相互影响。从而获取了多个因素的最佳组合和整个区域的最佳响应值[13]。响应面法可以同时对实验的各个水平因素进行分析,具有良好的预测性。研究证明,采用响应面法进行处方优化,得到的预测值与理论值较接近,说明建立的模型预测性较好。本实验在单因素的基础上,通过响应面法对CS-DMY-PEC-NPs处方进行优化,对结果进行二项式拟合分析以及二维、三维效应面,并在最优区域筛选出最佳处方范围值,得到最佳的制备工艺。
CS 是一种阳离子聚合物。由于其具有生物降解性、生物相容性、生物靶向性、生物粘附特性和渗透性增强等特性,已成为纳米药物载体的研究热点[14]。PEC 是一种阴离子可溶性多糖,从植物的初生细胞壁中提取。PEC可以完整地通过上消化道,并被肠道菌群分解。PEC 在结肠的碱性pH 值下是一种粘稠的粘合剂[10]。然而,单独使用时,PEC在碱性条件下会膨胀,这可能导致药物负荷过早释放。当与其他聚合物结合使用时,会产生更稳定的基质。因此,使用PEC 和CS 作为载体,以限制DMY在较高pH 值下的过早释放,确保在肠道条件下改善黏液黏附性。此外,PEC 容易被结肠微生物降解,这将确保DMY 从复合聚合物基质中局部释放。所以在本研究中用传统的CS作为纳米药物载体以及STPP作为交换剂制备NPs外,还增加了PEC作为纳米药物载体。为后续用CS-PEC作为载体包载药物达到靶向肠道菌群奠定实验基础。
在后续研究中,还对CS-DMY-PEC-NPs的质量表征及体内外的药效、药动及安全性进行深入研究,为其新剂型的开发与应用奠定基础。
