超声造影联合血清促甲状腺激素检测对甲状腺微小结节的诊断价值
2022-09-23王静,杨超,王刚,曹冰
王 静,杨 超,王 刚,曹 冰
(徐州市肿瘤医院,徐州 221000)
甲状腺病变早期多为结节性病变,甲状腺微小结节采用高分辨率的超声作为临床检查的主要手段[1]。对于甲状腺影像报告和数据系统(TI-RADS)4 类结节,临床上普遍通过超声引导及细针穿刺活检来明确病灶良、恶性,但结节直径≤1 cm时仍存在一定争论,特别是TI-RADS 4 类微小结节。目前临床上推行促甲状腺激素(TSH)检测,其可提高甲状腺功能障碍诊断的灵敏度。TSH由垂体分泌,是一种敏感激素,能够刺激甲状腺细胞的发育、合成和其他生理功能,与甲状腺结节癌变有着密切的相关性,但TSH 检测存在一定的局限性[2]。超声造影(CEUS)在鉴别甲状腺结节良、恶性方面的效果已得到临床医生普遍认可,超声定量分析能够通过结节周围信号强度分布判断甲状腺结节良、恶性,肿瘤组织血流量越大,恶性风险越高[2-4]。本研究旨在分析超声参数联合血清TSH 水平检测对甲状腺微小结节的诊断效能,并与术后病理检查结果进行对比,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取2019 年1 月至2021 年2 月在徐州市肿瘤医院接受手术治疗的94 例甲状腺微小结节患者,均经超声诊断为TI-RADS 4类微小结节,其中男45例,女49 例;年龄20~76 岁,平均(40.18±2.86)岁;甲状腺结节直径0.4~1.0 cm,平均(0.64±0.18)cm。所有患者均行甲状腺超声检查、超声引导下甲状腺细针穿刺活检、液基薄层细胞学检查及病理检查。排除其他器官恶性肿瘤患者。
1.2 研究方法 血清TSH 检测:抽取患者静脉血,离心,取血清,采用DXI800免疫分析仪及配套试剂进行TSH浓度检测,操作严格按照试剂盒说明书进行。TSH正常参考值为0.35~5.5µIU/mL。
PHILIPS EPIQ 5 超声诊断仪器(探头配备5~12 MHz)。TI-RADS 分级及造影检查操作方法:患者取仰卧位,暴露颈部,行常规超声检查,记录结节超声特征(位置、大小、回声、形态、边界、有无微钙化及纵横比)。参考TI-RADS 分级标准[5]对结节进行分级。怀疑为4 类结节进行CEUS 检查,切面选择结节最大径,且结节周边有足够正常腺体进行对比,固定探头,经肘静脉团注入2 mL 造影剂,5 mL生理盐水进行冲管。动态观察造影过程并记录结节增强强度,同时按下计时键和动态存储按钮,保存阴影图像。
由两位有5年影像工作经验医师对存储视频数据进行分析,同时采用设备的系统软件对结节进行定量分析,建立时间—强度曲线,记录并计算超声参数,包括上升时间(RT)、平均渡越时间(MTT)、峰值降半时间(TPH)、上升斜率(WIS)、达峰时间(TTP)、峰值强度(PI)、曲线下面积(AUC)。
1.3 统计学方法 采用SPSS 22.0统计软件进行数据处理,计量资料以均数±标准差()表示,两组独立样本间比较采用t检验;计数资料以百分率表示,率的比较采用χ2检验;采用受试者工作特征(ROC)曲线分析CEUS 参数及血清TSH 检测对于结节良、恶性的诊断效能,以P<0.05为差异有统计学意义。
2 结果
2.1 病理结果 94例患者中共检出166个结节,其中良性组63例(良性结节108个),结节性甲状腺肿58 个,桥本结节26 个,肉芽肿性甲状腺炎24 个;恶性组31例(恶性结节58个),甲状腺乳头癌44例,滤泡状腺癌5个,髓样癌5个,未分化癌4个。
2.2 两组患者TSH 水平比较 良性组血清TSH 水平为(5.23±0.74)µIU/mL,显著低于恶性组(5.80±0.76µIU/mL(t=5.335,P=0.021)。
2.3 良、恶性甲状腺微小结节患者的超声参数比较 良性组与恶性组甲状腺微小结节患者RT、MTT、TPH、WIS、TTP 比较,差异均无统计学意义(均P>0.05);良性组PI低于恶性组,AUC高于恶性组(均P<0.05),见表1、图1、图2。
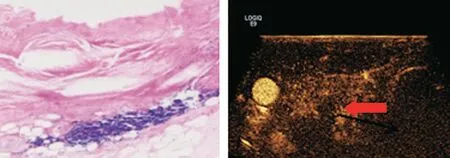
图1 CEUS为微小甲状腺良性结节
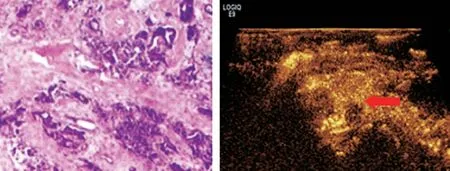
图2 CEUS为微小甲状腺恶性结节
表1 良、恶性甲状腺微小结节患者的超声参数比较

表1 良、恶性甲状腺微小结节患者的超声参数比较
2.4 CEUS 联合血清TSH 检测结果与术后病理诊断结果的符合率对比分析 以病理诊断结节性质为金标准,PI联合TSH检测结果显示:良性组118个病灶(误诊10个),恶性组48个病灶(误诊10个),诊断符合率为87.80%;AUC联合TSH检测结果显示,良性组116个病灶(误诊8个),恶性组50个病灶(误诊8 个),诊断符合率为90.25%;PI、AUC 联合TSH检测结果显示,良性组109个病灶(误诊1个),恶性组57 个病灶(误诊1 个),诊断符合率为98.79%。PI、AUC 联合TSH 诊断符合率高于PI联合TSH、AUC联合TSH(χ2=13.129,P=0.001),见表2。

表2 CEUS 联合血清TSH 诊断结节良、恶性与术后病理诊断结果的符合率比较
2.5 ROC 曲线分析 PI联合TSH 诊断结节良、恶性的准确率为69.43%、灵敏度为72.48%,特异度为76.81%,ROC 曲线下面积为0.694(0.484~0.819);AUC联合TSH诊断结节良、恶性的准确率为73.18%、灵敏度为75.63%,特异度为78.09%,ROC曲线下面积为0.732(0.386~0.891);PI、AUC 联合TSH 诊断结节良、恶性的准确率为82.93%、灵敏度为84.98%,特异度为86.11%,ROC 曲线下面积为0.829(0.432~0.917)。PI、AUC 联合TSH 诊断甲状腺微小结节良、恶性的ROC 曲线下面积大于PI联合TSH、AUC联合TSH,三者联合检测的准确率、灵敏度和特异度高于PI联合TSH、AUC联合TSH,见图3。
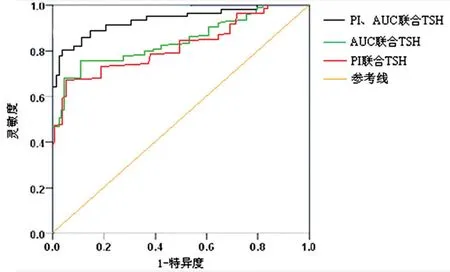
图3 CEUS参数PI、AUC联合血清TSH诊断结节良、恶性的ROC曲线图
3 讨论
微甲状腺恶性病变时各周围组织性生长的滋润,缺乏典型的恶性特征。常规临床诊断方法不能有效地鉴别甲状腺微小结节的良、恶性。TSH是临床甲状腺功能鉴别的敏感指标,即使在甲状腺微小结节病变引起的功能障碍诊断中也具有较佳的灵敏度[5-7]。本研究结果显示,良性组与恶性组血清TSH水平存在明显差异,提示血清TSH检测是诊断甲状腺微小结节良、恶性的敏感指标,与前述文献报道结果相符。
穿刺法也是诊断甲状腺病变致病性的有效方法,但受到有创性、甲状腺小结大小、部位等影响,限制了其临床应用[8]。近年来,临床上利用超声图像对甲状腺结节进行定量分析,提高了甲状腺结节良、恶性程度判断准确率。恶性甲状腺有相对致密的微血管分布,良性甲状腺有相对较少的微血管;恶性甲状腺易发生坏死,微血管可能被癌性损伤堵塞,阻碍血管循环;微血管破坏区域血小板,导致血栓形成和纤维化组织生长,增加管壁内侧不平整度,使得造影剂在管腔内流速减慢;恶性甲状腺的血液供应更为丰富,使造影剂运动更为顺畅,新生血管数量较多,而新生血管管壁薄,其内皮与基质膜不完整,细胞间隙大,使癌细胞更容易侵入微血管发生恶性病变[9-10]。研究表明,超声参数PI、AUC能够反映良、恶性甲状腺微小结节血管数量和血液流动通畅性[10-11]。本研究亦发现,良性组与恶性组甲状腺微小结节患者的超声参数PI、AUC 差异明显。以术后病理检查结果作为金标准,超声参数PI、AUC联合TSH鉴别诊断符合率高于单独PI或AUC联合血清TSH 的诊断符合率,且超声参数PI、AUC联合TSH检测对于甲状腺微小结节良、恶性的诊断准确率、灵敏度和特异度均高于单独PI或AUC 联合血清TSH检测。提示CEUS参数PI、AUS联合血清TSH水平检测可提高甲状腺微小结节良、恶性的诊断效能。
值得一提的是,本研究在确定TSH微小甲状腺结节(PI、AUS)的特征时,仍有一种良性微小甲状腺结节被归类为恶性,分析原因可能与微甲状腺结节密度有关,微甲状腺结节密度高时,超声图像质量下降,导致超声测量不准确,也可能与节点的位置有关。
综上所述,CEUS 参数(PI、AUS)联合血清TSH检测能够有效鉴别甲状腺微小结节良、恶性,可作为病理检查重要辅助手段,提高了临床甲状腺微小结节良、恶性诊断能力,有助于临床及早制订治疗决策。
