宫颈上皮内瘤变发生风险预测模型的建立与评价*
2022-09-23庞博华阳长永
梁 漫,庞博华,阳长永,王 鹤
(广西医科大学附属肿瘤医院妇瘤科二区,南宁 530021)
宫颈癌是最常见的女性生殖道恶性肿瘤,目前其发病率排在女性恶性肿瘤第4位[1],并呈现出上升和年轻化趋势,严重影响女性的生理及心理健康。宫颈癌病因研究一直是国内外研究的热点。目前较为明确的是持续性的人类乳头瘤病毒(HPV)感染是造成宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)及宫颈癌的关键病因[2]。目前研究中,我国在不同地区和不同人群中的HPV16感染率基本上都是最高的。在中国大陆目前感染率排在前5 位HPV 亚型分别是HPV16、HPV52、HPV58、HPV53、HPV18[3]。女性阴道微生态由阴道的解剖结构、微生态菌群、局部免疫系统及机体的内分泌调节功能共同组成,是动态平衡的微生态系统[4]。阴道局部能够通过增强局部自身的抗肿瘤免疫功能,来延缓或者阻止肿瘤的发生,其不仅受到阴道微生态平衡的影响,也受其黏膜免疫防御系统、局部免疫细胞以及其分泌的细胞因子的调节。本研究对单纯HPV16、HPV18、HPV52、HPV58阳性患者其阴道微生态、阴道灌洗白细胞介素(IL)-2、IL-10免疫因子及CD4+或CD8+T 细胞水平进行检测,对比分析HPV16、HPV18、HPV52、HPV58感染相关的宫颈病变对对阴道微生态及局部免疫状态的影响及分析相关的危险因素,最终建立相关的CIN发生风险预测模型并进行验证,为临床改变阴道微环境及局部免疫状态、降低CIN 发生风险及CIN 的早诊早治提供新思路。
1 资料与方法
1.1 研究对象
选取2018 年6 月至2020 年6 月在广西医科大学附属肿瘤医院妇瘤科行宫颈癌筛查或因宫颈病变就诊的患者行HPV 检测,最终选取单纯HPV16、HPV18、HPV52、HPV58 阳性的患者共155 例,其中HPV16、HPV18、HPV52、HPV58 阳性患者分别为88 例、14 例、33 例和20 例,同期选取HPV 阴性患者71 例为阴性对照。以上患者均在初诊时常规进行阴道微生物检测及阴道灌洗。病例纳入标准:(1)经高危型人乳头状瘤病毒(HR-HPV)检测结果为单纯HPV16、HPV18、HPV52、HPV58 阳性或HPV 阴性;(2)年龄18~72 岁;(3)既往有性生活史,非月经期、非妊娠期及非哺乳期妇女;(4)月经干净超过3 d;(5)取材前3 d内无性生活、无妇科检査、无阴道冲洗及阴道内用药;(6)近1 个月无抗生素服用史;(7)未用免疫抑制剂或激活剂。排除标准:(1)年龄小于18岁或大于72岁;(2)无性生活史;(3)处于月经期、妊娠期、哺乳期;(4)取材前3 d 内有性生活、妇科检査、阴道冲洗及阴道内用药;(5)近1 个月有抗生素服用史;(6)使用免疫抑制剂或激活剂;(7)高血压、糖尿病、免疫系统疾病及其他恶性肿瘤等病史者;(8)曾接受如淋巴结切除术、脾切除术等损害机体免疫功能的手术治疗者;(9)曾接受化疗、放疗及免疫系统治疗者。本研究已取得本院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2 标本采集
1.2.1 阴道微生态检测 患者取膀胱截石位,利用不涂润滑剂的阴窥器暴露阴道,先用精密pH 试纸接触阴道壁,30 s 后取出,与标准色板比较读取pH值。检测出阴道pH值;常规于阴道侧壁中上1/3处取分泌物涂片,用于检查霉菌、线索细胞、乳酸杆菌、滴虫等微生物。
1.2.2 阴道局部免疫因子及T细胞亚群的检测
用一次性10 mL无菌注射器取5 mL生理盐水,冲洗阴道后穹窿及宫颈部,回吸收集阴道灌洗液大约5 mL,存放于无菌离心管内,离心10 min(2 000 bpm),收集上清液采用酶联免疫吸附试验(ELISA)法检测IL-2、IL-10、CD4+及CD8+的检测,并在-20°C冰箱保存,避免反复冻融,并计算CD4+/CD8+比值。
1.2.3 HPV 检测 采用HPV 检测专用取样工具在宫颈口处取样并保存于样品管内,送往检验中心检验。
1.2.4 宫颈病变检查 对以上患者选取经病理学检查或宫颈液基脱落细胞学检査确定宫颈病变程度。
1.3 统计学方法
采用SPSS 26.0 统计软件及R3.6.2 软件进行数据分析。计量资料以均数±标准差()表示,两组均数比较采用t检验,多组间均数比较采用方差分析,两两比较采用SNK-q检验。计数资料以频数或百分率(%)表示,组间比较采用χ2检验。CIN 危险因素应用单因素及多因素向前逐步Logistic 回归,应用R3.6.2软件中的rms建立预测模型并制作列线图(nomogram)。通过受试者工作特征曲线(receiver operating characteristic curve,ROC)评估预测模型的区分度;运用校准曲线实现(bootstrap 1 000 次抽样)评估预测模型预测概率与实际概率的一致性;临床决策曲线分析(decision curve analysis,DCA)评估预测模型的临床适用性。以P<0.05为差异有统计学意义。
2 结果
2.1 根据HPV16、HPV18、HPV52、HPV58 感染情况进行分组的阴道微生态检测结果
各组间阴道中pH≤4.5、乳酸杆菌、滴虫、霉菌、线索细胞比较,差异均无统计学意义(P>0.05),见表1。

表1 HPV16、HPV18、HPV52、HPV58感染的阴道微生物状态检测结果分析
2.2 根据HPV16、HPV18、HPV52、HPV58 感染情况进行分组的的阴道局部免疫因子及T细胞亚群分析
HPV16(+)组、HPV52(+)组中IL-2 水平低于HPV(-)组(P<0.05);HPV16(+)组中IL-10 水平高于HPV(-)组(P<0.05);HPV16(+)组IL-10 水平高于HPV58(+)组(P<0.05);HPV16(+)组、HPV58(+)组中CD4+低于HPV(-)组(P<0.05),见表2。
表2 HPV16、HPV18、HPV52、HPV58感染的阴道局部免疫状态检测结果

表2 HPV16、HPV18、HPV52、HPV58感染的阴道局部免疫状态检测结果
与HPV(-)组比较,aP<0.05;与HPV16(+)组比较,bP<0.05。
2.3 根据宫颈病变情况分组的阴道微生物状态及HPV检测结果
CIN 组HPV(+)检出率高于慢性炎症组(P<0.05)。CIN组阴道pH(≤4.5)阳性检出率低于慢性炎症组(P<0.05);CIN组乳酸杆菌、滴虫、线索细胞与慢性炎症组比较差异无统计学意义(P>0.05),见表3。

表3 宫颈病变的阴道微生物状态及HPV检测结果
2.4 根据宫颈病变情况分组的阴道局部免疫检测结果
CIN 组阴道局部免疫因子IL-2、CD4+、CD4+/CD8+比值低于慢性炎症组,IL-10 高于慢性炎症组(P<0.05);CIN 组CD8+与慢性炎症组比较,差异无统计学意义(P>0.05),见表4。
表4 宫颈病变的阴道局部免疫状态检测结果
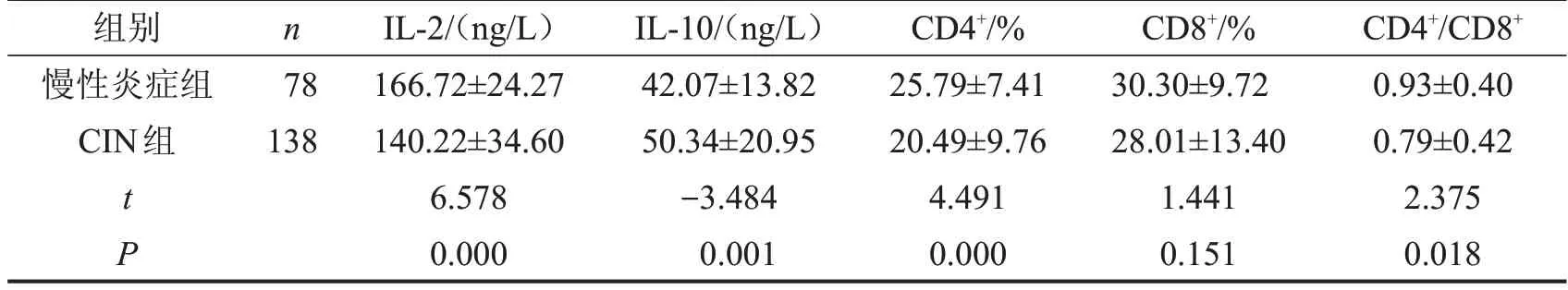
表4 宫颈病变的阴道局部免疫状态检测结果
2.5 阴道微环境及阴道局部免疫状态中导致CIN的危险因素分析结果
纳入HPV、IL-2、IL-10、CD4+、CD4+/CD8+比值等构建多因素Logistic回归方程,结果发现,HPV感染(P=0.000)、IL-2 降低(P=0.000)、IL-10 升高(P=0.001)、CD4+低表达(P=0.029)是CIN发生的危险因素;而CD4+/CD8+比值对CIN 发生无明显影响(P=0.881),见表5。
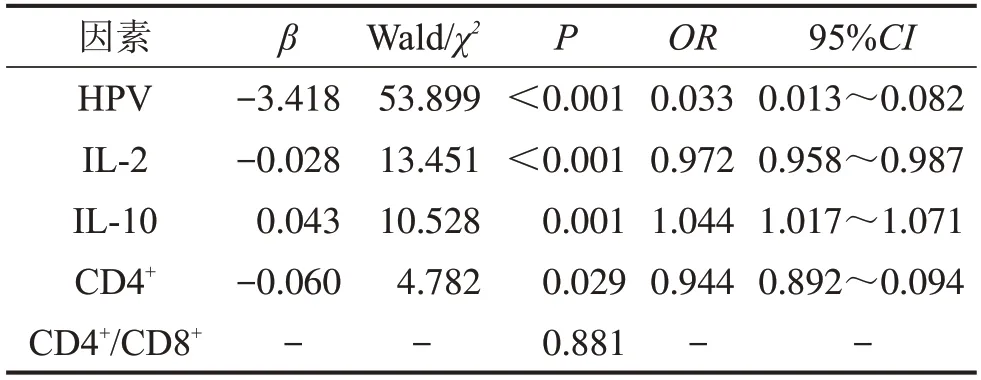
表5 CIN的多因素Logistic危险因素分析结果
2.6 基于阴道微生态及局部免疫相关的CIN 发生风险预测模型的建立
通过多因素采用向前逐步Logistic 回归,得出的具有显著统计学意义的4 个预测因素HPV(+)、IL-2、IL-10、CD4+纳入、建立并绘制CIN发生风险预测模型,以列线图模型呈现,见图1。
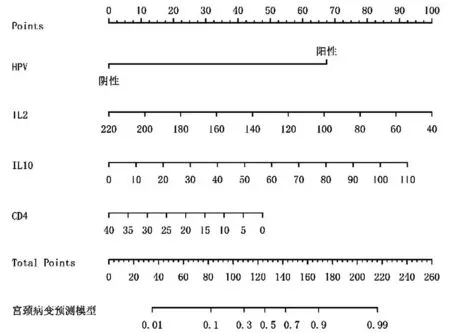
图1 CIN发生风险列线图模型
2.7 模型的预测性能评估
绘制ROC 曲线,结果见图2,ROC 曲线下面积(AUC)为0.920,95%CI(0.882~0.958)超过0.9,表明该模型对于CIN 发生风险的预测能力有较高准确性。校准曲线为斜率接近于1 的直线,表明CIN的实际发生风险和预测的可能性之间有很好的相关性(图3)。此外,霍斯莫—莱梅肖检验拟合度(hosmer and lemeshow test)方法来检验模型的拟合优度,当P>0.05,认为当前数据中的信息已经被充分提取,模型拟合优度较高,当P<0.05,则模型校准度差,表明实际观测值与模型预测值之间存在一定差异。本模型Hosmer-Lemeshow 的检验水准P=0.4831 也表明此次预测模型的拟合优度较高,与理想模型比较,差异无统计学意义(P<0.05)。
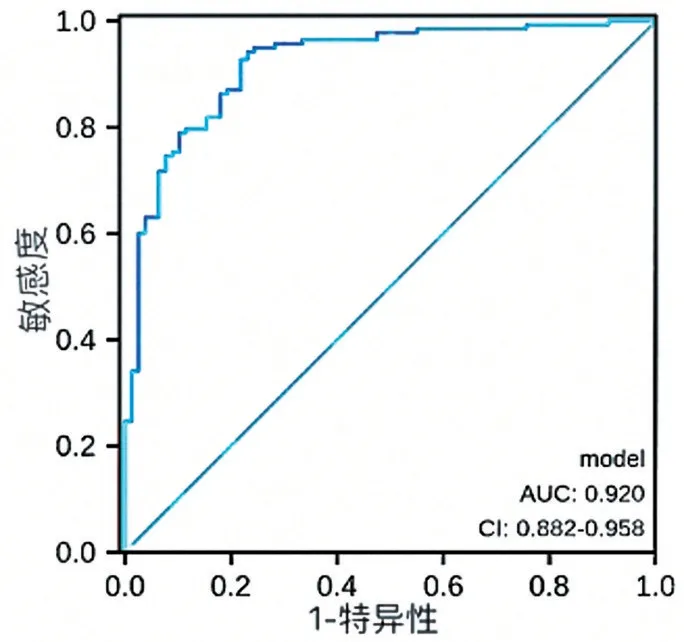
图2 列线图模型的ROC曲线及AUC
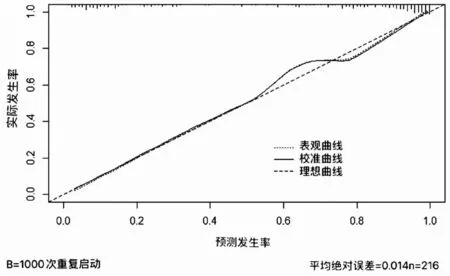
图3 列线图模型的校准曲线
2.8 模型的决策曲线分析
通过计算模型的净效益,应用决策曲线分析评估预测模型的临床价值及临床适用性(图4)。从图4 中可知,在阈值范围内(横坐标)该预测模型的净获益率曲线(红线)均在两条极端线(黑线和灰线)的上方,即表明该预测有较大的阈值以及较好的临床适用性。因此,本决策曲线分析显示:在相同阈概率(横坐标)下,使用当前研究中的列线图(红线)来预测CIN 发生风险要比极端曲线(黑线和灰线)策略更获益。
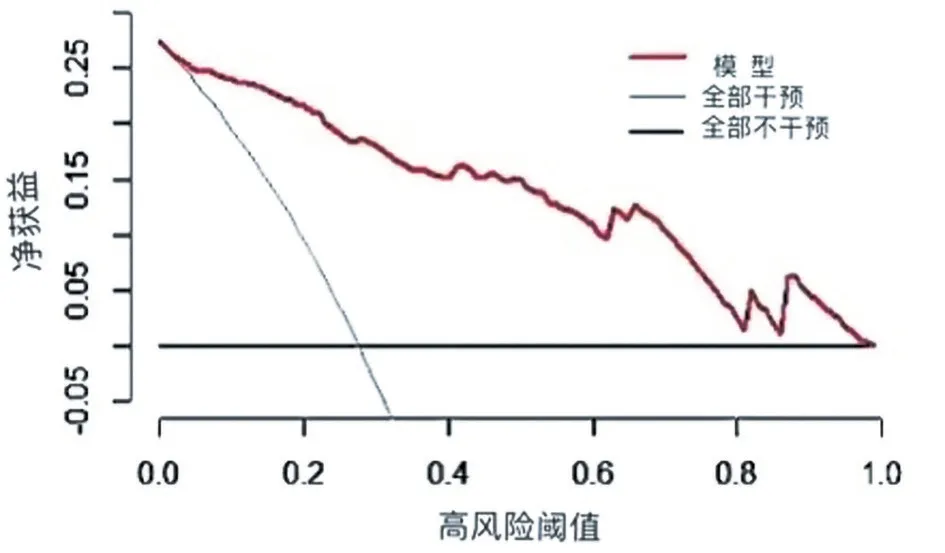
图4 列线图预测CIN的临床决策曲线
3 讨论
本文通过研究目前感染率较高的HPV 亚型HPV16、HPV18、HPV52、HPV58 对局部阴道微生态及局部阴道免疫状态的相关性,建立CIN风险预测模型并进行评价。本研究结果显示CIN组HPV(+)检出率较慢性炎症组高,多因素分析也证实HPV感染是CIN发生的危险因素,目前认为持续HPV感染是导致CIN及宫颈癌的关键病因。HPV通过感染、整合、癌变参与宫颈病变的发生、发展[4]。与既往研究中认为持续性HPV 感染是CIN 主要病因相一致[2]。
本研究中CIN 组阴道pH(≤4.5)阳性检出率低于与慢性炎症组,说明阴道pH 值的升高可能导致正常宫颈向CIN 转变。Curty 等[6]研究表明,女性阴道中以乳酸杆菌为优势菌种能够促进HPV 的清除及减少宫颈病变的发生。另外,也有研究表明阴道,pH 值的升高是CIN 发生的危险因素[7]。Norenhag等[8]的系统回顾和荟萃分析提示,阴道中的乳酸杆菌与HPV感染显著相关。
本研究中结果显示,HPV16(+)组、HPV52(+)组IL-2 水平低于HPV(-)组,HPV16(+)组、HPV58(+)组IL-10 水平高于HPV(-)组,HPV16(+)组IL-10 水平高于HPV58(+)组。Th2 细胞型因子如IL-4、IL-10 在肿瘤患者体内处于优势地位,HPV 感染后导致宫颈组织向Th2细胞偏移发生偏移导致Th1/Th2失衡,使IL-2等Th1细胞型因子等合成减少,IL-4、IL-10 等Th2 细胞型因子合成增加[9]。本研究结果显示,在HPV16、HPV18、HPV52、HPV58 这4 个亚型感染导致阴道局部Th1/Th2 免疫平衡也向Th2细胞偏移明显。另外,本研究结果也表明,IL-2、IL-10是诱导宫颈病变的重要因子,在感染HPV 后,会出现免疫抑制的情况,表现为IL-2 水平降低,IL-10水平升高[10],这与Westrich 等[11]研究相一致。本研究证实IL-2 降低、IL-10 升高是CIN 发生的危险因素。
本研究结果显示,HPV16(+)组、HPV58(+)组中CD4+水平低于HPV(-)组;CIN 组阴道局部CD4+、CD4+/CD8+水平低于慢性炎症组。这与唐清华等[12]报道的结果相一致。CD4+/CD8+作为T 细胞亚群,在调节细胞免疫反应以及维持机体免疫平衡方面具有重要作用。本研究中,HPV16、HPV58 感染主要表现为CD4+细胞的缺陷;而CIN组阴道局部CD4+、CD4+/CD8+水平低于慢性炎症组,说明CD4+的低表达及CD4+/CD8+的比例失衡,可导致宫颈免疫应答的减弱,从而导致宫颈向CIN的转化。同时本研究结果表明CD4+低表达是CIN 发生的独立危险因素。
在临床研究中,临床预测模型是精准医学研究的重要工具[13]。本研究建立了基于4 个预测因素HPV(+)、IL-2、IL-10、CD4+的CIN发生风险预测列线图模型。对该模型的预测效能验证表明:列线图的AUC=0.920,超过0.9,表明该模型对于CIN 发生风险的预测能力有较高准确性;校准曲线为斜率接近于1 的直线,表明实际CIN 发病率和预测的可能性之间有很好的相关性。本模型Hosmer-Lemeshow 的检验水准P=0.4831 也表明此次预测模型的拟合优度较高,和理想模型没有统计学差异。并且临床决策曲线结果显示,在相同阈概率下,使用当前研究中的列线图来预测CIN 发生风险要比极端曲线策略更获益说明该预测模型具有临床适用性。以上验证表明,本文建立了一个预测效能良好的CIN发生风险预测模型。陈娴等[14]研究中确定吸烟史、TCT、HPV、阴道镜影像诊断、病变面积/宫颈面积预测因子建立CIN2+的列线图预测模型具有良好的区分度与精确度。
综上所述,本研究建立的CIN 预测模型具有良好的预测效能。但由于该模型是基于单中心、回顾性数据,并且仅做了内部验证,缺乏外部的验证集及前瞻性数据的验证,因此,本预测模型仍存在一定的局限性,未来应开展联合多中心的前瞻性研究对该模型进行验证,进一步评估其稳定性并投入到临床的工作中。
