PKA-CREB-BDNF通路在异丙酚诱导大鼠海马远期学习记忆功能障碍中的作用研究*
2022-09-23魏艳妮余小凡
魏艳妮,邹 敏,余小凡
(重庆市开州区人民医院麻醉科,重庆 405400)
发育期的大脑非常脆弱,容易受到全身麻醉剂的影响[1]。临床研究表明,暴露于全身麻醉剂的新生儿和婴幼儿在青少年时期更容易出现学习和认知功能障碍[2-3]。异丙酚(2,6-二异丙基苯酚)是一种烷基苯酚衍生物,具有起效快和可完全恢复等优点,普遍认为其是理想的静脉全身麻醉剂,并常规用于儿童麻醉的诱导和维持。然而,研究发现,新生儿暴露于异丙酚会诱导发育中的大脑神经元凋亡和显著的远期学习记忆障碍[4]。这些证据引起了人们对小儿异丙酚麻醉安全性的密切关注。蛋白激酶A(protein kinase A,PKA)在中枢神经系统中普遍表达并介导细胞内信号转导,其对神经元分化、存活、功能和可塑性以及远期学习和记忆机制有重要影响[5]。据报道,PKA 抑制剂会损害啮齿动物的远期记忆,这意味着PKA 对远期记忆的形成至关重要[6]。cAMP 反应元件结合蛋白(CREB)是PKA 的下游靶点,被称为“记忆开关”,在被蛋白激酶磷酸化后激活,与突触可塑性和记忆形成有关[7]。且pCREB 级联反应的上调已得到证实可改善啮齿动物对行为任务的学习和记忆能力[8]。脑源性神经营养因子(BDNF)是CREB 的下游靶基因之一,既往研究发现,BDNF对CREB的调控具有活性依赖性,其表达参与神经元发育、突触可塑性和神经保护[9],在学习和远期记忆的形成中发挥重要作用[10]。因此,本文旨在研究异丙酚可能通过PKA-CREB-BDNF 信号通路在发育大脑中诱导神经元凋亡,并在成年后引起显著的学习和记忆障碍。
1 材料与方法
1.1 实验动物与分组
选用SPF级7日龄SD大鼠140只,雌雄各半,体重平均10~12 g,孕鼠购自北京维通利华实验动物技术有限公司。新生大鼠与母鼠放置在同一笼内,保持在(25±2)℃和12 h 光—暗周期交替的标准生活条件下(从07:00~19:00 光照),直到出生后第7 天。采用随机数字表法将7 日龄鼠分为5 组(n=28):对照组、脂肪乳剂组(10%,10 mL/kg)、异丙酚低剂量组(50 mg/kg)、异丙酚中剂量组(100 mg/kg)和异丙酚高剂量组(200 mg/kg)。
1.2 主要试剂材料
Fluoro-Jade B(FJB)染色试剂盒(Histo-Chem,Jefferson,美国);小鼠单克隆抗神经元核抗原(NeuN)抗体(Cell Signaling Technology,美国);BCA蛋白浓度检测试剂盒(碧云天,中国);抗PKA 抗体(Cell Signaling Technology,美国);抗pCREB 抗体(Abcam,美国);抗BDNF 抗体、抗GAPDH 抗体(Santa Cruz,美国)。
1.3 实验方法
药物均通过腹腔注射,异丙酚的计量浓度参考已发表研究选择[11]。对照组大鼠不给予任何处理,脂肪乳剂组给予10%脂肪乳10 mL/kg 剂量腹腔注射,异丙酚组大鼠均每30 min给予50 mg/kg剂量的异丙酚腹腔注射,直至目标累计剂量。翻正反射丧失作为引起无意识和睡眠的指标,秒表记录翻正反射消失和恢复的时间。麻醉期间,所有幼鼠置于加热装置中,直肠温度保持在(37±1)℃;使用脉搏血氧仪监测氧饱和度,并保持在95%左右。
1.4 动脉血气分析
麻醉结束后,用32号注射器从左心室获取动脉血(100 μL),用血气分析仪进行分析。采血后立即测量动脉氢离子浓度(hydrogen ion concentration,pH)、动脉二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)、动脉氧分压(arterial partial pressure of oxygen,PaO2)和动脉氧饱和度(arterial oxygen saturation,SaO2)。该过程在5 min内完成。
1.5 FJB染色检测变性死亡神经元数目
用10%水合氯醛对大鼠进行深度麻醉,立即取出大脑,4%多聚甲醛固定过夜。将冷冻的脑组织连续切成4 μm厚的冠状切片。60 ℃玻片加热器上干燥3~4 h后,在无水乙醇、80%乙醇、70%乙醇和蒸馏水(distilled H2O,dH2O)中浸泡,转入0.06%高锰酸钾溶液10 min,dH2O 清洗2 min,避光浸入0.001%FJB 溶液30 min。dH2O 清洗3 次,每次1 min,室温晾干,中性树脂封固。使用倒置显微镜,绿色(450~490 nm)激发光和屏障滤光片,在不同大鼠切片的相似位置获取CA1区域图像。
1.6 Morris水迷宫(MWM)实验
采用MWM 测试系统对65 只大鼠在异丙酚暴露8 周后进行学习记忆测试。将一个装满水[深度25 cm,温度(24±2)℃]的水迷宫水池(直径160 cm,高50 cm)中加入黑色无毒墨水,使水不透明,水池由2条穿过中心的假想垂直线分为4个相等的象限(I、Ⅱ、Ⅲ和Ⅳ)。第I象限设定为目标象限,1 个可移动的黑色圆形平台(直径12 cm)位于中心位置。利用位于水箱中心上方的摄像机和计算机动物追踪系统监测和转播图像。9 周龄时,首先训练大鼠定位清晰标记的平台(可见平台,第1天),并从预设起点(平台浸入水面下2 cm,第2~6 天)单独随机放入面向池壁的水中。起始位置在设备周边的4 个等距点之间变化。后续试验中,随后的起点以顺时针方式进行。平台位置保持不变,允许大鼠游90 s或直到它们找到平台。在每次试验中测量到达平台的时间,并在每个训练日取平均值。未能在90 s 内找到平台的大鼠被手动引导到平台并停留10 s后,放回笼内。每次试验之间间隔5 min。训练第7 天,测量撤除平台后大鼠空间记忆保留情况。将大鼠放入水里并允许在与目标象限相对的象限中单独游泳90 s。测量大鼠游过平台所在位置的频率。
1.7 NeuN免疫组化分析
将脱蜡和重新水化的切片在高温高压下(10 min,0.1 M柠檬酸盐缓冲液,pH6.0)进行抗原修复,并用3%H2O2孵育以阻断内源性过氧化酶。dH2O和PBS洗涤后,4°C 抗NeuN(1∶1 000)一抗免疫标记过夜。PBS 清洗后,室温下将切片与二抗混匀(10 min),PBS 冲洗。用3,3’-二氨基联苯胺(diaminobenzidine,DAB)对切片进行可视化,并用苏木精进行反染色,在荧光显微镜上成像。DAB阳性细胞的整体光密度(integrated optical density,IOD)通过Image-Pro Plus 6.0分析。
1.8 透射电镜观察海马神经元和突触的超微结构
MWM测试后,成年大鼠(n=3)用10%水合氯醛深度麻醉,取出海马组织,2.5%甲醛(4°C)固定2 h,冰PBS 清洗3 次,每次15 min,转移到2%OsO4PBS溶液中,避光固定2 h。PBS清洗后,室温下脱水,用50/50 Araldite-Epon(Embed-812)/环氧丙烷混合物浸渍过夜,再用新鲜的Araldite-Epon 混合物浸渍6 h,转移到充满Araldite-Epon 混合物的盒中,60 ℃下保持48 h(2.66~3.33 kPa)。在Ultracut E 超微切片机上使用cryotrim 45金刚石刀将组织块修剪成包含CA1明胶层的梯形。用钻石刀切成超薄切片(厚度≈50 nm),安装在Formvar涂层槽栅上,用1%乙酸铀酯染色45 min,Reynolds柠檬酸铅染色3 min。在透射电子显微镜下拍照记录。
1.9 Western blotting 检测PKA-pCREB-BDNF 相关蛋白表达
处死实验大鼠后,采集海马区标本并立即置于冰PBS 中。4 ℃条件下,加入蛋白裂解缓冲液和蛋白酶抑制剂,用匀浆器研磨海马组织。裂解1 h,4 ℃、12 000 r/min离心20 min。BCA法检测样本蛋白含量,煮沸变性。应用SDS-PAGE 凝胶对40 µg总蛋白进行电泳。湿转将蛋白转移至PVDF 膜上,5%脱脂牛奶封闭非特异性蛋白2 h,置于稀释的抗PKA 抗体(1∶1 000)、抗pCREB 抗体(1∶500)或抗BDNF 抗体(1∶1 000)中4 ℃过夜,TBST 洗3 次后,与辣根过氧化物酶二抗(1∶5 000)室温孵育1 h。采用ECL 化学发光法显示蛋白条带,Image-Pro Plus 6.0进行灰度分析。
1.10 统计学方法
采用SPSS 26.0 软件对数据进行统计分析,计量资料以均数±标准差()表示。动脉血气、FJB染色、Western blotting 和免疫组化检测组间比较采用单因素方差分析(one-way ANOVA),后进行Dunnet's post hoc 检验。MWM 试验数据用重复测量双因素方差分析,然后用Bonferroni 多重比较检验进行对比。以P<0.05为差异具有统计学意义。
2 结果
2.1 5组动脉血气分析比较
5 组间pH 值、PaCO2、PaO2和SaO2比较,差异均无统计学意义(P>0.05)。说明各组大鼠均无代谢或呼吸窘迫异常。
表1 5组动脉血气分析比较n=5,
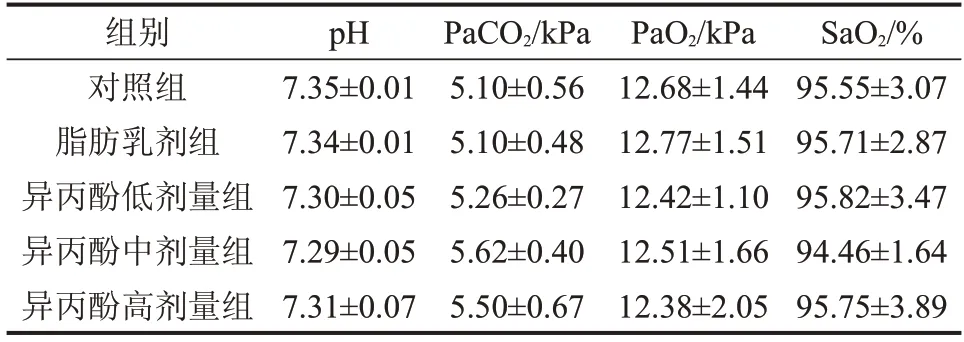
表1 5组动脉血气分析比较n=5,
2.2 异丙酚诱导新生大鼠海马的神经元细胞凋亡
如图1A 所示,与对照组相比,异丙酚诱导新生大鼠海马的FJB阳性细胞增加;与低剂量组相比,接受中和高剂量异丙酚注射的大鼠显示出更多的FJB阳性细胞(P<0.05)。对FJB 阳性细胞的定量分析表明,异丙酚(50 mg/kg、100 mg/kg和200 mg/kg)可引起剂量依赖性的神经凋亡(图1B),而对照组和脂肪乳剂组的FJB 阳性细胞数量较少,两组比较差异无统计学意义(P>0.05)。
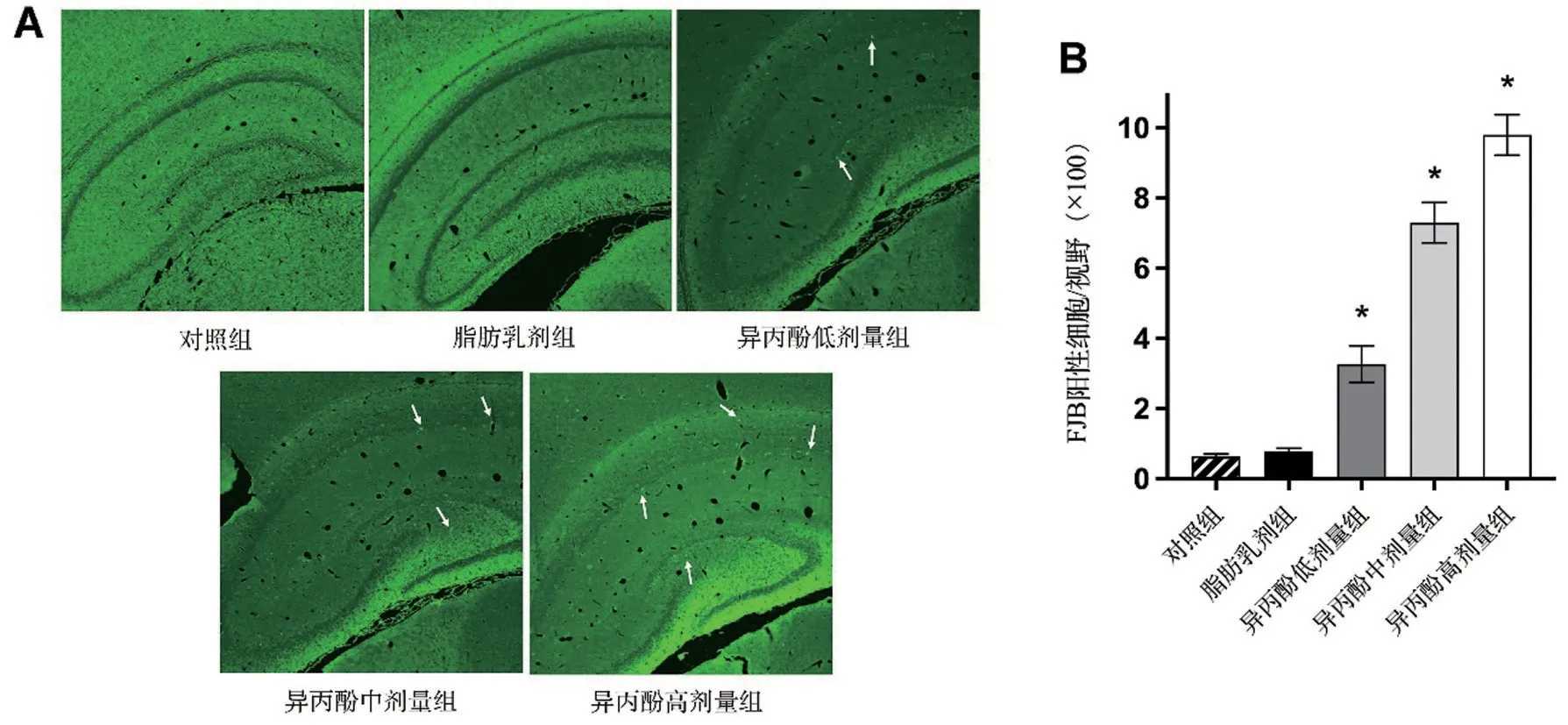
图1 异丙酚暴露后新生大鼠(7日龄)海马FJB染色(n=5)
2.3 异丙酚可诱导大鼠成年后空间学习和记忆障碍
MWM试验第1天所有大鼠均在边缘游动以寻找逃生机会,大多数大鼠找不到平台,且5组大鼠的平均逃逸潜伏期比较,差异无统计学意义(P>0.05)。从第2~6天,异丙酚组大鼠的逃逸潜伏期长于对照组(P<0.05),见图2A;跨越原平台位置的次数减少(P<0.05),见图2B。尤其是异丙酚中浓度组比其他两个剂量的影响更严重,平台跨越次数减少更明显(P<0.05)。脂肪乳剂组与对照组比较,差异无统计学意义(P>0.05)。
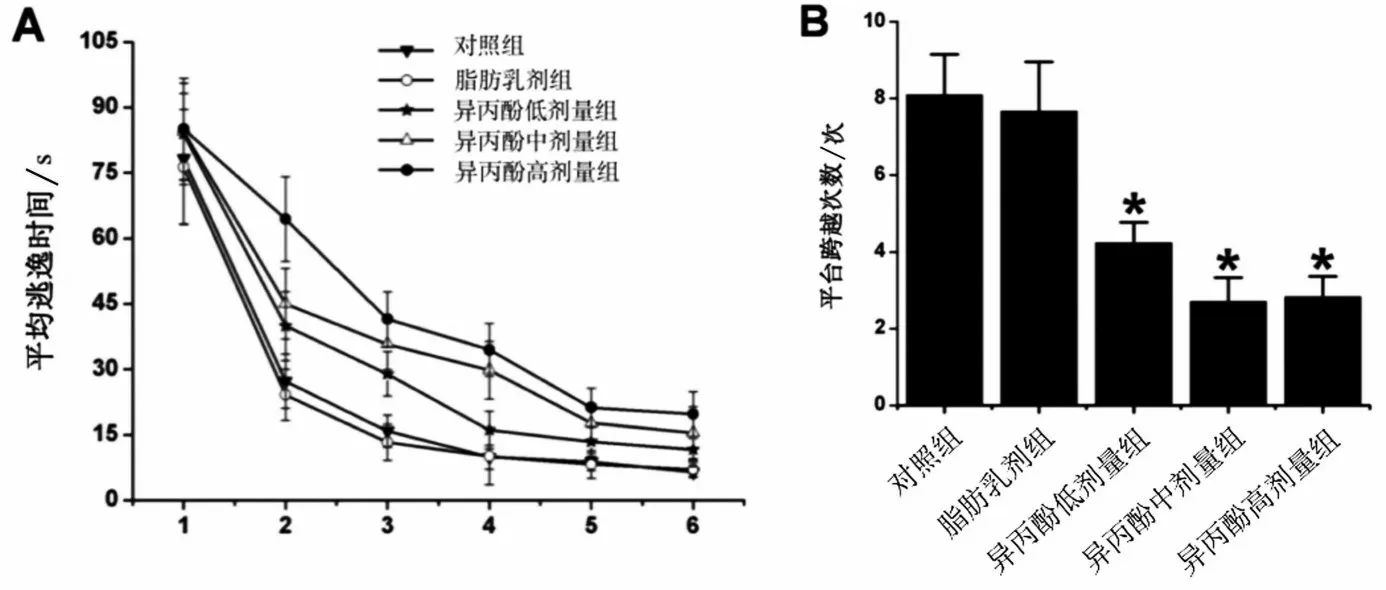
图2 新生大鼠暴露于异丙酚诱发成年后的空间学习和记忆障碍(n=13)
2.4 异丙酚诱发成年大鼠海马区神经元的损失
MWM 试验结束后,在海马CA1 区检测NeuN阳性细胞的数量(图3A),通过测量IOD对NeuN阳性细胞进行定量分析(图3B)。结果发现,对照组和脂肪乳剂组之间NeuN阳性细胞数量比较无显著差异(P>0.05)。然而,与对照组相比,新生大鼠异丙酚处理(50 mg/kg、100 mg/kg 和200 mg/kg)可引起成年后海马区成熟神经元减少(P<0.05)。

图3 新生大鼠暴露于异丙酚诱发成年期海马的神经元损伤(n=5)
2.5 异丙酚损害了海马CA1 区神经元和突触的超微结构
透射电镜结果显示,异丙酚组大鼠可观察到海马神经元的核膜收缩、核染色质凝缩和边缘化(P<0.05),见图4A 和图4C。而且,异丙酚处理的大鼠海马神经元线粒体数量减少,部分线粒体肿胀并有紊乱的嵴膜,见图4B和图4D,与对照组和脂肪乳剂组相比,异丙酚处理大鼠的突触结构发生了改变,部分突触结构紊乱,一些突触裂隙变得更宽,突触囊泡减少,以及突触前膜和突触后膜的部分融合(P<0.05)。上述病理变化在对照组和脂肪乳剂组中并不明显(P>0.05)。
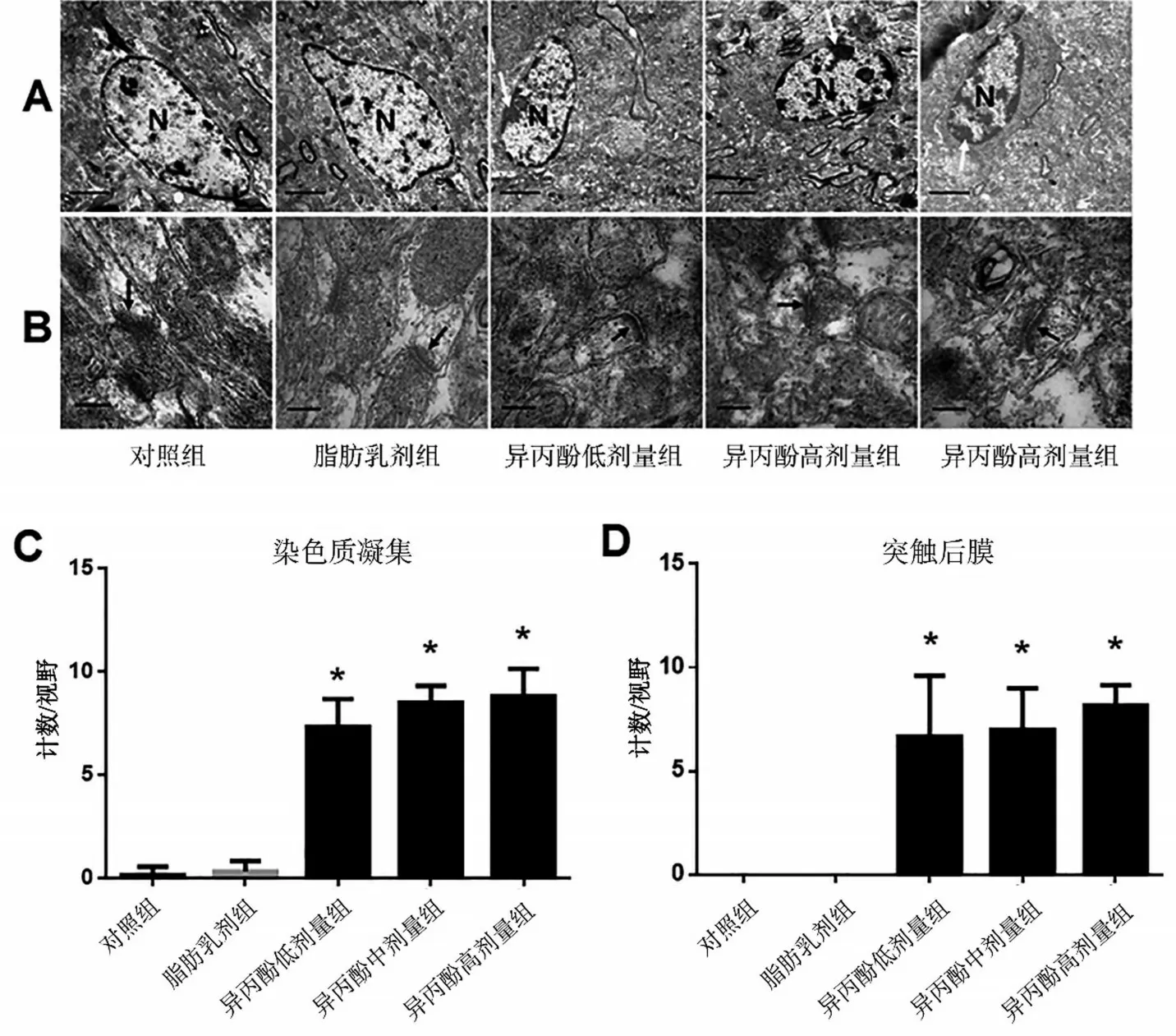
图4 新生大鼠暴露于异丙酚会损害海马CA1区神经元和突触超微结构
2.6 异丙酚对新生大鼠和成年大鼠海马区PKACREB-BDNF信号通路均有抑制作用
麻醉后2 h以及MWM试验结束后,对5组大鼠的海马PKA、pCREB 和BDNF 蛋白表达进行Western blotting分析。麻醉2 h后,异丙酚组7日龄和成年大鼠海马区的PKA、pCREB和BDNF蛋白表达水平均低于对照组(均P<0.05),但无剂量依赖性;对照组和脂肪乳剂组之间无统计学差异(P>0.05),见图5。
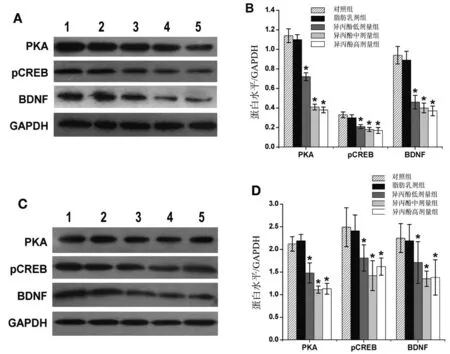
图5 异丙酚诱导7日龄和成年大鼠海马PKA、pCREB和BDNF蛋白水平下调(n=5)
3 讨论
既往研究表明,新生儿异丙酚全身麻醉是日后神经行为异常的重要危险因素[2-3]。虽然大量研究表明新生儿麻醉导致成年期认知功能障碍的原因之一可能是神经元凋亡[1],但新生儿麻醉导致认知功能障碍的确切机制尚未完全阐明。海马CA1 区神经元突触可塑性的改变在认知障碍的发展中发挥着重要作用。因此,本文探究了新生大鼠暴露于异丙酚对海马CA1 区神经元凋亡以及成年后学习和记忆能力的影响。
众所周知,麻醉期间的低体温、低氧、高碳酸或乳酸中毒可能与麻醉诱导的神经毒性有关[12]。在本研究中,大鼠幼崽被安置在一个温控的孵化器中,在麻醉过程中监测脉搏血氧饱和度,并在异丙酚注射结束后进行血气分析,所有的生理参数均保持在正常范围内。结果表明,成年大鼠的学习和记忆障碍不是由系统平衡的非生理性改变引起的,而可能是由新生大鼠接触异丙酚引起的。近年来,婴幼儿和新生儿使用麻醉剂的安全性是一个重要问题[13-14]。大脑的某个发育期容易受到全身麻醉剂的影响,这个时期被定义为大脑的快速生长期[15]。人类大脑快速生长期从怀孕中期到出生后2 年,而在啮齿动物中,发生在出生后的头14 d[16]。大鼠大脑发育高峰发生在出生后的第7 天,因此使用7 日龄新生大鼠更适合建立麻醉剂后的大脑发育和学习及记忆障碍。
海马区在学习和记忆过程中起着关键作用,特别是在海马CA1 区[11]。我们的研究发现,异丙酚诱导的海马CA1区FJB凋亡神经元数量显著增加,这意味着CA1 区可能容易受到丙泊酚暴露的影响。NeuN是一种中枢和外周神经系统中神经元特异性标志蛋白,位于有丝分裂后的神经细胞核及其周围,与神经发生密切相关[17]。本文结果显示,新生大鼠暴露于异丙酚后,成年后海马神经元明显减少。除了神经元损失,异丙酚处理明显引起了神经元形态的长期改变,以及突触超微结构的显著紊乱,这种情况在麻醉后至少持续9周。MWM试验是评估神经行为的标准方法,本研究结果发现,与对照组相比,大鼠寻找平台的潜伏期增加,穿越平台的次数减少,这表明异丙酚麻醉可降低成年大鼠的空间学习和记忆能力。
越来越多的研究表明,异丙酚可以通过改变发育中大脑多个基因和蛋白质的相互作用而损害学习和记忆[18],但精确机制仍不明确。学习和记忆是由神经元可塑性介导的,其中包括现有突触的持久强化、突触生成、内在兴奋性的调控和成年神经生成[19]。最近研究表明,PKA-CREB-BDNF 信号通路与长期学习和记忆有关[20]。PKA 是一种丝氨酸/苏氨酸激酶,在中枢神经系统中广泛表达并介导细胞内信号转导,在神经发生、突触可塑性和记忆形成中发挥重要作用[21],通过催化各种底物蛋白的磷酸化来调节细胞功能。CREB是一种位于胞核的转录调节因子,是多种蛋白激酶的磷酸化底物,如PKA、丝裂原活化蛋白激酶、蛋白激酶C和钙/钙调素依赖性蛋白激酶[22-23],CREB介导的基因转录和蛋白质合成在长期海马突触可塑性和记忆形成中至关重要[24]。pCREB蛋白主要分布在大鼠海马组织中,招募参与神经发育和神经元形成的CREB转录激活结合蛋白,发挥学习和记忆调控功能。BDNF 是CREB 的下游靶基因之一,CREB 磷酸化可促进BDNF 的表达,调控神经元生存、生长、突触可塑性以及长期学习和记忆[25]。此外,抑制BDNF 信号传导可在海马诱发电位长时程增强,这被认为是学习和记忆的神经生理学基础[26]。本研究中,笔者观察到异丙酚降低了PKA、pCREB 和BDNF 的表达,海马依赖性的空间学习记忆能力受损。这些发现与FJB 染色和神经元核抗原免疫组化分析结果一致,对于理解异丙酚对长期学习和记忆的损害的影响非常重要。
综上所述,新生大鼠暴露于异丙酚会诱发大鼠成年后海马区FJB 阳性细胞的显著增加、空间学习和记忆障碍、认知障碍和持久的超微结构异常。此外,在新生大鼠和成年大鼠中均表现出PKA、pCREB和BDNF蛋白表达水平下调。因此,新生大鼠暴露于异丙酚会诱发神经凋亡,并通过失活大鼠海马的PKA-CREB-BDNF 信号通路损害学习和记忆能力。
