牛病毒性腹泻-黏膜病病毒噬菌体单链抗体库的构建和筛选
2022-09-23孔梓安宋想胜程如楠甄思慧吴竹青吴清民
孔梓安 宋想胜 程如楠 甄思慧 吴竹青 吴清民 王 真*
(1.北京农学院 动物科学技术学院/兽医学(中兽医)北京市重点实验室,北京 102206; 2.中国农业大学 动物医学院,北京 100193)
牛病毒性腹泻-黏膜病(Bovine viral diarrhea,BVD),是由牛病毒性腹泻病毒引起的一种以发热、黏膜糜烂、溃疡、腹泻、咳嗽及怀孕母牛流产或产出畸形胎儿为主要特征的传染病。目前该病在全世界均有报道,许多养牛发达国家都是该病的重灾区。美国的养牛场有一半检测出牛病毒性腹泻-黏膜病病毒(Bovine viral diarrhea virus,BVDV);加拿大部分地区阳性率达83%;甚至在澳大利亚以及新西兰的BVDV感染率高达近90%。随着我国畜牧养殖业的迅速发展,已经成为养牛大国,根据我国各地BVD的血清学调查与统计,阳性率远高于过去,牛病毒性腹泻病流行呈现上升趋势,并在全国范围内流行,给养牛业造成了巨大的经济损失。BVDV为正链RNA病毒,蛋白在基因组的顺序依次为5’-P20-P14-gP48-gP25-gP53-gP125(P54/P80)-P10-P30-P133(P58/P75)-3’。其中,gP48基因编码蛋白是重要的结构蛋白,既是构成病毒粒子的一种外壳蛋白,又是病毒仅有的两种保护性抗原之一,可诱导机体产生中和抗体,并且有较高的保守性,是诊断试剂开发和亚单位基因工程疫苗研究的候选抗原之一。
目前BVDV主要通过血清中和试验、琼脂扩散试验、ELISA和RT-PCR等技术进行诊断,其中病毒分离鉴定、荧光免疫以及血清中和试验等方法非常耗时,且需专业人员操作,不利于临床疾病的快速诊断;ELISA方法操作相对简单,且可以进行批量检测,是目前临床疾病诊断的首选方法之一,然而BVDV ELISA检测试剂盒基本上被国外公司垄断,价格昂贵,购买周期太长,不适用于我国牛群的早期、快速诊断。因此,有必要建立一种敏感性高,检测成本低且适合大规模检测的ELISA 方法为国产试剂盒做技术储备。ELISA方法核心材料的选择和准备是诊断试剂研发的关键。单链抗体(Single-chain Fv,ScFv)是一种通过15~20个氨基端残基短肽将抗体的重链可变区和轻链可变区连接起来的新型基因工程抗体。与传统抗体相比,更易于在原核细胞表达和在基因水平进行改造。此外,单链抗体不仅可大量生产且成本较低,其分子量与免疫原性也很低,是一种理想的ELISA新型原材料。目前单链抗体技术在疾病治疗、预防以及肿瘤影像分析上都有应用。王丽娟等构建了抗非洲猪瘟病毒(ASFV)的猪源噬菌体单链抗体文库,从中筛选出可以稳定表达的猪源ScFv。经ELISA方法测定结果显示,纯化后的单链抗体蛋白存在良好的 ASFV 反应活性。该抗体的成功制备填补了目前市场上 ASFV ScFv的空白,为 ASFV 诊断与防控提供了新型原材料。谢崇等利用大肠杆菌表达了具有中和活性的重组穿梭肽-狂犬病单链抗体,经ELISA检测重组抗体具有较高的亲和力,该重组单链抗体可用于狂犬病治疗的特异性和靶向性抗病毒药物载体。Sengupta等利用噬菌体展示系统制备了针对禽流感病毒(AIV)核蛋白(NP)的ScFv, 以单链抗体为基础建立的CI-ELISA方法对850多份血清进行血凝抑制(HI)试验敏感性为100%,特异性为98.7%,进行琼脂免疫扩散(AGID)试验敏感性和特异性均为100%。
为探讨单链抗体在BVD诊断试剂研发中的应用前景,本研究用BVDV gP48蛋白对小鼠进行免疫,利用噬菌体展示技术构建gP48蛋白鼠源噬菌体单链抗体克隆库,进行富集,筛选与gP48蛋白具有高结合活性的特异性单链抗体,为基于单链抗体的BVD疾病ELISA检测方法的研究奠定基础。
1 材料与方法
1.1 实验动物
6~8周龄BALB/c小鼠(雌),购于北京维通利华实验动物技术有限公司。
1.2 主要试剂
HRP m13抗体购自北京义翘神州科技有限公司;显色液TMB A和TMB B购自北京索莱宝科技有限公司;PCR master mix,弗氏佐剂、琼脂糖、DNA分子量标准等试剂购自生工生物工程股份有限公司;普通SU5aLpha F`细胞、长链噬菌体载体、辅助噬菌体M13K07购自盛世君联生物技术有限公司;Trizol试剂购自普洛麦格生物技术有限公司;反转录试剂盒购自康为世纪生物科技有限公司;胶回收试剂盒购自百泰克生物技术有限公司。
1.3 gP48蛋白的原核表达
gP48蛋白原核表达载体由本实验室构建,诱导表达和纯化的gP48蛋白保存于-80 ℃低温冰柜,质量浓度为2 mg/mL。
1.4 引物设计
根据NCBI中登录的BVDV序列(Genbank:MW732738.1),利用Primer Premier 5软件设计ScFv扩增引物,序列详情见表1,由生工生物工程(上海)股份有限公司合成。
表1 本研究的引物序列信息
Table 1 Information of primer sequences in the study
引物名称Primer name引物序列(5'- 3')Primer sequence (5'-3')ScFv-1CTACAAATGCCTATGCATCTAGAGACTACAAAGScFv-2CAGCATTGACAGGAGGTTGGAATTCG
1.5 小鼠免疫
为建立免疫文库扩增单链抗体基因,对小鼠进行3次免疫。首次免疫将gP48蛋白抗原(100 μg/只)用弗氏完全佐剂乳化后颈背部皮下多点注射小鼠,第二次和第三次免疫将gP48蛋白抗原(50 μg/只)用弗氏不完全佐剂乳化,颈背部皮下多点注射。首免与二免间隔 18 d,二免与三免间隔 15 d。经3次免疫的小鼠用于后续试验。
1.6 单链抗体基因的扩增
无菌分离3次免疫后的小鼠脾脏,通过TRIZol方法提取脾RNA,并检测RNA浓度和纯度。用cDNA合成试剂盒进行小鼠cDNA的合成,以此为模板,扩增抗体的轻链(VL)和重链(VH)可变区。以单链抗体的形式组装VH和VL中的多肽接头核苷酸序列。PCR完成后,进行琼脂糖凝胶电泳、胶回收纯化目的片段。制备VH的DNA模板 50 ng和VL的DNA模版 50 ng,作为单链抗体扩增的模板,进行重叠延伸PCR,琼脂糖凝胶电泳和胶回收纯化单链抗体基因序列。PCR反应体系50 μL(10×Pfu Buffer 5 μL、dNTP 4 μL、Pfu DNA聚合酶 0.5 μL、VH DNA 2 μL、VL DNA 2 μL、引物各1.5 μL、5×GC Buffer 10 μL、ddHO 23.5 μL);PCR 反应条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环35次,72 ℃终延伸5 min。
1.7 构建重组噬菌粒
将长链噬菌体载体用Xba
I和EcoR
I进行双酶切,获得线性化载体。与上述扩增的单链抗体基因通过Gibson assembly反应:50 ℃,15 min,得到重组噬菌粒。37 ℃培养过夜,之后接种于2 L的2YT/carb/kan培养液中,37 ℃ 200 r/min震荡培养,计算库容。计算公式:抗体克隆库容量(抗体个数/mL)=单菌落数×稀释倍数÷10(计数时取10 μL)×1 000,其中由于取10 μL克隆库进行鉴定,故÷10可以得到抗体个数/μL,再×1 000可以得到抗体个数/mL。1.8 噬菌体抗体库的富集淘筛
取辅助噬菌体M13K07加入初级抗体库菌液中,37 ℃振荡1.5 h进行噬菌体的侵染及重组质粒的整合,然后利用PEG8 000/NaCl对重组噬菌体进行沉降富集。以gP48蛋白包被酶联免疫板,加入重组噬菌体孵育后,用PBST将非特异性的噬菌体洗去,再使用洗脱液(0.2 mol/LGly-HCl,pH 2.5)洗脱特异性噬菌体,把洗脱下来的噬菌体侵染处于对数生长期的SU5alpha F’细菌进行选择性富集。通过上述微孔板筛选法对抗体库进行3轮富集淘筛。
1.9 ELISA检测条件的优化
以gP48蛋白为包被抗原,建立筛选针对gP48蛋白的阳性噬菌体单链抗体的间接 ELISA 方法,分别对蛋白包被浓度、包被条件、封闭液种类及封闭时间,一抗和二抗孵育时间等基本条件进行确定,以期筛选到阳性值较高的单链抗体。
1.10 单链抗体序列分析及抗体结合活性测定
从三轮淘选后的LB/carb平板上随机挑取112个单菌落于含有辅助噬菌体M13K07的1 mL 2YT/carb的培养基中,37 ℃ 200 r/min过夜培养。第二天10 000 r/min离心15 min,利用优化的ELISA筛选阳性噬菌体单链抗体。吸取50 μL单克隆上清液至1.5 mL离心管中在沸水中煮10 min。使用ScFv的上、下游引物进行PCR扩增,经琼脂糖凝胶电泳鉴定后测序。
其中测序正确的克隆进行ELISA检测,根据ODnm值判定单链抗体结合活性,结合活性越好ODnm值越高。
2 结果与分析
2.1 单链抗体基因的扩增
以小鼠cDNA作为模板分别扩增VH和VL基因片段,进行琼脂糖凝胶电泳如图1(a)所示,分别扩增出大小约400 bp的VH和VL序列,与预期长度相符合。接着以VH和VL的DNA作为模板,进行重叠PCR扩增。如图1(b)所示,成功获得大小约800 bp的目的条带,说明VH和VL基因连接成功。

M, DNA标记;1,VH扩增片段;2,VL扩增片段;N,阴性对照;3,扩增条带。 M, DNA marker; 1, VH fragment; 2, VL fragment; N, negative control; 3, amplified fragments.图1 VH和VL片段的PCR扩增(a)及重叠PCR扩增(b)Fig.1 PCR amplification (a) and overlap PCR amplification (b) of VH and VL fragments
2.2 抗体克隆库库容量计算以及重组率的鉴定
根据抗体克隆库库容量计算公式,本研究构建的抗体克隆库库容量为:4.3×10CFU/mL。随机挑选18个单菌落培养并进行PCR验证,结果如图2 所示,重组率为83.3%。

M:marker; 1~18:样品。 M: marker; 1-18: Strain samples.图2 抗体克隆库菌株的PCR鉴定Fig.2 PCR identification of antibody clone library strains
2.3 噬菌体抗体库的富集
抗体克隆初始文库经调整噬菌体滴度为5×10CFU/mL,用96孔微孔板法对噬菌体抗体库进行了3轮“吸附-洗脱-富集”,对每一轮的输入和输出噬菌体进行滴度测定,其中富集倍数用来衡量抗体库分离并富集的效果,其数值越高效果越好。结果见表2,每轮经过洗脱后的噬菌体回收比从4.6×10逐渐上升到6.6×10。富集倍数也由1上升至1.43×10,说明噬菌体抗体库得到了特异性的富集。
2.4 间接ELISA筛选特异性噬菌体单克隆株
从培养板上随机挑出24个单菌落进行筛选,检测并选取OD数值最高的用作ELISA方法建立的抗体。结果如图3所示,8个样品的ODnm>0.3,本研究选择其中数值最高的21号克隆株作为后续间接ELISA方法优化用的抗体。
表2 噬菌体抗体库的选择性富集
Table 2 Selective enrichment of ScFv from the libraries during panning
项目Item第一轮First round第二轮Second round第三轮Third round噬菌体输入量2×10122×10122×1012噬菌体输出量9.2×1032.84×1061.32×108回收比(输出/输入量)4.6×10-91.42×10-66.6×10-5富集倍数(本轮回收比/第一轮回收比)1.00308.071.43×104

图3 24个单克隆株初筛结果Fig.3 Preliminary screening results of 24 strains
2.5 ELISA最佳条件的确定
将gP48蛋白包被酶标板,对最佳包被浓度、最佳封闭液、最佳封闭时间、最佳二抗稀释度、一抗孵育时间和最佳显色时间进行确定。读取ODnm值,计算P/N比值,选取P/N值较大的孔所对应的条件作为最佳反应条件(表3)。
表3 ELISA的最佳反应条件
Table 3 Optimum reaction conditions of ELISA
ELISA相关条件ELISA related condition最佳值Optimumvalue抗原包被浓度Antigen coating concentration800 ng/mL封闭液种类Type of sealing fluid1%明胶封闭时间Closing time37 ℃ 1 h一抗孵育时间Incubation time of primary antibody37 ℃ 2 h二抗稀释度Secondary antibody dilution1∶15 000显色时间Color development time20 min
2.6 阳性克隆株序列分析
从第三轮淘选后的培养板上挑取单菌落进行培养,ELISA筛选出阳性噬菌体单链抗体克隆株。对36株结合活性比较高的阳性单链抗体克隆株进行PCR鉴定。结果如图4所示,共计12个成功检测到目的条带(只展示了部分电泳结果)。将PCR阳性的12个克隆进行测序,最终9株克隆测序成功。利用DNA star的Clustal W对测序成功的9株阳性克隆进行序列分析,结果显示,抗体基因的linker序列全部正确。同源性比对结果如图5所示,ScFv-004和ScFv-116,ScFv-017和ScFv-032,ScFv-021和ScFv-030,ScFv-049、ScFv-056和ScFv-091序列相同。利用IgBLAST分析,结果显示9株阳性克隆抗体均为鼠源IgG。
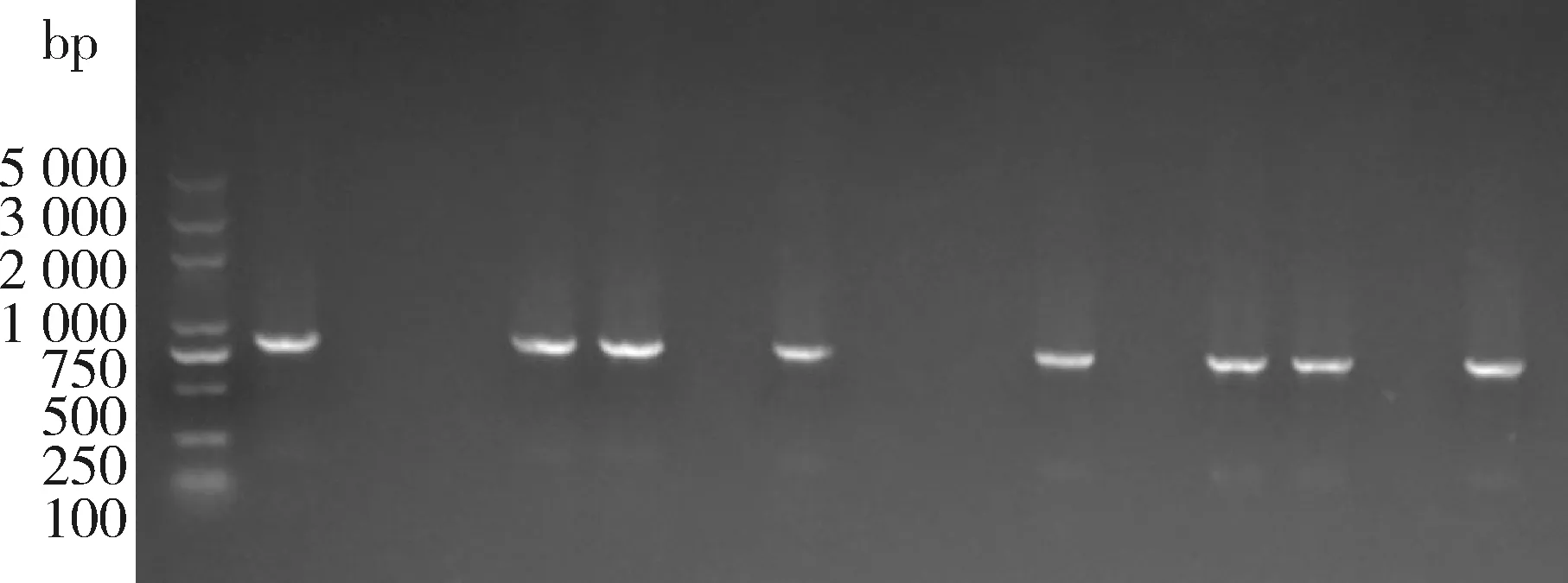
M:marker;1~15:克隆株扩增条带。 M: marker; 1-15: Amplified bands.图4 PCR鉴定阳性单链抗体克隆株Fig.4 PCR identification of positive ScFv clones
2.7 ELISA检测单链抗体的结合活性
选取序列不同的3株阳性单链抗体,利用建立的ELISA方法检测其与gP48蛋白的结合活性。酶标仪读取ODnm值并分析试验数据。结果如图6所示,ScFv-017、ScFv-030、ScFv-116均可以与gP48蛋白特异性结合;其中,阳性单链抗体ScFv-116与gP48蛋白的结合活性最高。

1~9分别表示9株阳性克隆,ScFv-004和ScFv-116,ScFv-017和ScFv-032,ScFv-021和ScFv-030,ScFv-049、ScFv-056和ScFv-091。 1-9 represent nine positive clones, respectively. ScFv-004 and ScFv-116, ScFv-017 and ScFv-032, ScFv-021 and ScFv-030, ScFv-049, ScFv-056 and ScFv-091.图5 9株阳性ScFv序列同源性分析Fig.5 Identity analysis of nine positive ScFv genes

图6 3株ScFv结合活性的测定Fig.6 Determination of binding activity of three ScFv strains
3 讨 论
随着规模化养殖业的不断发展,BVD的流行在我国牛群中呈上升趋势,给养殖业造成严重经济损失。因此建立快速、准确的检测方法对该病的防控尤为重要。目前研究、应用较多的是ELISA方法。传统的ELISA以单克隆抗体为核心材料,而单抗制备过程繁琐,价格昂贵,不利于ELISA试剂盒的快速研发和推广。单链抗体免疫原性低、组织穿透力强、特异性高且能够进行大规模生产,使其在科研、诊断及治疗方面应用广泛。现在较常用的单链抗体筛选技术为抗体噬菌体展示技术,通过该技术筛选得到的抗体不仅可以在标签蛋白的辅助下进行选择和纯化,还可通过基因测序的方法得到单链抗体的完整基因序列,再根据需要对单链抗体进行修饰和改造。与传统的杂交瘤制备单克隆抗体技术相比,制备单链抗体更加便捷和有效,为临床疾病检测方法的建立提供了新型原材料。本研究旨在筛选与gP48蛋白具有高结合活性的特异性单链抗体,为基于单链抗体的BVDV疾病ELISA检测方法的研究奠定基础,弥补国产基于单链抗体BVDV检测试剂盒的空白,为牛群BVD疾病的防控提供技术产品。
由于抗原刺激后,脾淋巴细胞分泌特异性抗体水平明显高于未受到抗原刺激下机体产生的抗体水平,因此利用免疫后的动物制备的抗体库的特异性、抗体阳性率明显高于天然抗体库。另外,免疫程序对淋巴细胞的分化及抗体的产生也有重要的影响,通过多次免疫诱导机体产生具有保护力的抗体。因此,本研究将gP48蛋白采用3次重复方式免疫小鼠,使其产生主动免疫,从而达到对淋巴细胞的有效刺激,用于构建BVDV抗体阳性率高的噬菌体抗体库。对噬菌体抗体库进行筛选,是获得高亲和力特异性抗体分子的关键步骤。本研究利用gP48蛋白对构建的噬菌体抗体克隆库进行特异性的富集淘选,经过三轮的“孵育-洗脱-一扩增”直接包被固相筛选,将噬菌体克隆文库富集了1.43×10倍。一般情况下,富集倍数超过100倍即合格,目前已报道的研究其富集倍数范围一般是从100多到2 000以内。从富集结果来看,本研究获得了比较稳定的噬菌体抗体文库。
为获得高亲和力的阳性噬菌体单链抗体,本研究以gP48蛋白作为抗原,分别对间接ELISA各项反应条件进行了优化,建立了针对gP48蛋白阳性噬菌体单链抗体筛选的间接ELISA方法,利用建立的ELISA方法最终成功筛选到多株阳性值较高的噬菌体单克隆株。对阳性ScFv基因进行同源性比对,结果显示其linker序列全部正确。通过IgBLAST分析ScFv基因,结果显示均为鼠源IgG。综上所述,本研究构建了BVDV gP48蛋白的鼠源噬菌体单链抗体克隆库,获得了与gP48蛋白具有较高结合活性的特异性单链抗体,有望用于BVDV诊断方法的研制,同时也将为开发BVDV抗体药物提供必要材料,为预防和治疗BVDV感染提供新的方法。
