浅谈与量有关的几类盐与碱反应离子方程式的书写技巧
2022-09-22杨雅勇
杨雅勇
(陕西省宝鸡市陈仓区虢镇中学 721300)
离子方程式的书写是高考考查的重要知识点,在这一内容中,酸式盐与碱、几种典型的复盐与碱反应的离子方程式相对比较难写,而近几年全国各地的高考试题中常有考查.许多同学不知从何下手,也很难保证准确无误.本文将近几年高考中,考查过的此类问题进行了比较全面的归纳总结,便于高考备考和有效的进行专题复习,并针对这类离子方程式的书写技巧,谈点粗浅的经验.
1 部分酸式盐与碱的反应
1.1 定量类
例1①Ca(HCO3)2溶液与足量NaOH溶液反应的离子方程式.
②Ca(HCO3)2溶液与少量NaOH溶液反应的离子方程式.
③等体积、等浓度的Ca(HCO3)2和NaOH溶液混合的离子方程式.
解析此类问题的书写技巧是:定“1” 法,即将量相对少的物质定为1 mol,另一物质溶液中的离子可取任意量,先中和,确定水分子的数目,然后让难溶物先结合,从而确定出生成物及其量.
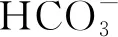

2H2O+CaCO3↓+Na2CO3
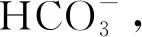

H2O+CaCO3↓+NaHCO3
对于③而言,通过分析具体的量,显然与②的相同.
点拨此类常见的有Ca(HCO3)2[或Ca(HSO3)2、Ba(HCO3)2、Ba(HSO3)2] 与NaOH或KOH的反应;另一大类是:NaHCO3(或KHCO3、NaHSO3、KHSO3、NH4HCO3)与Ca(OH)2或Ba(OH)2的反应.
1.2 限定条件类
例2向NaHSO4溶液中逐滴加入Ba(OH)2溶液:
①使溶液刚好呈中性时反应的离子方程式:____;
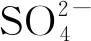
解析此类问题紧扣条件,用题干中条件限定的量来确定各物质反应的计量数,对①而言,要使溶液刚好呈中性,溶液中的H+和OH-需恰好完全反应,故应为2 mol NaHSO4与 1 mol Ba(OH)2反应,即

2H2O+BaSO4↓+Na2SO4

H2O+BaSO4↓+NaOH
故OH-有余,溶液显碱性,pH>7.
2 部分复盐与碱的反应
2.1 KAl(SO4)2与Ba(OH)2的反应
这类书写的关键是:根据Ba(OH)2的量,分析出生成物中铝元素存在的微粒形式,以铝元素存在的微粒形式为突破口,来确定各物质的计量系数.
(1)当Ba(OH)2少量时,铝元素以Al(OH)3的形式存在,观察可知需3mol Ba(OH)2,将生成2 mol Al(OH)3,这样以来,其它物质的化学计量数也就确定了.即

2Al(OH)3↓+3BaSO4↓+K2SO4
3BaSO4↓+2Al(OH)3↓


KAlO2+2BaSO4↓+2H2O
点拨此类写法还适用于Ba(OH)2与Al2(SO4)3溶液的反应,即
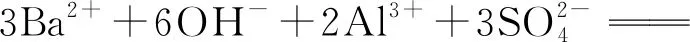
3BaSO4↓+2Al(OH)3↓ [Ba(OH)2少量]

2.2 NH4Fe(SO4)2与Ba(OH)2的反应
这类问题处理时,可采用假设法.


2Fe(OH)3↓+3BaSO4↓+(NH4)2SO4
3BaSO4↓+2Fe(OH)3↓
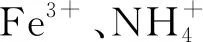

Fe(OH)3↓+2BaSO4↓+NH3·H2O
Fe(OH)3↓+2BaSO4↓+NH3·H2O
点拨此类还有
(1)(NH4)2Fe (SO4)2与Ba(OH)2的反应

Fe(OH)2↓+BaSO4↓+(NH4)2SO4
[Ba(OH)2少量]
Fe(OH)2↓+BaSO4↓

Fe(OH)2↓+2BaSO4↓+2 NH3·H2O
[Ba(OH)2过量]
Fe(OH)2↓+2BaSO4↓+2NH3·H2O
(2)NH4Al(SO4)2与Ba(OH)2的反应


2Al(OH)3↓+3BaSO4↓+(NH4)2SO4
[Ba(OH)2少量]
2Al(OH)3↓+3BaSO4↓

Al(OH)3↓+2BaSO4↓+NH3·H2O
[二者恰好1∶2时]
Al(OH)3↓+2BaSO4↓+NH3·H2O

附:(2012年重庆高考11题)向10 mL 0.1mol/L NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL,下列叙述正确的是( ).

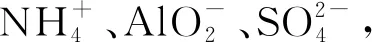
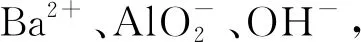

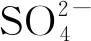
综上,熟练掌握这几类反应的物质、离子组合以及离子间基本反应的比例关系,从存在微粒的角度理清各类反应的特点和准确分析有关量,是分析解决这类问题的金钥匙.
