以“元素化合物”知识为载体培养学生的价态观
2022-09-22蒋芬芬
蒋芬芬
(广西壮族自治区柳州市民族高中 545006)
1 前言
“元素化合物”知识是化学必修课程的重要组成部分,在化学必修一课本的最后两章内容集中学习,包括金属及其化合物和非金属及其化合物,知识量非常大,学生学起来很困难,知识点多而杂,规律性不强,大部分地学生都对这部分有畏难情绪.
笔者认为在进行元素化合物该部分知识的教学时,“元素化合物知识”仅仅是一个载体,更加重要地是让学生通过“元素化合物”知识地学习掌握化学核心观念的元素观、分类观和转化观.还要让学生在学习“元素化合物”知识的过程中深刻体会实验观以及价态观,并通过该部分知识与环境保护方面的息息相关,建立社会责任感,体会化学的价值观.化学变化观概括着人们对化学变化的特征、本质、规律、价值、研究方法以及有关认识的发生、发展等重要问题的认识和看法.化学的变化观包含物质类别之间的变化、能量的变化以及不同价态之间的转化,下面以“元素化合物”知识为载体来探讨一下其中涉及的价态观,如何在“元素化合物”知识部分更好地利用价态观.
2 引例分析
把氧化还原反应理论融合到“元素化合物”知识中是高中化学新课程必修一的一个突出特点.初中化学中,学生已经学习了四种基本反应类型,已经认识到了元素化合物之间的一些规律性.在高中化学课程中元素化合物部分的知识里有很多氧化还原反应方程式,学生很难理解反应的特征,无法寻找出反应的规律.在学习Na、Al、Fe、Cu、Cl、S、N元素及其化合物时,会遇到很多困惑,面对里面多而杂的化学方程式,学生很难找出反应的特征和规律,所以很难记忆这些复杂的化学方程式,在书写化学方程式的时候就会很困难.如果在高考题中碰到教材里引申出来的相关联反应,学生更是无从下手.在化学反应中,元素的化合价是否发生变化,很好地体现了化学反应的多样性和复杂性,又揭示了物质变化的另一个重要特征.氧化还原反应是通过分析元素化合价的变化来寻找这类反应的规律,进一步上升到反应的本质是电子的得失,让学生从简单化合价入手可以更好地帮助学生找到学习氧化还原反应的方法.通过氧化还原反应理论来指导“元素化合物”知识的学习,能培养学生运用“价态观”来学习化学的一种思维习惯.对于一些较复杂的化学反应,学生运用元素“价态观”,对问题的解决就容易多了.
二维物质关系图是以元素为核心的、以价态和物质类别为坐标的二维物质关系图,应用于不同元素时,坐标会出现变化.以Fe、N、S这三种元素为例,来探讨其中所包含的价态观.
Fe元素的价态为0、+2和+3价,与铁相关的常见物质有单质、氧化物、盐和碱.根据这些内容构建Fe的二维关系图,如图1所示.
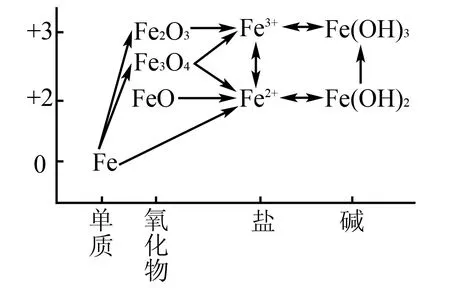
图1
Fe容易被氧化剂O2氧化成FeO、Fe2O3、Fe3O4.氧化物又可与非氧化性酸(如:HCl、稀H2SO4等)反应生成亚铁盐和铁盐.两种不同价态的盐之间又可以相互转化.利用价态观,以Fe元素为核心的物质转化主要有两种形式:(1)同种价态不同物质类别之间的转化,例如Fe(OH)3和FeCl3的转化、Fe(OH)2和FeCl2的转化,同价态之间的转化可通过复分解反应达成,例如酸碱中和反应、酸碱与盐的反应;(2)同种元素不同价态之间的转化,例如FeCl3与FeCl2的转化.转化则需要通过氧化还原反应来实现.亚铁盐转化为铁盐,则需要加入氧化剂,如氯水、过氧化氢、酸性高锰酸钾溶液以及硝酸等;而铁盐转化为亚铁盐,则需要加入还原剂,例如单质Fe、Cu、I-、S2-、Vc等.他们的氢氧化物之间也可以互相转化,因为氢氧化亚铁不稳定,容易被空气中的O2氧化成氢氧化铁.
Fe3+、Fe2+的检验方法.可以通过两种方法来进行检验,第一种是加入NaOH溶液:


第二种方法是加入KSCN溶液,Fe3+与SCN-结合生成血红色的络合物;Fe2+滴加KSCN溶液后无明显现象,再加入氧化剂氯水、过氧化氢等均可,出现血红色,则表明原溶液中有Fe2+.根据物质的价态、所属类别,通过元素价态观直观地引导学生体会和预测已学过和未学过物质的性质,让学生掌握学习的一种方法.当学生把关注转化关系内化为一种观念,把从价态和物质类别变化的角度认识物质和反应,内化为一种思想方法的时候,学生就找到了高中阶段学习元素化合物的根本方法.
非金属元素N也同样可以利用价态观来帮助学生更好地学习理解它们之间的关系.N的价态主要有-3、0、+2、+3、+4、+5,包含的物质类别有氢化物(NH3)、单质(N2)、氧化物(NO、NO2)、酸(HNO3)、盐[Cu(NO3)2]等.据此构建N元素的二维关系图,如图2所示.

图2
从N元素的二维关系图可以看出,氮元素的价态比较多,涉及的物质种类也较多.如果靠简单记忆可能需要花很多的时间,未必能取得很好的效果.但是如果利用这个二维关系图加上化学核心观念中的价态观,对于学习氮的相关物质之间的转化就要容易得多了.

(2)从-3的NH3与+2价氧化物之间的转化,即为氨的催化氧化:

(3)单质与氧化物之间的转化:



(4)氧化物与酸之间的转化:

(5)酸与盐之间的转化:


以价态为线索,各价态之间的转化关系清楚了,学习N元素就容易多了.运用化学核心观念之价态观,能帮助学生构建知识网络体系,让“元素化合物”知识的学习变得更加容易.引导学生将知识网络进行延伸,实现由“学”向“用”,由“是什么”向“为什么”的转变. 让学生从中体会元素价态观,掌握思考和答题的方法.
非金属元素S的价态主要有-2、0、+4、+6,包含的物质类别有氢化物(H2S)、单质(S)、氧化物(SO2和SO3)、酸(H2SO3和H2SO4)、盐(CuS、CuSO4)等.据此构建S元素的二维关系图,如图3所示.

图3
从S元素的二维关系图可以看出,硫元素的价态比较多,涉及的物质种类也较多.如果能够对物质进行分类,结合物质类别与价态之间的关系,系统地学习,这将大大提升学习效率的作用.
(1)-2价的硫.S元素的最低价-2价是氢化物H2S,它是一种弱酸,具有一般酸的通性.它能通过酸碱中和反应转化为同价态的盐类物质,另一方面它有较强的还原性,可以被氧化剂氧化成0价的S单质,例如:


(2)0价的硫.S的游离态是一种淡黄色的固体,性质较为稳定.如果在日常生活中打碎了水银温度计常用它来处理.它与氧气反应生成SO2.
(3)+4价的硫.SO2是无色气体,有强烈刺激性气味,是大气主要污染物之一.由于煤和石油通常都含有硫化合物,因此燃烧时会生成二氧化硫.当二氧化硫溶于水中,会形成亚硫酸(酸雨的主要成分),亚硫酸不稳定又会分解成二氧化硫和水.若在催化剂条件下,SO2进一步氧化,生成SO3,便会生成硫酸(H2SO4).酸碱中和反应会生成相应的亚硫酸盐.亚硫酸盐和硫化盐发生归中反应,生成S单质.
(4)+4价的硫.S元素的最高价是+6价,对应的氧化物是SO3,酸是H2SO4,盐是硫酸盐.稀硫酸具有一般酸的通性,浓硫酸则具有一些不同的性质:吸水性(作干燥剂)、脱水性(能把有机物中的H、O按2∶1的比例脱出来)、酸性、强氧化性.
(5)结合所学的知识解决酸雨带来的环境问题.通过实验探究转化关系,应用转化关系设计工业原理,应用转化关系分析酸雨的形 成与防治.层层递进,让学生真正掌握一种元素的学习方法.
除了以上列举的Fe、N和S元素以外,其他的元素也可以按照这样的模式,建立二维关系图,以价态为线索,运用价态规律既便于记忆又能更深刻理解.价态规律在“元素化合物”知识的学习中是非常行之有效的.通过对铁、氮、硫及其化合物的性质有一定的认识之后,还能对它们的化合物的保存、制备、分 离、提纯、应用有一定的了解,甚至在生产生活中都能体现它们的化学学科价值.要构建起化学基本观念,必须在深入理解化学学科特征的基础上所获得的对化学的总观性的认识.它的形成不能靠知识的简单积累,不可能通过大量记忆化学知识而自发形成,它需要学生在积极主动的探究活动中深刻理解和掌握有关的化学知识和核心观念,在充分应用所学知识分析问题与解决问题的过程中不断概括、提炼而形成.元素化合物知识部分充分地体现了化学核心观念之价态观.
