春兰组培苗镁原卟啉IX甲基转移酶基因克隆及功能分析
2022-09-22蒋彧涂勋良何俊蓉
蒋彧, 涂勋良, 何俊蓉
四川省农业科学院园艺研究所,四川 成都 610000
春兰(Cymbidium goeringii)是兰科(Orchidaceae)兰属(Cymbidium)中的一个种,具有较高的观赏价值和经济价值。‘宋梅’是中国春兰传统铭品,为梅瓣花的代表品种,被誉为春兰“四大天王”之首,“春兰之王”等,幽香馥郁,浓而不浊,深受广大兰友的喜爱。
镁原卟啉Ⅸ甲基转移酶(Magnesium protoporphyrin Ⅸ methyltransferase,ChlM)是叶绿素合成过程中的关键酶,也是重要的调控酶,其活性受到光照、叶绿体氧化还原状态和叶片中叶酸含量调控。此外,镁原卟啉Ⅸ甲基转移酶不仅影响PSⅠ、PSⅡ和Cytb6f 蛋白复合体内重要蛋白的积累,参与叶绿体到细胞核的反向信号转导、ABA 信号转导,还通过调控ChlH 表达影响镁螯合酶活性[1]。原卟啉Ⅸ甲基转移酶是单基因产物,定位在叶绿体被膜和类囊体膜上,其发挥作用时依赖于腺苷甲硫氨酸( Ado-Met) ,属于S-腺苷-L-甲硫氨酸依赖的甲基转移酶大家族[2-3]。拟南芥At4g25080是编码该甲基转移酶的基因,在烟草[4]、水稻[5]、豌豆[6]、衣藻[7]中均发现ChlM 序列同源物。本研究从‘宋梅’组培苗叶片中克隆了春兰ClChlM1基因,构建pART-ClChlM1植物表达载体,进而在烟草中瞬时表达鉴定了该基因的叶绿素生物合成功能,旨在为春兰叶绿素合成途径的揭示及春兰叶色变异提供理论依据。
1 材料与方法
1.1 材料
供试材料为春兰‘宋梅’组培苗,保存在四川省农业科学院园艺研究所组培室(见图1)。

图1 春兰‘宋梅’组培苗Fig.1 Tissue culture seedling of Cymbidium goeringii. ‘Songmei’
1.2 方法
根据天根生化科技有限公司的植物总RNA提取试剂盒说明书,从叶片样品中提取总RNA,利用Nanodrop2000(Thermo Scientific,美国)对RNA的浓度和纯度进行检测,1.5%琼脂糖凝胶电泳检测RNA 完整性。
使用Aidlab公司反转录试剂盒(TUREscript 1st Strand cDNA Synthesis Kit)进行cDNA的合成,反应体系为40 μL:500 ng总RNA,8 μL 5×RT Reaction Mix,2 μL Oligo(dT)引物,2 μL TUREscript HRTase/RI Mix,采用RNase Free dH2O补足至40 μL。反转录反应程序条件为:42 ℃ 60 min,65 ℃ 10 min。反应结束后,将得到的cDNA放置-20℃保存,用前稀释10倍使用。
1.2.2 ‘宋梅’ClChlM1基因克隆
根据表1的引物,从‘宋梅’cDNA中克隆了ClChlM1基因。PCR扩增程序:96 ℃ 10 min;96℃30 s;60 ℃ 30 secs,72 ℃ 1 min,30个循环;72 ℃10 min。将扩增产物经1.5%琼脂糖凝胶分离后对目的片段进行切胶回收,连入pMT18-T载体并转化大肠杆菌DH10B过夜培养。次日挑选克隆经菌落PCR验证后送至上海美吉生物医药科技有限公司测序。
1.2.3 ‘宋梅’ClChlM1进化树分析
选取铁皮石斛的DcChlM1、马蹄蝴蝶兰的PeChlM1、油棕的EgChlM1、深圳拟兰的AsChlM1、风铃木的HiChlM1、香蕉的MaChlM1、玉米的ZmChlM1、柑橘的CsChlM1、黄麻的CoChlM1,以及春兰的ClChlM1,采用MEGA 5.0构建系统进化树。
1.2.4 ‘宋梅’ClChlM1亚细胞定位
设计酶切引物对ClChlM1基因进行扩增,将扩增后的片段经XhoI和SalI双酶切后连入pBI121-GFP载体,并对拟南芥原生质体进行转化。通过荧光显微镜(Olympus BX51)观察融合蛋白的定位。
根据银隆相关人员的描述,魏银仓在未经债权人华融国际同意的情况下,通过魏旗下另一家公司受让银隆对华融国际3.75亿元债务,但并未实际还款,导致银隆的欠款依然存在。同时,在魏银仓任董事长期间,他与银隆签订《债权债务抵销协议》,导致其原本欠银隆的3.75亿元债务灭失。在这起事件中,其他股东并不知晓魏银仓所为。卢春泉坦承:“华融国际已申请对银隆的部分资金进行冻结。”

表1 引物序列Tab.1 Primers used in the present study
1.2.5 烟草转化
为了获得ClChlM1过量表达载体,将ClChlM1编码区序列插入pART-CAM,获得pART-ClChlM1载体[8]。通过农杆菌介导法将载体导入到本氏烟草中[9]。表1引物检测烟草的阳性转化率。
1.2.6 ALA和叶绿素的检测
按照Alawady and Grimm的方法检测ALA[4]。取烟草叶片,在含有40 mM乙酰丙酸(pH 6.9)的20 mM磷酸盐缓冲液(pH值7.5)中,置于光下培养4小时。取上清液,加入乙酰乙酸煮沸10分钟。加入等量的Ehrlich’s试剂,在553 nm下检测ALA。
检测烟草的叶绿素含量,用95%的乙醇和稀释的丙酮碾磨叶片。用紫外分光光度计检测665 nm,649 nm 和 470 nm波长[10]。
1.2.7 实时定量荧光PCR
引物序列详见表1。ACTIN基因作为内参,通过2-△△Ct法对目的基因表达量进行计算。
2 结果与分析
2.1 ClChlM基因克隆
通过RT-PCR获得了ClChlM1的开放阅读框(ORF)。DNA测序结果显示,ClChlM1的ORF长度为945 bp,编码314个氨基酸残基组成的蛋白质(见图2)。将ClChlM1序列提交至NCBI,序列号为MG574594。
2.2 ClChlM蛋白结构及进化树分析
选取春兰的ClChlM1、铁皮石斛的DcChlM1、深圳拟兰的AsChlM1、油棕的EgChlM1进行氨基酸序列比对,结果表明春兰的ClChlM与其余四种有较高的同源性,且都含有守的Mg-por_mtran_C区域(见图3 A)。
为进一步分析ClChlM进化关系,选取铁皮石斛的DcChlM1、马蹄蝴蝶兰的PeChlM1、油棕的EgChlM1、深圳拟兰的AsChlM1、风铃木的HiChlM1、香 蕉 的MaChlM1、玉 米 的ZmChlM1、柑 橘 的CsChlM1、黄麻的CoChlM1蛋白序列进行进化树构建,结果显示植物ChlM蛋白分为三个亚类,其中ClChlM与DcChlM1、PeChlM1、AsChlM1、EgChlM1、MaChlM1属于第I亚类,且与DcChlM1亲缘关系最近(见图3 B)。
2.3 ClChlM1亚细胞定位
原生质体转化结果显示ClChlM1-GFP融合蛋白绿色荧光与叶绿体探针红色荧光融合为黄色荧光,表明ClChlM1定位于叶绿体(见图4)。
2.4 ClChlM1基因功能验证
为进一步验证ClChlM1基因的功能,采用叶盘法将其转化到烟草中(见图5)。经PCR检测,获得三个转基因株系(见图5E)。
叶绿素是一种含卟啉化合物,ALA是卟啉生物合成过程中的一个重要前体。测定结果显示转基因株系中ALA合成效率显著高于对照株系,约为对照株系中的2.28倍(见图6)。
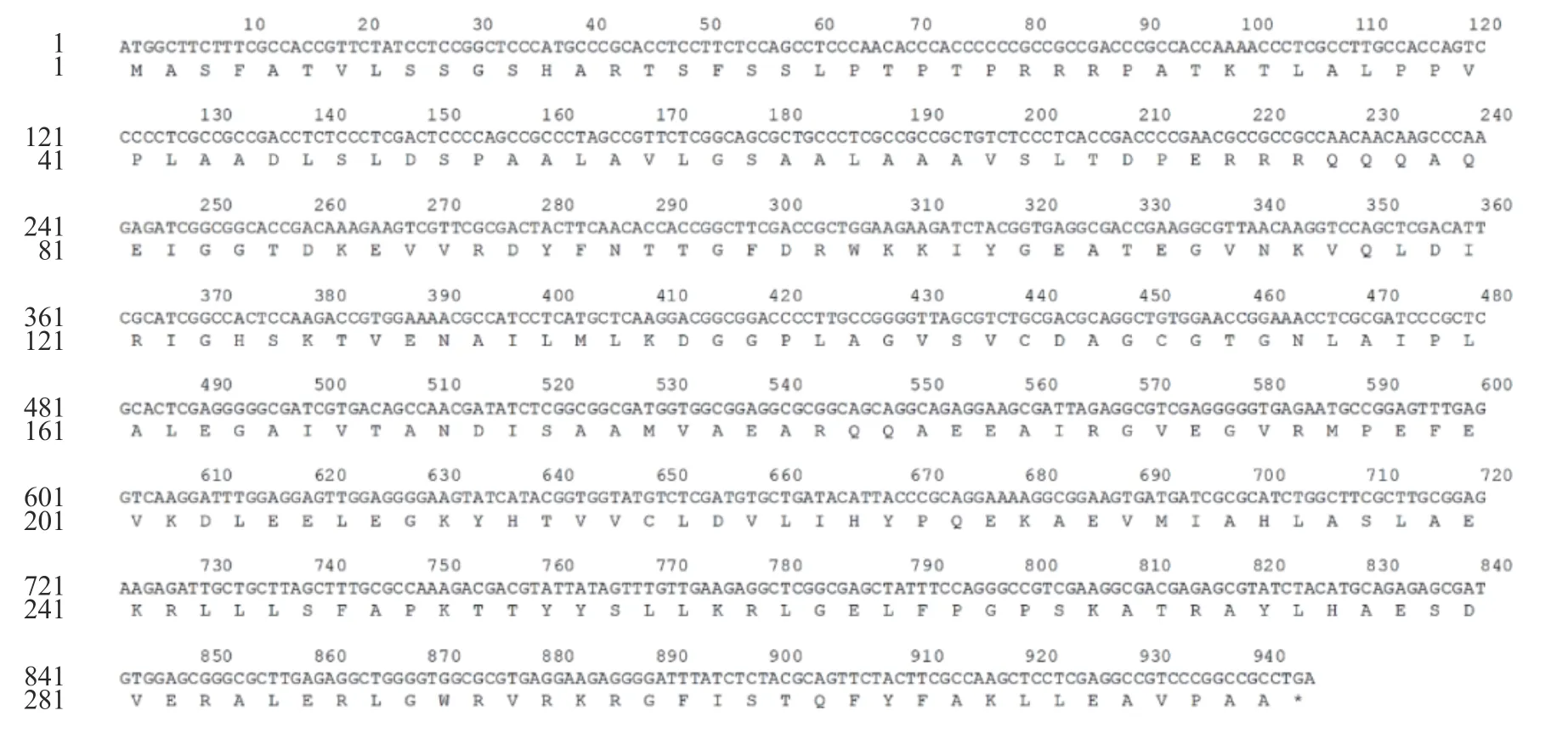
图2 ‘宋梅’ClChlM1核苷酸及推导氨基酸序列Fig.2 Nucleotide and deduced amino acid sequences of ClChlM1 from Cymbidium goeringii. ‘Songmei’
叶绿素含量测定结果显示转基因株系中叶绿素a、叶绿素b、叶绿素总量含量远高于对照株系,分别是对照株系的1.32倍、1.56倍、1.35倍(见图7)。
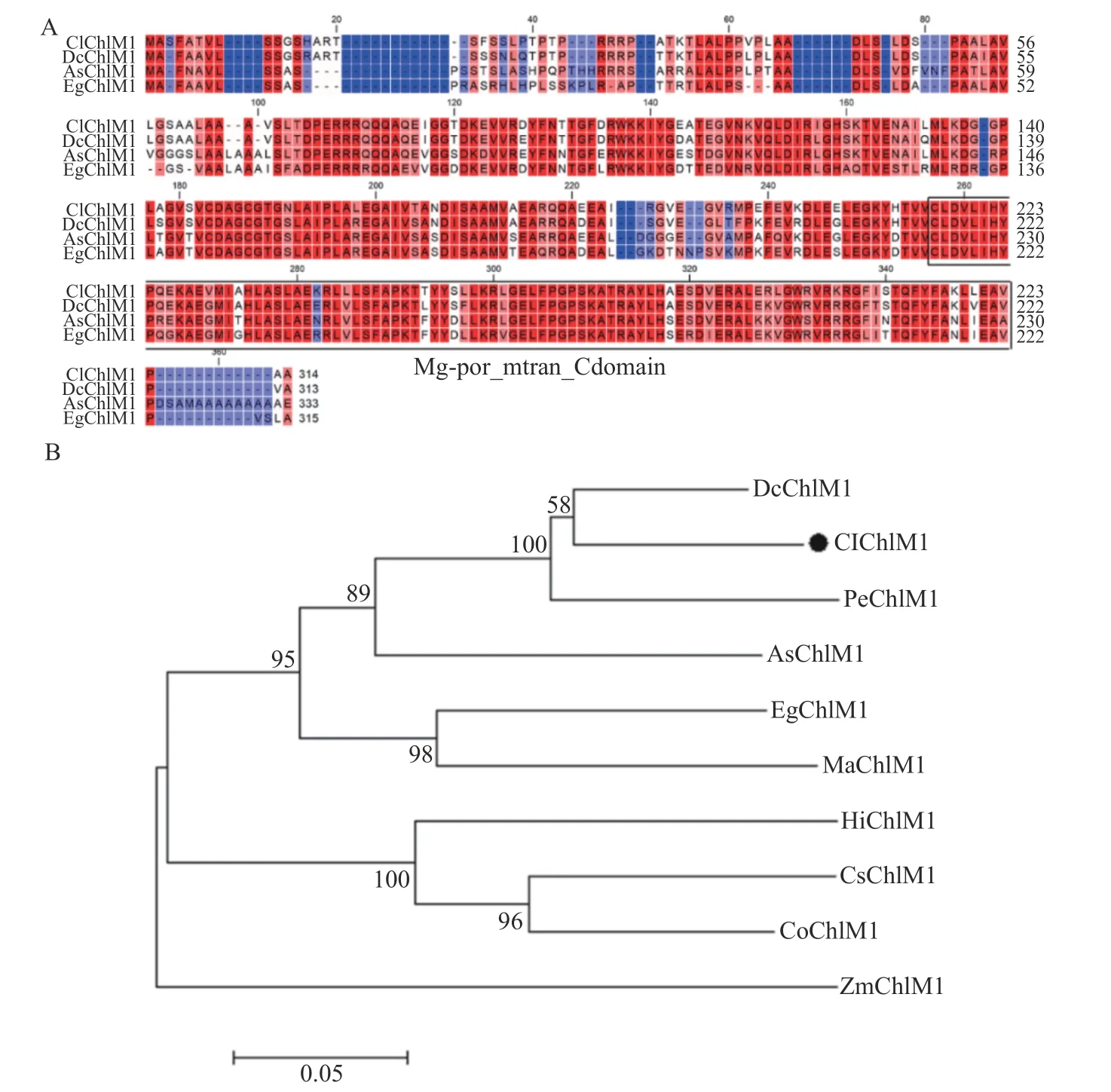
图3 ClChlM1同源性比较及系统进化树分析Fig.3 Phylogenetic and alignment of ClChlM1 with homologous proteins from other plants
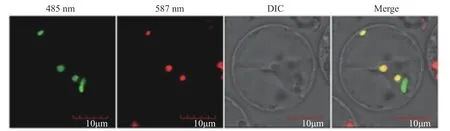
图4 ClChlM1亚细胞定位。Fig.4 Subcellular location of ClChlM1 in Arabidopsis protoplast
进一步对光合作用相关成员谷氨酰tRNA还原酶(HemA), 谷氨酸酯-1-半醛2,1-氨基变位酶 (Gsa),叶绿素a/b结合蛋白(LHCB), 镁离子螯合酶CHLI和镁离子螯合酶CHLH在转基因烟草中的表达模式进行分析,结果显示除了ClHemA外,ClGsa、ClLHCB、ClCHLI、ClCHLH在转基因株系中的表达量均显著高于对照组(见图8)。
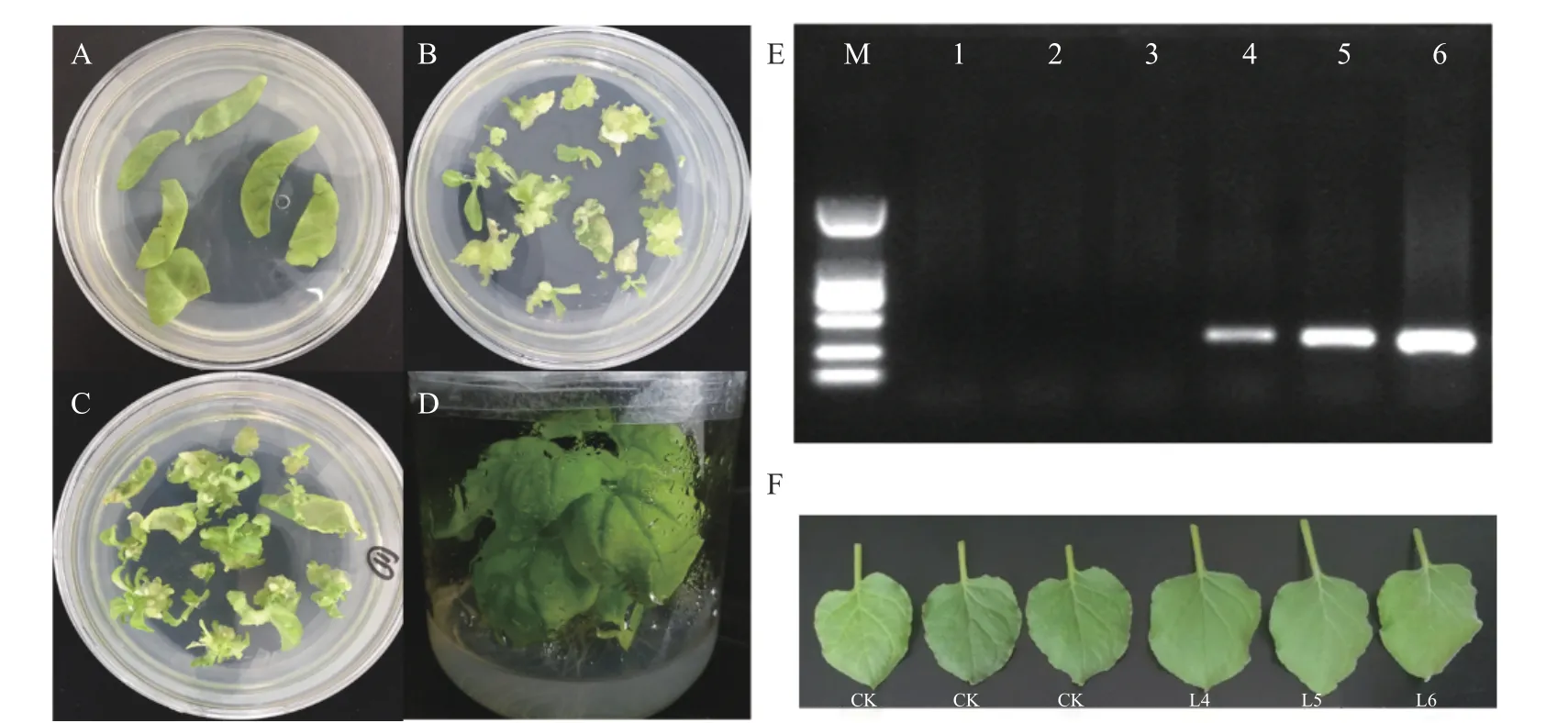
图5 ClChlM1烟草转基因Fig.5 Tobacco ClChlM1 transgenic
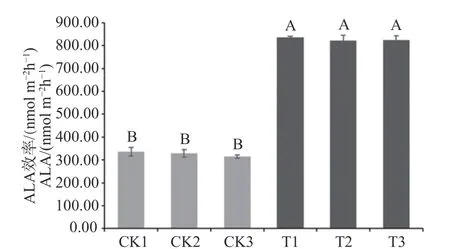
图6 转基因株系中ALA合成效率Fig.6 Efficiency of ALA Synthesis in Transgenic Strains
3 讨论
从春兰组培苗中克隆的ClChlM1基因ORF长度为945 bp,氨基酸序列分析显示ClChlM1拥有植物ChlM蛋白高度保守的Mg-por_mtran_C结构域,进化树分析显示ClChlM1与同为兰科植物的铁皮石斛的DcChlM1亲缘关系最近。
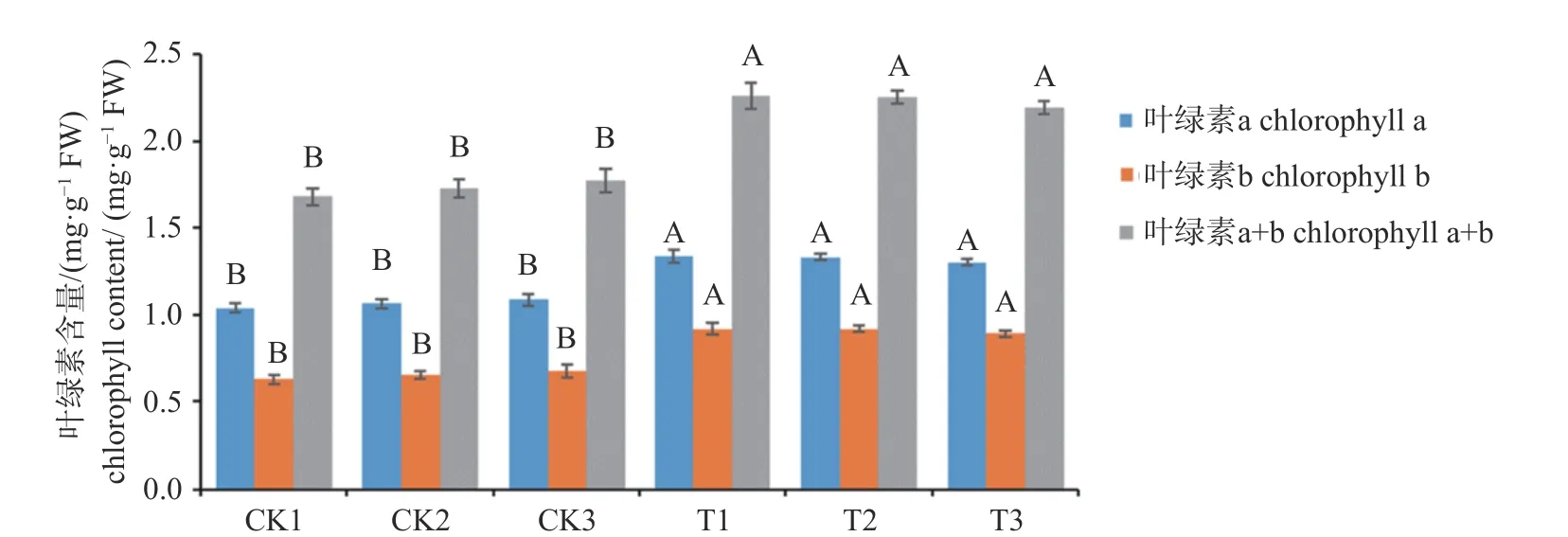
图7 转基因株系中叶绿素含量Fig.7 Chlorophyll content in transgenic lines
高等植物叶绿素生物合成属于典型的卟啉代谢途径,由谷氨肽-tRNA到叶绿素a和叶绿素b的形成共需经历十余步酶促反应,其中催化镁原卟啉Ⅸ(MgP)形成镁原卟啉Ⅸ单甲醚(MgPME)的ChlM是该过程关键酶之一[12]。最近还有研究表明ChlM可以在转录后水平对光合作用编码蛋白进行调控。LHCB是捕光天线蛋白,位于叶绿体类囊体膜上,作用是将吸收的光能传递到作用中心,启动光合作用。在大麦中,Gadjieva等发现ChlM产物MgPME的积累会促进LHCB基因的表达[13-14]。在本研究中,除了ClLHCB外,还发现ClGsa, ClCHLI和ClCHLH在ClChlM1过表达植株中显著上调,而ClHemA基因的表达量则无变化。HemA编码谷氨肽-tRNA还原酶,是叶绿素生物合成途径第一个酶;Gsa编码的谷氨酸-1-半醛转氨酶是叶绿素生物合成途径第二个酶,主要负责ALA的合成;CHLI和CHLH编码的蛋白是镁螯合酶的不同亚基,主要负责镁原卟啉IX的合成。因此,推测ClChlM1可反馈调节叶绿素的生物合成,具体的调控机制将是下一步研究重点。
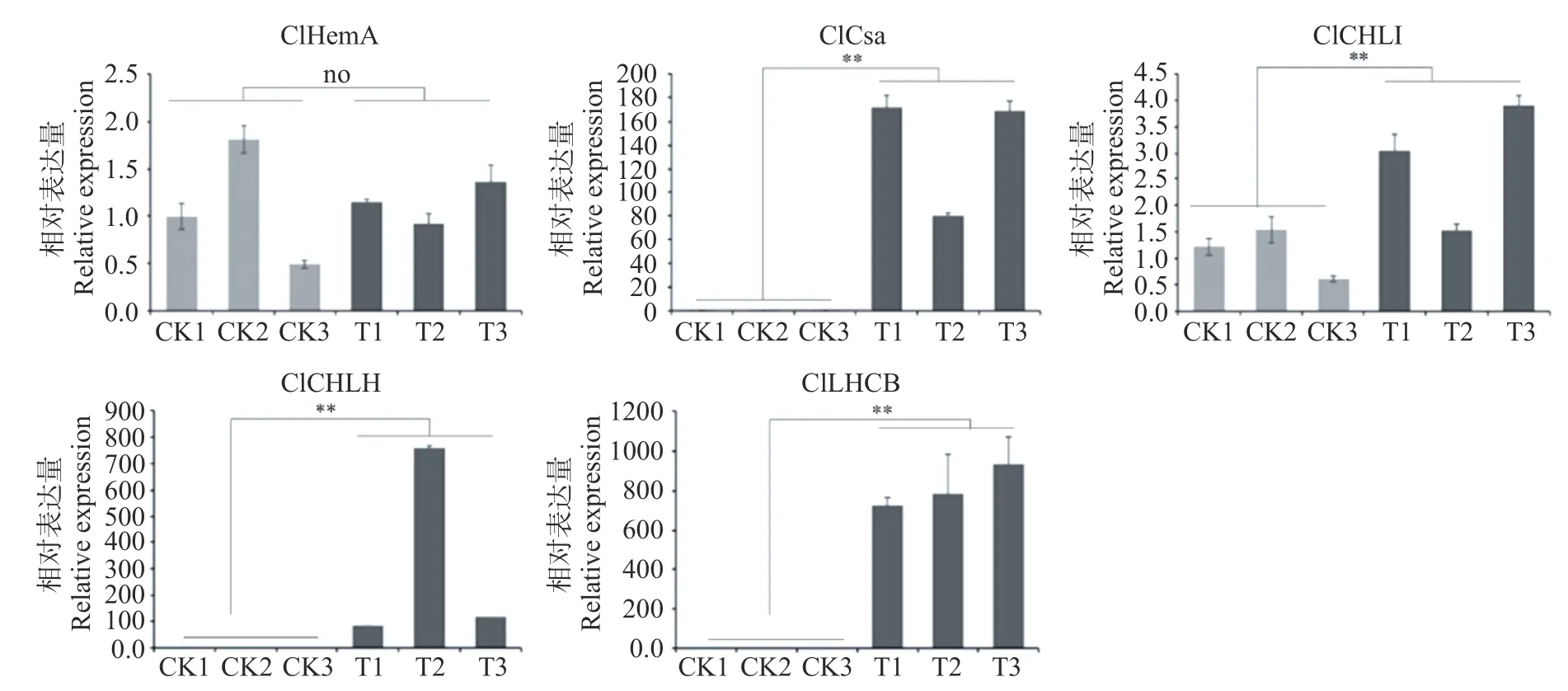
图8 相关基因RT-PCR分析Fig.8 RT-PCR analysis of related genes
