‘玫瑰香’葡萄组培生根期愈伤组织的转录组分析
2022-09-22李光宗韦伟许文娣单守明
李光宗,韦伟,许文娣,单守明*
(宁夏大学农学院,宁夏 银川 750021)
玫瑰香(Muscat Hamburg)又名麝香,原产于英国,欧亚种,属中晚熟品种,作为具有鲜食、酿酒、制汁等功能的优质品种在我国广泛栽培[1-2]。目前葡萄繁殖方式主要以压条、扦插、嫁接为主,其中扦插繁殖应用广泛[3-4],然而生产中发现扦插成苗率低,不定根数量少,且根系生长弱,影响葡萄的繁殖效率。此外,长期采取扦插繁殖方式,会造成严重的退化现象[5]。
近年来,葡萄组培快繁相关研究取得了重大进展,不但能够缩短苗木的繁育周期,而且可培养出根系好、枝条粗壮的苗木[6]。生根培养是组织培养体系中的主要步骤,培养基的类型及其中附加的激素如IAA、IBA、6-BA、KT和NAA等影响组培苗的生长[6-7]。生根培养中,IBA和NAA在促进生根中发挥着重要作用[4]。目前对于‘玫瑰香’葡萄组织培养的相关研究较少,且多集中于组培快繁体系建立方面,本研究将探究不同激素配比对‘玫瑰香’葡萄生根的作用。
转录组测序技术具有高通量、低成本、高效率等特点,利用RNA-Seq可以有效了解基因的功能和结构,揭示器官及细胞在特定生物学过程中的机制[12]。Illumina转录组测序平台,可进行多个样品同时测序,且测序结果具有良好的顺序性和精确性,是应用较为广泛的测序平台[13]。目前,转录组测序技术应用于葡萄的许多方面,如‘温克’葡萄气生根[14]、‘夏黑’葡萄叶片衰老[15]、补光对‘红地球’葡萄萌芽[16]及葡萄糖对‘红地球’葡萄试管苗光合作用的影响[17]等,而对于葡萄组培苗愈伤组织转录组测序的相关研究较少。本研究对‘玫瑰香’葡萄组织培养至生根阶段,筛选出较为合适的培养基类型,通过不同处理选定转录组测序材料,并对测序结果进行分析,以期探究‘玫瑰香’葡萄生根的分子机理。
1 材料与方法
1.1 试验材料
组培所用外植体为‘玫瑰香’葡萄带芽茎段,于2021年7月在宁夏银川平吉堡酿酒葡萄示范园内获取。‘玫瑰香’葡萄7年生,“厂”形架式,南北行向,株行距为1.0 m×3.0 m,葡萄园基础管理一致。
1.2 试验方法
1.2.1 外植体消毒
将‘玫瑰香’葡萄带芽茎段取回实验室,立即用流水充分冲洗10 min。在超净工作台上,用70%的乙醇溶液浸泡并轻晃消毒45 s,倒出乙醇后使用无菌水清洗3次,之后采用15%的H2O2溶液充分浸泡消毒6 min,取出后,再次用无菌水冲洗4次。
1.2.2 启动培养
将制备好的外植体以斜角约45°切去两端5 mm,然后接种到培养基中。启动培养基为:MS+1.0 mg·L-16-BA+0.2 mg·L-1NAA+30 g·L-1蔗糖+7 g·L-1琼脂。培养条件为:日光照时间16 h,温度25 ℃,光照强度2500 Lx。
1.2.3 生根培养基筛选
等到初代培养的带芽茎段芽萌发且长至5 cm左右时,通过超净工作台将长势均一的萌发枝条切取并转接至生根培养基中,每瓶接1个茎段。生根培养基的筛选:采用0.3 mg·L-1IBA+0.3 mg·L-1NAA+25 g·L-1蔗糖+7.5 g·L-1琼脂,对1/2MS、1/2B5、B5、1/2WPM、WPM和N6培养基进行筛选。培养条件为:日光照时间12 h,温度25 ℃,光照强度2500 Lx。各培养基类型分别设10个样本。于15 d后统计不同培养基中组培苗的生根情况,进而计算平均生根数和生根率(未生根的组培苗不做统计)。
1.2.4 生根培养
选定用于生根的基础培养基后,采用IBA(0.1、0.3、0.5 mg·L-1)、NAA(0.1、0.3、0.5 mg·L-1)和蔗糖(15、25、35 g·L-1)各3个浓度进行处理,设计正交试验(表1),共计9组,每组10个样本,各培养基琼脂浓度7.5g·L-1。培养条件为:日光照时间12 h,温度25 ℃,光照强度2500 Lx。

表1 正交试验设计Table 1 Orthogonal experimental design
当茎基部愈伤组织开始生出根系,且根系数目增长较快时,将基部愈伤组织取下并切去周围杂质,液氮速冻,保存于-80 ℃冰箱中,用于后续转录组测序分析和荧光定量验证。
1.3 转录组测序
1.3.1 RNA提取及测序
愈伤组织总RNA的提取参照TIANGEN RNA提取试剂盒产品说明书进行。每个样品3个生物学重复,使用NanoDrop 2000测定RNA的提取质量,并结合琼脂糖凝胶电泳检测RNA的完整性,以确保后续分析的需要。参考刘帅[12]等人的方法构建cDNA文库并进行质检,将已构建好的cDNA文库通过上海美吉生物医药科技有限公司在Illumina Novaseq 6000测序平台上测序。
1.3.2 测序数据分析
利用Sickle和SeqPrep软件处理测序所获得的原始数据(Raw reads),从而获得高质量数据(Clean reads)。将Clean reads通过HISAT2软件与参考基因组进行比对分析,获得用于后续表达量计算等的mapped reads。采用RSEM软件对基因表达进行定量,以FPKM为单位,|log2FoldChange|≥1、P-adjust<0.05为筛选条件,统计基因显著性差异表达情况(DEGs)。进而进行GO功能分类、COG功能注释及KEGG相关分析,当P-value<0.05时,认为KEGG富集功能存在显著富集情况。
1.3.3 差异基因的荧光定量验证
为了验证转录组测序数据结果的可靠性,根据转录组测序结果,随机选出6个差异表达基因,使用CWBIO荧光定量试剂盒做qRT-PCR 验证。以VvEF基因(登录号:AF176496)作为内参,通过2-△△CT算法计算基因相对表达量。各反应3次重复,运用Primer 5.0设计引物,引物序列见表2。

表2 qRT-PCR基因引物序列Table 2 Primer sequences for qRT-PCR
2 结果与分析
2.1 生根培养基筛选及测序样品选择
由表3可知,1/2B5培养基组生根率最高,达到了100%,且平均生根条数为6.2;其次为1/2WPM组,其生根率为80%。B5培养基组平均生根数为6.6,生根率为60%。综合各培养基平均生根数和生根率数据,选择1/2B5培养基为生根培养基。
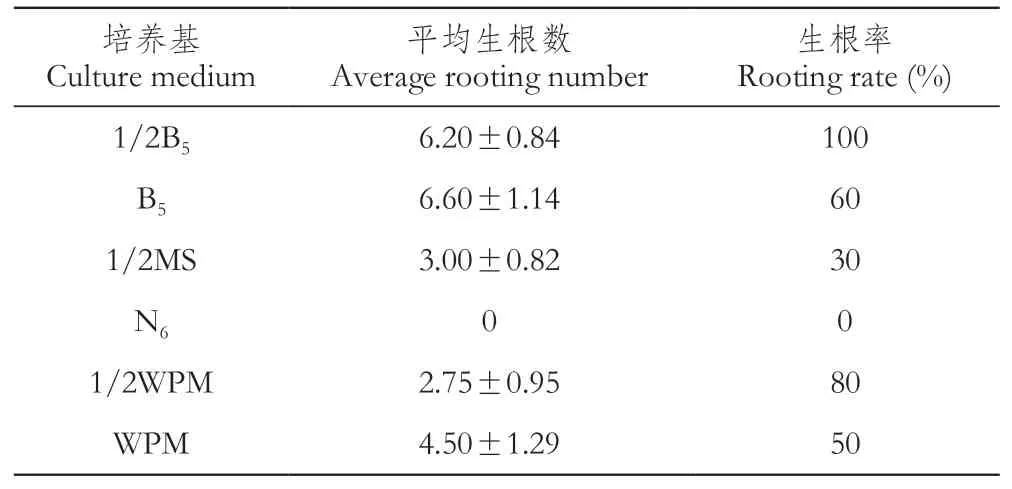
表3 不同培养基生根指标Table 3 Rooting index of different media
图1为生根处理20 d生根情况,M6的主根数和侧根数显著高于其他各组,而M1的主根数最少,且与侧根数目最少的M2相差较少,因此选择生根差异较大的M1与M6的根基部愈伤组织作为转录组测序材料。
2.2 RNA-Seq测序数据产出统计
利用Illumina Novaseq 6000测序平台对6个样品测序,共得到42.86 Gb Clean data,各样品Clean data均达到5.49 Gb以上。将Raw reads过滤后,各样品Q20和Q30百分比分别在97.95%与93.85%以上,GC含量为45.93%~46.49%,表明测序质量较好,可以用于进一步比对分析(表4)。
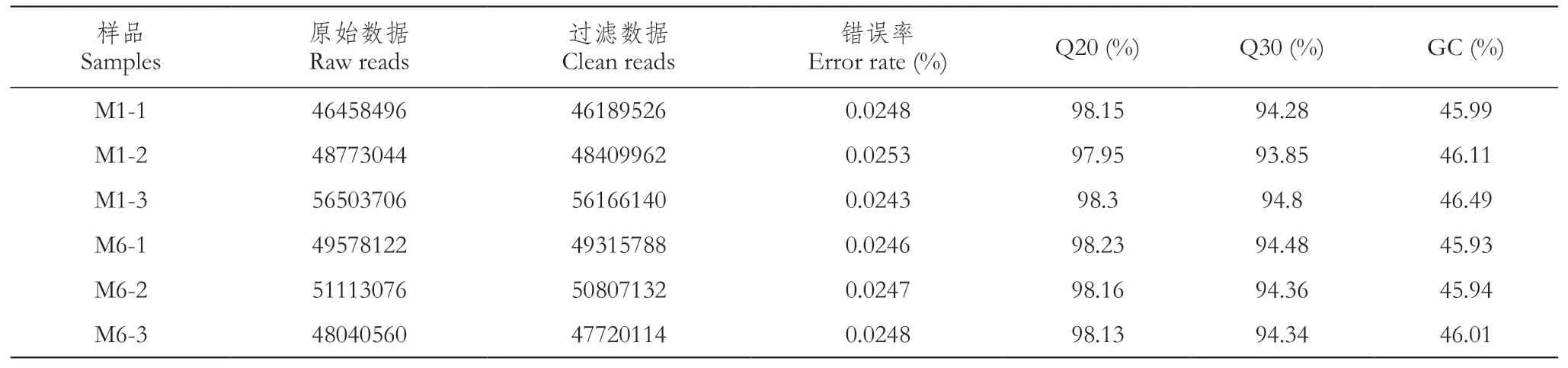
表4 测序数据质量统计Table 4 Statistics of sequencing data quality
2.3 RNA-Seq测序数据与参考序列比对
利用HISAT2软件将Clean reads与参考基因组进行比对分析。比对分析结果显示(表5),各样品8 8.2 3%以上的C l e a n r e a d s能定位到参考序列,其中有多个比对位置的为2.6 9%~3.3 9%,唯一位置的比对效率为85.27%~88.2%。而比对到基因组上的Clean reads在参考基因组编码区域的分布情况为84.2%~85.68%。各项数据表明可以进行后续分析。
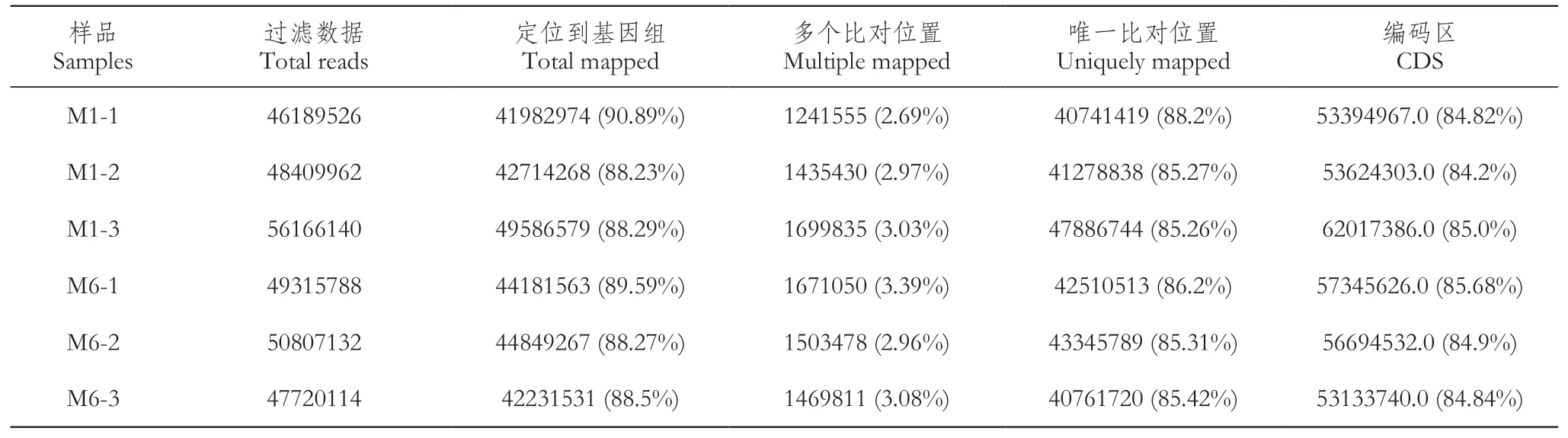
表5 Clean reads与参考基因组比对统计Table 5 Statistics of clean reads and reference genome comparison
2.4 差异表达基因的筛选
以|log2FoldChange|≥1、P-adjust<0.05为筛选条件,统计基因显著性差异表达情况(图2)。结果表明,在M1 vs M6中共筛选到52个DEGs,其中下调基因35个,上调基因17个,DEGs的差异倍数大多集中在-6~8之间,这些DEGs以下调表达为主。
2.5 差异基因GO功能分类
GO功能分类体系包括生物过程、细胞组分和分子功能3大类,对差异基因进行GO功能分类,共有52个差异基因被注释到26个GO功能类别中。图3为GO功能注释条目表,其中在生物过程功能体系中,主要包括代谢过程、细胞过程、生物调节等条目;在分子功能体系中,主要包括催化反应活性、蛋白结合等条目;而在细胞组分体系中,主要包括细胞部分、细胞膜部分等条目。差异基因在生物过程中注释到的条目较多,主要注释到代谢过程、细胞过程和生物调节3个类别中;其次为细胞组分,基因主要集中于细胞和细胞膜部分;而分子功能体系中,基因主要富集于催化反应活性和蛋白结合功能中(表6)。
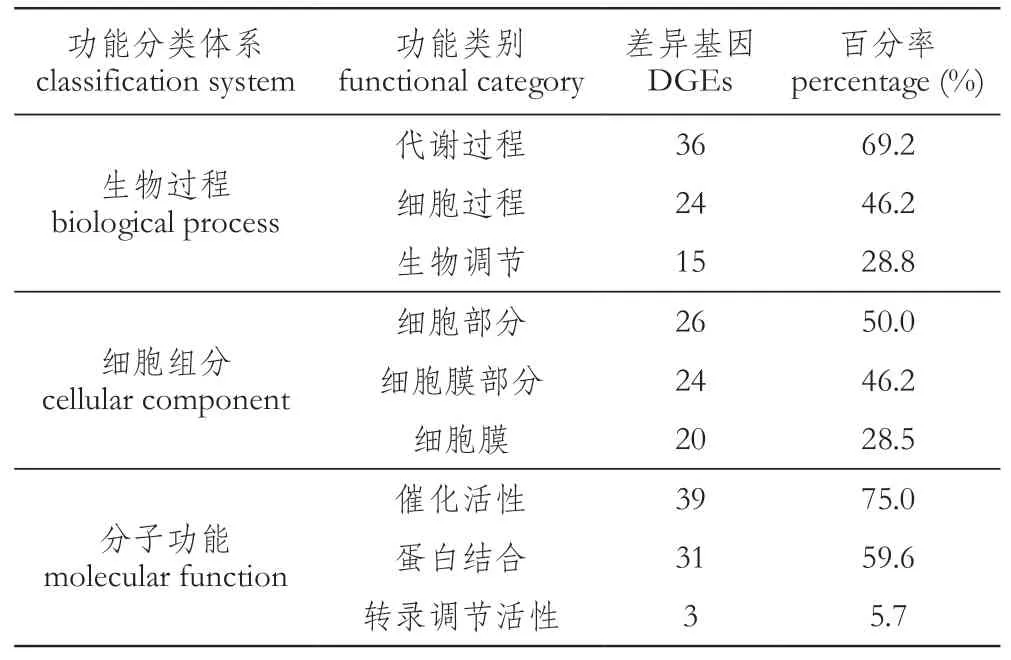
表6 差异基因GO功能统计Table 6 Statistics of DEGs GO function
2.6 差异基因COG功能注释分析
愈伤组织差异表达基因根据COG注释功能分类,可分为信息存储和处理、代谢、细胞过程和信号以及表达不明显4大类,涉及12条功能分类(图4)。其中,样品注释到未知功能(S, 22)的基因数最多;其次为次生代谢物生物合成、转运和分解代谢相关基因(Q, 9)和碳水化合物运输和代谢(G, 9);翻译、核糖体结构和生物发生(J, 3),而较少注释到脂质运输和代谢(I, 1)以及防御机制(V, 1)等相关基因条目。
2.7 差异基因KEGG分析
为进一步研究差异基因所具有的生物学功能,进行了KEGG注释分析,共有22个基因参与了14条KEGG通路(图5),共分为代谢、遗传信息处理、有机系统3大类。其中DEGs注释最多的为碳水化合物代谢,其次为其他次生代谢物的生物合成;注释最少的为环境适应等。
对差异基因进行KEGG通路富集分析发现,碳水化合物代谢中的氨基糖和核苷酸糖代谢、戊糖和葡萄糖醛酸相互转化通路;次生代谢物生物合成中的黄酮类生物合成和异黄酮生物合成4个通路显著富集,各通路中差异基因均为下调,基因数目分别为3、2、2、1(图6)。
2.8 生根阶段愈伤组织中差异基因表达分析
图7为显著富集通路中的差异基因表达热图,图中红色代表高表达基因,蓝色代表低表达基因。由图7可以看出,‘玫瑰香’葡萄组培苗基部生根愈伤组织显著富集通路中的8个差异表达基因均在M1中上调表达,而在M6中都下调表达。其中氨基糖和核苷酸糖代谢通路富集于细胞壁大分子物质分解过程,包括3个几丁质酶基因(VIT_05s0094g00220、VIT_05s0094g00230、VIT_05s0094g00360);而戊糖和葡萄糖醛酸相互转化通路主要富集于果胶分解过程,为2个果胶酯酶基因(VIT_07s0005g00720、VIT_16s0022g00700);在黄酮类生物合成通路中分别筛选出1个氧化还原酶基因(VIT_06s0009g03040)和1个查尔酮合酶(CHS)家族基因(VIT_16s0100g01120);异黄酮生物合成中为甲基转移酶基因(VIT_10s0003g00470)。
2.9 差异基因的荧光定量验证
为了验证 RNA-seq 数据的真实可靠性,随机选取6个DEGs进行qRT-PCR验证(图8)。进一步将验证结果与转录组数据进行相关性分析,结果表明,6个基因的qRT-PCR验证结果与转录组分析的相关系数较高(0.943),并且表达趋势基本一致,表明RNA-seq分析结果真实可靠。
3 讨论与结论
近年来,转录组测序技术日益兴起,其在发掘差异基因表达模式及调控机理方面发挥了重要作用[18]。本试验筛选出较适合‘玫瑰香’葡萄生根的培养基类型为1/2B5,之后通过正交设计以不同浓度IBA、NAA和蔗糖进行处理,并对组培苗基部生根愈伤组织进行转录组测序分析.Illumina Novaseq 6000测序结果表明,测序质量及质控结果较好,共得到42.86 Gb Clean data,约88.23%以上的Clean reads能定位到参考序列。测序结果共获得52个DEGs,主要以下调表达为主。因此,数据基本能够反应基部生根愈伤组织转录组特征,为进一步研究提供数据参考。而对于所筛选DEGs较少的原因,推测可能为大多数基因在M1和M6两个生根阶段差异表达不明显。
GO功能注释表明,根基部愈伤组织的转录组特性与生物过程、细胞组分和分子功能相关;COG功能分析根据物种所属的clade选择参考数据集,充分展示了与其它注释信息(KEGG/GO)的关联[19]。本研究共得到12个不同的功能条目,差异基因主要注释到次生代谢物生物合成、转运和分解代谢以及碳水化合物运输和代谢中。进一步对差异基因序列进行KEGG分析,结果表明,碳水化合物代谢中的氨基糖和核苷酸糖代谢通路以及戊糖和葡萄糖醛酸相互转化通路、次生代谢中的黄酮类和异黄酮生物合成通路在KEGG代谢通路中显著富集,KEGG分析结果在一定程度上可以说明生根愈伤组织相关的信号转导在本试验中体现为转录调控相关生物学过程,启动如碳水化合物代谢、次生代谢物合成等KEGG通路响应[20]。以往研究表明,经过不同条件处理,植物差异基因所富集通路也不相同。对NaCl胁迫下新疆野苹果叶和根转录组分析显示,差异基因主要富集在糖酵解/糖异生、磷酸戊糖途径和果糖和甘露糖代谢等[21];在Cd胁迫处理后番茄根的转录组分析中,差异基因在植物MAPK信号通路、苯丙酸生物合成和植物-病原菌互作等通路富集程度较高[22];而在IBA诱导楸树扦插不定根转录组分析中,大量的差异基因则富集在苯丙烷合成、糖酵解和植物激素代谢等途径中[23]。由此可见,不同处理下植物转录组测序得到的差异基因富集通路差异较大,充分体现了转录组对不同环境下植物生长响应的差别反应。
碳水化合物代谢是植物最基础也是最重要的生命活动代谢[24],在本研究中也是‘玫瑰香’葡萄愈伤组织中响应最显著的代谢通路。其中涉及差异基因最多的为氨基糖和核苷酸糖代谢途径,主要富集了几丁质酶基因。植物几丁质酶主要在植物细胞壁中进行合成,并在植物的防御、发育和生长调节中发挥作用[25-26]。而戊糖和葡萄糖醛酸相互转化通路富集了果胶酯酶(Pectinesterase,PME)基因,果胶酯酶通过调节植物细胞壁结构来调控细胞生长[27],PME属于大型多基因家族,其对植物根系发育存在影响[28]。梁国平[29]等研究发现,豌豆根尖PME基因的表达与根边缘细胞的游离紧密相关,因此会抑制根边缘细胞的正常游离。本研究表明,两条代谢通路中富集的相关基因在M1中上调表达,而在M6中均下调表达,可能受到试验中高浓度蔗糖或激素的影响。目前,尚未有关于氨基糖和核苷酸糖代谢以及戊糖和葡萄糖醛酸相互转化两条途径在植物生根中发生作用的相关报道,但在白鲜、新疆野苹果、番茄等[30,21-22]植物根系转录组中均有富集,因此本研究推测其可能通过影响植物细胞壁来进行生命活动,而关于其具体作用需要进一步的研究。
植物的次生代谢产物在提高自身保护和生存竞争能力以及协调与周围环境关系上起着至关重要的作用[31]。本研究中次生代谢通路主要富集于黄酮类和异黄酮生物合成两条通路中。黄酮类物质是一种重要的次生代谢物,在植物中不仅参与花、果实、种子的形成和发育,而且还具有抵御生物或非生物胁迫的作用[32]。试验中有1个基因注释到查尔酮合酶(CHS),该酶是黄酮合成途径中的第一个关键酶[33],对于黄酮类物质的合成具有重要的作用。两条次生代谢物合成通路中富集的基因在M1中上调表达,而在M6中均下调表达,其可能在适应局部环境,响应高浓度的处理中发挥着重要作用。
本研究对‘玫瑰香’葡萄组织培养中生根培养基的类型进行筛选,认为1/2B5培养基具有较高的生根率;之后以不同浓度蔗糖、NAA和IBA进行处理,结果1/2B5+IBA0.5 mg·L-1+NAA0.5 mg·L-1+蔗糖25 g组合具有较高的生根率和主根数。转录组结果分析表明,‘玫瑰香’葡萄细胞壁结构的改变可能是其生根发育调控机理之一,而次生代谢物合成在‘玫瑰香’葡萄生根适应局部环境以及协作生根中具有重要作用,研究生根相关的基因及其功能初步为‘玫瑰香’葡萄生根的分子机理提供参考信息。
