脑小血管病总负荷与脑血流动力学指标的相关性☆
2022-09-22陈珺茹高庆春钟嘉仪黄乐恩
陈珺茹 高庆春 钟嘉仪 黄乐恩
脑小血管病变会导致脑血流动力学改变,脑血流动力学改变可以表现为脑自动调节(cerebral autoregulation,CA)受损。近年来有研究发现CSVD患者的双侧CA均受损,并且CA受损程度与CSVD严重程度呈正相关[2]。生理学和临床研究已证实大脑中有临界闭合压(critical closing pressure,CCP)的存在,CA过程中血管平滑肌的收缩或舒张使CCP升高或降低,改变动脉部分的有效灌注压,维持脑血流量(cerebral blood flow,CBF)相对恒定[3-4]。CCP主要反映血管平滑肌的收缩程度,可以通过测定以CCP为中心的脑血流动力学指标,评估CSVD患者CA的变化情况。CSVD的神经影像学特征主要包括腔隙性梗死(lacunar infarction,LI)、脑白质高信号(white matter hyperintensity,WMH)、血管周围间隙(enlarged perivascular space,EPVS)、脑微出血(cerebral microbleed,CBM)等[5]。这些神经影像学特征通常以不同的组合同时出现,由HUIJTS[6]提出的CSVD总负荷评分能更全面地评价CSVD严重程度[1,7]。本研究通过分析CSVD总负荷与以CCP为中心的脑血流动力学指标的相关性,探讨以CCP为中心的脑血流动力学指标能否反映脑小血管病变的严重程度。
1 对象与方法
1.1 研究对象本研究为横断面研究。连续纳入2021年5月至2021年11月在广州医科大学附属第二医院神经内科住院的CSVD患者。
纳入标准:①符合2015年《中国脑小血管病诊治共识》诊断标准[8];②MRI表现符合2013年国际血管改变神经影像标准报告小组STRIVE[9]公布CSVD研究的影像学诊断标准,一种影像学特征或几种并存;③TCD检测可探及双侧MCA清晰的脑血流信号,频谱包络线完整;④自愿参加检查,无精神疾病,依从性好。
排除标准:①双侧或单侧无颞窗,频谱包络线信号差,TCD连续监测显示存在血栓栓子;②由心脏和大血管栓塞引起的脑血管病,以及有以下相关病史,如房颤,心肌梗死小于6周,心瓣膜病,心内膜炎,心肌病,二尖瓣狭窄,室壁瘤;③有严重脑大血管疾病(同侧近端颅内或颅外动脉有>50%的狭窄)及静脉类病变患者;④感染,中度以下贫血或恶性疾病,急慢性严重心、肺、肝、肾等全身性疾病;⑤伴急、慢性传染病及恶性肿瘤患者。
本研究得到广州医科大学附属第二医院临床研究与应用伦理委员会批准。受试者均签署知情同意书。
1.2 方法
1.2.1 临床资料收集 收集所有研究对象的年龄、性别、个人史、既往史和血管危险因素以及实验室检验等资料。个人史包括身高、体质量。既往史和危险因素包括高血压史、糖尿病史、脑血管病史、有无颈动脉斑块形成和吸烟史。实验室检验资料包括甘油三酯、低密度脂蛋白和红细胞压积。
1.2.2 影像学检查 所有研究对象行磁共振(Achieva 1.5T MRI,飞利浦)检查,将MRI设定层厚6 mm,间距1 mm,获取轴位横断面快速梯度回波T1WI、快速自旋回波T2WI、反转恢复序列T2FLAIR、弥散加权成像(DWI)。视野分别为210 mm、210 mm、250 mm、240 mm;矩阵分别为256×256、256×256、192×256、288×288。
1.2.3 CSVD影像学诊断标准 参照已发表的系列标准[9]形成下列影像学评估标准。①血管源性腔隙:T2FLAIR序列上表现为直径3~15 mm圆形或卵圆形的腔隙灶,周围可围绕一圈高信号。②血管周围间隙:T2序列上表现为直径<3 mm的圆形或线形病变,信号强度与脑脊液影像相同。③脑白质高信号:T2和T2FLAIR序列上呈高信号,可分为脑室周围高信号和深部白质高信号。利用Fazekas量表[10]进行分级,脑室周围高信号和深部白质高信号的评分相加为最终评分,1~2分为轻度,3~4分为中度,5~6分为重度。
所有MRI图像由一位影像科医师及一位神经内科医师共同评估。两位医师在评估前已接受过培训,并且评估结果已通过一致性检验。
1.2.4 CSVD总负荷评分和分组 本研究参考CSVD总负荷评分[6]对血管源性腔隙、血管周围间隙和脑白质高信号三个影像学特征进行评分,具体评分方法如下:①血管源性腔隙≥1个,1分;②血管周围间隙>10个,1分;③中重度脑白质高信号(根据Fazekas量表,脑室旁白质高信号3分和∕或深部脑白质高信号2~3分),1分。CSVD总负荷0分为轻度组,1分为中度组,2~3分为重度组。
1.2.5 脑血流动力学指标的计算 由两位熟练掌握检测技术的医师操作经颅超声多普勒仪(TCD,DelikaiMVU-6203,中国深圳),获取双侧大脑MCA稳定的最佳血流流速信号,使用无创手指血压监测仪(Finometer Model 1,荷兰)测定动脉血压,同步记录15~30 min稳定的动脉血压和脑血流流速曲线。之后离线导出分析动脉血压和脑血流流速趋势图,按照高庆春等[11]建立的方法和PANERAI等[12]的方法,计算脑血流动力学指标。
1.3 统计学方法应用SPSS 25.0进行统计学分析,符合正态分布的计量资料以±s描述,组间比较应用独立样本t检验或方差分析,进一步两两比较用LSD检验;不符合正态分布的计量资料用中位数(四分位数)M(QL,QU)描述,组间比较采用Mann-WhitneyU检验或Kruskal-Wallis检验。计数资料以率描述,组间比较应用χ2检验或Fisher精确概率法。CSVD总负荷及子项目(影像学特征评分)与脑血流动力学指标之间的相关性采用Spearman相关分析。应用多因素logistic回归进一步分析CSVD严重程度与脑血流动力学指标之间的关系。检验水准α=0.05。
2 结果
2.1 临床资料本研究共纳入92例患者,其中CSVD轻度组54例、中度组26例、重度组12例。三组间年龄、性别、高血压史、糖尿病史和脑血管病史比较,差异具有统计学意义(P<0.05)。其余均无统计学差异(P>0.05),见表1。
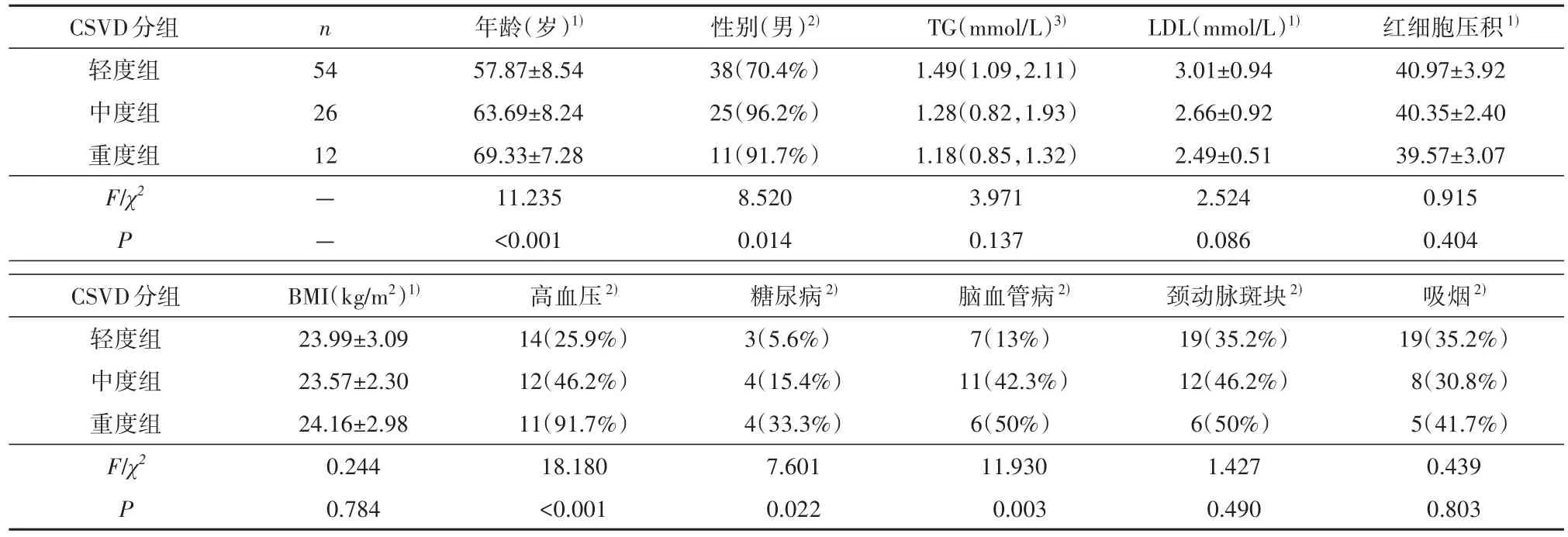
表1 一般临床资料
2.2 脑血流动力学指标三组间CCP、收缩压和平均动脉压差异有统计学意义(P<0.05)。经LSD检验发现中、重度两组的CCP高于轻度组(P=0.039,P<0.001),重度组的收缩压、平均动脉压高于轻度组(P=0.021,P=0.043)。见表2。

表2 脑血流动力学指标
2.3 CSVD总负荷与脑血流动力学指标之间的关系CSVD总负荷与CCP(r=0.365,P<0.001)、收缩压(r=0.259,P=0.013)、平均动脉压(r=0.258,P=0.013)呈正相关。纳入脑血流动力学指标(CCP、收缩压、平均动脉压)构建多因素logistic回归方程,结果显示CSVD总负荷与CCP显著相关(OR=1.070,P=0.006)。见表3。收缩压、平均动脉压与CSVD总负荷无统计学相关性。

表3 进入Logistic回归方程中的自变量及有关参数的估计值
在CSVD神经影像学特征(血管源性腔隙、血管周围间隙、脑白质高信号)中,脑白质高信号与 CCP(r=0.233,P=0.025)、收缩压(r=0.348,P=0.001)、平均动脉压(r=0.309,P=0.003)呈正相关。血管源性腔隙、血管周围间隙与CCP、收缩压、平均动脉压无统计学相关性(P>0.05)。
3 讨论
本研究参考了CSVD总负荷评分法对收集的患者进行总体评估后,对CSVD总负荷与CCP为中心的脑血流动力学指标之间进行相关性分析,结果发现①CSVD组间对比,重度组CCP、收缩压、平均动脉压高于轻度组;②CSVD总负荷与CCP、收缩压、平均动脉压呈正相关,logistic回归分析发现CSVD总负荷与CCP显著相关。
脑血管阻力是CA的重要决定因素,并且很容易适应脑灌注压的变化。血压变化时,血管平滑肌通过肌源性反应主动扩张或收缩,脑血管阻力随之降低或升高。脑大动脉和小动脉通过肌源性反应改变脑血管阻力可以有效避免下游的脑微循环(毛细血管网)受到血压快速变化的不利影响。在CA正常并且血压在CA范围内的情况下,无论血压上升或下降,脑血管阻力都会发生相应变化以保证脑微血管免受损伤。CCP的概念由BURTON[13]首次提出,BURTON的理论模型认为CCP是颅内压与血管壁张力的总和,血管平滑肌的收缩程度是CCP的决定因素。在CA范围内血管平滑肌的收缩或舒张使CCP升高或降低,改变动脉部分的有效灌注压,从而维持相对恒定的脑血流[14]。动物及临床实验表明CCP是真正的脑循环有效下游压,在CA范围内,脑血流量取决于平均动脉压与CCP之间的差值[15-16]。
有研究表明CSVD患者的CA受损,并且受损程度与CSVD严重程度呈正相关[2]。目前对CSVD发病机制的相关研究已经确定小血管病变会导致血管内皮障碍、血脑屏障受损、平滑肌细胞增殖和粥样硬化等病理改变[17-18],在合并有衰老和高血压危险因素的情况下,这些病变会导致血管阻力增加、血管舒缩功能下降、CA受损和脑灌注不足。本研究结果表明随着CSVD严重程度的增加,CCP、收缩压、平均动脉压也随之升高,舒张压无明显变化,并且CCP的升高会增加CSVD病变进展的风险。随着小血管病变进展,平均动脉压、脑循环有效下游压也随之升高,这可能意味着在面对变化的动脉血压时大脑无法维持正常的脑灌注压,脑血流无法维持恒定会导致脑组织灌注不足;收缩压和脉压差升高,这可能意味着在CSVD患者CA受损的情况下,脑血管阻力对高收缩压、高脉压差适应不佳,造成脑微循环损伤继而导致小血管病变的发生发展,继而进一步加剧恶化脑组织病变,最终造成不可逆的临床结局[14]。
关于脑白质病变的病理学研究表明,缺血和血脑屏障破坏被认为是脑白质病变发生的机制,其中脑室旁和深部脑白质高信号的病理特点是动脉血管壁增厚,血管密度降低,血管迂曲度增加,这也同样表明脑白质病变患者的脑血管阻力升高和CA异常[19-20]。临床研究结果发现脑白质病变与CA受损有关,并且脑白质低灌注随着CSVD严重程度增加而下降。本研究发现随着脑白质病变严重程度增加,CCP水平也随之增加,收缩期血压与平均动脉压升高而舒张期血压没有升高,这可能说明了在血压以及脉压差升高的情况下,由于脑白质病变的患者CA受损,脑白质部位的远端小血管受损并发生病变,在血压不稳定的情况下会进一步加重疾病严重程度。
此外,本研究发现年龄、男性占比以及糖尿病、脑血管病的患病率与CSVD严重程度增加呈正相关。许多临床研究表明男性、高血压和糖尿病对CSVD总负荷评分有显著影响,是CSVD的危险因素[21-22]。来自流行病学、临床和实验研究的研究结果表明年龄越大,CSVD的发病率越高,脑微血管功能障碍和微循环损伤也与年龄相关[4,23]。并且有多个研究表明血管源性腔隙、脑白质高信号和脑微出血会增加缺血性及出血性卒中的风险[24-26]。对于有高血压、糖尿病和脑血管病史的老年男性患者,CCP及动脉血压的升高可能意味着脑小血管功能障碍以及更广泛的脑组织病变。
本研究的不足之处有:①CSVD评分未纳入脑微出血这一特征,收集的样本量较小且不同特征组合的样本量分布不均,可能会导致CSVD特征组合效果与脑小血管病变严重程度之间关联的证据薄弱。②本研究使用1.5T MRI而不是分辨率更高的3.0T MRI对受试者进行影像学检查,可能会使小血管病变的检出率下降,这也是本研究的不足之处之一。③对于CCP估计值,目前无法直接测量真实的脑循环有效下游压,大多数关于CCP的文献都是基于线性假设得出的估计值,得出的是表观CCP而非真实的CCP。就目前的测量和分析工具而言,CCP的主要作用是概念性的,是向更精确的脑血管床模型的过渡。本团队下一步工作会继续扩大样本量,继续探索CCP与更多脑血流动力学指标之间的关系,以提供更多的可用于临床实践的有用信息。
综上所述,本研究通过分析CSVD各组间脑血流动力学指标之间的差异,分析CSVD总负荷与以CCP为中心的脑血流动力学指标之间的关系,发现CSVD患者的脑血流动力学改变为CCP、收缩压、平均动脉压水平升高,以CCP为中心的脑血流动力学指标可以反映CSVD患者CA受损,可以反映脑小血管病变的严重程度,并且CCP和动脉血压水平的升高可能会进一步增加CSVD病变进展的风险。
