lncRNA在猪流产相关病毒感染中的作用研究进展
2022-09-22牛晓玉陆梦琪陈燕虹
余 鹏,牛晓玉,董 翎,陆梦琪,陈燕虹,李 凡,宋 卉
(华中农业大学动物科技学院/动物医学院,武汉 430070)
自1989年第一个真核生物调控性lncRNA H19被发现和命名后,便开启了调控性长链非编码RNA(long noncoding RNA,lncRNA)的相关研究[1]。lncRNA在某些发育阶段、组织或疾病状态中具有非常特异性的表达,因此可作为生物标记物[2]。一些针对与疾病相关的lncRNA的研究表明,与疾病相关的lncRNA可以作为新兴的治疗靶标来进行药物的设计和开发。然而,由于在人和实验动物模型中lncRNA序列之间缺乏保守性以及对lncRNA的功能和机制研究尚处于初期阶段,可能会使相关治疗方法的开发复杂化[3]。lncRNA是利用多种机制调控哺乳动物稳态和发育的关键调控因子,随着高通量测序技术的发展,越来越多的新lncRNA被发现[4]。随着畜牧业和生物医学的发展,对生猪及模型猪的需求越来越大,而猪的繁殖力决定其生产效率,其中与流产相关的病毒感染对于母猪的繁殖效率产生很大影响,如猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪细小病毒(Porcine parvovirus,PPV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪圆环病毒2型(Porcine circovirus type 2,PCV2)等,给养殖业带来巨大的经济损失[5]。病毒感染宿主会触发一系列反应,其中强大的免疫反应对病毒的清除至关重要[6]。以往研究病毒与宿主相互作用的机制主要从宿主或病毒的蛋白质或基因组DNA的角度着手[7],但近十年,随着lncRNA研究的兴起,越来越多的研究数据表明,病毒感染宿主后lncRNA发生了差异性变化并发挥了重要的调控作用[8]。作者主要总结了lncRNA及其与猪流产相关病毒之间的关系、宿主lncRNA与病毒的互作及调控通路、目前存在的问题及应用前景,强调了lncRNA在猪流产相关病毒感染中的重要性,以期为猪的抗病育种、猪流产药物的开发及相关疾病的靶点治疗等提供理论依据。
1 lncRNA概述
1.1 lncRNA的定义和定位
lncRNA是一类转录本长度>200 nt、无特异完整的开放阅读框且无蛋白质编码能力的RNA分子[9]。随着测序技术的发展,已经揭示了一些lncRNA能翻译稳定的功能性小肽(也称为微肽),且一些lncRNA确实具有小的开放阅读框(sORF,长度<300 nt),可以编码具有关键生物学功能的短肽[10]。
近年来,RNA的亚细胞定位因为影响许多细胞过程而备受关注,lncRNA作为功能单元,使得其亚细胞定位对其功能影响至关重要[11]。lncRNA在细胞核、细胞质中都有定位,在细胞核中又分为定位在核质其他地方的lncRNA和聚集到特定核体的lncRNA(图1)。研究表明,lncRNA在细胞内的定位和分布受多种因素决定,包括核糖核酸的核保留元件、核内蛋白因子、高阶染色体结构以及RNA-蛋白质与lncRNA转录的耦合,但细胞内不同的lncRNA如何转运到特定的亚细胞区室并执行对基因的调控至今仍不清楚[12]。

图1 lncRNA在细胞内的定位和分布[12]
1.2 lncRNA的功能机制
lncRNA具有多种重要的功能,它可以局部调节染色质或基因表达,构成细胞核结构域的组成部分[13],对细胞增殖、周期、迁移、侵袭、自噬和凋亡等都有影响[14]。此外,许多疾病与lncRNA有关,如前列腺癌、结肠癌、阿尔茨海默病、心血管疾病和肺癌[15]。lncRNA主要通过与DNA、RNA、染色质、蛋白质互作发挥功能,如编码功能肽的lncRNA可通过许多不同的方式来调控基因表达和蛋白合成,参与染色质重塑、直接的转录调控及转录后的调控[16]。
lncRNA功能机制是多种多样的,包括作为脚手架、诱饵、向导和信号,可以正向或反向调节自身基因的表达,或靶向其他基因,通过与染色质复合物的相互作用来调节染色质的表观遗传景观[17]。作为脚手架时,lncRNA可以对相关的蛋白质或RNA进行识别和结合,使蛋白质或RNA募集到lncRNA上形成相关的复合物,从而调控靶基因[18](图2A);作为诱饵时,lncRNA可以诱导转录因子和其他蛋白质离开染色质或诱导蛋白质因子进入核亚域,从而对靶基因进行调控,此外,lncRNA还会诱使miRNA与其结合,从而影响mRNA的翻译(图2B);作为向导分子时,lncRNA可以指导蛋白复合物定位到特定调控位点,对靶基因进行调节(图2C);作为信号分子时,lncRNA的表达可以忠实地反映转录因子或信号通路的组合作用,指示基因在空间和时间上的调控(图2D)[19]。
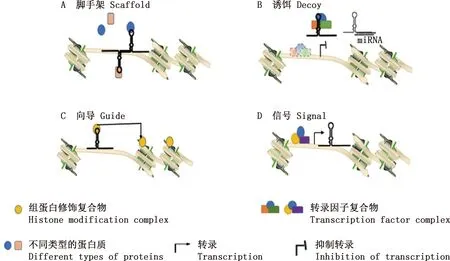
A,lncRNA作为脚手架,结合多种蛋白质并且稳定信号复合物,对靶基因进行调控;B,lncRNA作为诱饵,诱导转录因子、其他蛋白质和miRNA与其结合,参与转录和转录后调控,影响靶基因的表达;C,lncRNA作为向导,招募染色质修饰酶到靶基因,进行顺式和反式调控靶基因;D,lncRNA作为信号,指示基因在时间和空间上的调控
1.3 lncRNA的研究工具
破译lncRNA的功能和机制需要相应的研究工具,常用工具见表1。RNA-Seq在过去几十年发展迅速,能够生成高质量的深度测序,并在短时间内提供大量信息,能够对基因表达、可变剪切事件、大规模发现新的转录本、单核苷酸变异(single nucleotide variation,SNV)进行预测和功能注释[20],研究lncRNA的各种微扰策略包括CRISPR干扰(CRISPR interference,CRISPRi)、反义寡核苷酸(antisense oligonucleotides,ASOs)和RNA干扰(RNA interference,RNAi)。dCas9融合到KRAB抑制域,可以定向到特定的基因组位点以阻止转录,称为CRISPRi。CRISPRi允许在不编辑基因组的情况下抑制目标位点,从而避免主动调控元件的无意删除[21];ASOs是一种反义寡核苷酸,能够高效消耗细胞核中的lncRNA,已成功用于功能丧失的研究,如lncRNA MALAT1通过此方法提出了抑制乳腺癌进展的潜在疗法[22];RNAi是使用小的干扰RNA分子通过触发其降解来消耗靶转录本,在肝癌的研究中发现,牛磺酸上调基因1(taurine upregulated gene 1,TUG1)在肝癌细胞中表达上调,siRNA诱导的TUG1敲低不仅可降低免疫抑制,而且在体内外抑制了肿瘤的进展[23]。

表1 研究lncRNA的常用工具
使用ChIRP-MS和RAP-MS可以鉴定与lncRNA互作的蛋白质。ChIRP-MS是研究内源性核糖核蛋白复合物的一项新技术,它可以用来研究与lncRNA直接结合的蛋白质和扩展的蛋白质网络[24],而RAP-MS鉴定的蛋白质可能代表与lncRNA直接相互作用的蛋白质[25]。利用交联和免疫沉淀测序(CLIP-Seq)方法可以鉴定蛋白质与lncRNA结合部位的序列。CLIP-Seq首先用光反应或化学反应交联RNA和蛋白质;然后在体内捕获发生相互作用的RNA-蛋白质复合物;最后通过测序鉴定出蛋白质与RNA结合部位的序列,是一种蛋白质对应多种RNA的策略[26]。
lncRNA的功能与其在细胞内的分布有关,但相关的计算预测方法有限,主要包括lncLocator、Loc-lncRNA、Deep lncRNA和新开发的lncLocation[27]。对lncRNA进行定位可以采用荧光原位杂交(fluorescenceinsituhybridization,FISH),FISH已被证明是研究lncRNA定位的一种强大而通用的方法。在这种方法中,荧光反义探针与嵌入细胞的RNA靶杂交,并用荧光显微镜观察。利用此方法,lncRNA MEG3已被证明定位在细胞核中,而一种新型lncRNA CRNG定位在细胞质中[28-29]。
2 lncRNA与几种猪流产相关病毒的关系
病毒可经母猪的胎盘感染胎儿,几种猪流产相关的病毒均能够越过胎盘屏障,然而这些病毒通过胎盘的机制尚不明确[30]。虽然lncRNA与猪流产相关病毒的研究取得一定的进展,但相关的研究仍然处于初期阶段。
2.1 lncRNA与PRRSV
PRRSV是一种有包膜的正链RNA病毒,属于动脉病毒科,病毒粒子大致呈球形或椭圆形,直径为50~60 nm,外观相对光滑[31]。2017年,Zhang等[32]最早通过RNA测序对PRRSV感染猪肺泡巨噬细胞的lncRNA图谱进行了全基因组分析,共发现299种lncRNAs在病毒感染后差异表达,且在与病毒感染和免疫反应相关的途径中富集。Zhang等[33]研究发现,感染PRRSV后的猪子宫内膜上皮细胞的凋亡率明显高于对照细胞,差异表达的基因和lncRNA谱的整合分析表明,LTCONS_00010766和LTCONS_00045988的靶基因与细胞凋亡信号通路有关。lncRNA与炎症反应以及病毒诱导的干扰素产生高度相关。Gao等[34]对PRRSV感染猪肺泡巨噬细胞的lncRNA库分析发现,差异表达的lncRNA在炎症和病原体感染诱导的途径中富集,上调的lncRNA主要与NF-κB、Jak-STAT、TNF等信号通路相关,而下调的lncRNA主要在PI3K-Akt、MAPK和趋化因子信号通路中富集。为了探究lncRNA在PRRSV感染增殖中的作用,吴俊静等[35]基于构建的猪lnc-00649超表达载体和实时荧光定量PCR技术发现,lncRNA能够抑制PRRSV的复制。进一步探究抑制PRRSV复制的机制,王京煜等[36]研究表明,Marc-145细胞内Wnt/β-catenin信号通路的活性与lncRNA NEAT1中的C4段区域有关,C4段区域增强了信号通路有关转录因子的活性,从而使PRRSV的复制下降。此外,Zhang等[37]研究发现,猪肺泡巨噬细胞中的lnc_000397被PRRSV感染后发生了明显的上调,并通过上调干扰素刺激基因(IFN-stimulated gene,ISG)表达而抑制PRRSV复制。
2.2 lncRNA与PRV
PRV也称为Aujeszky病病毒(Aujeszky disease virus,ADV),是一种有包膜的双链线性DNA病毒,属于疱疹病毒科,是一种猪的病原体,但可以感染各种哺乳动物,在全球范围内造成毁灭性疾病和经济损失[38]。2018年,Guan等[39]最早开展了PRV的lncRNA研究,PRV不仅可以产生病毒编码的lncRNA,还可以诱导宿主lncRNA的差异表达,基于高通量测序、Northern blotting和实时荧光定量PCR技术鉴定和验证了3种病毒lncRNAs和几种宿主lncRNAs,其中病毒lncRNA LDI可能调节IE180的表达,而IE180是病毒基因的有效转录激活剂,此外,病毒lncRNA不仅可以在上皮细胞中表达,而且还可以在受感染的原代鸡背根神经节(dorsal root ganglion,DRG)培养物中表达。2020年,Jin等[40]基于RNA-Seq、实时荧光定量PCR、Western blotting技术首次揭示了病毒和gE-TK-PRV-Ⅱ感染细胞中宿主lncRNA的表达谱,将lncA02830进行沉默后发现,干扰素调节因子3(interferon regulatory factor 3,IRF3)、干扰素β(interferon β,IFN-β)和黏液病毒抗性蛋白1(Myxovirus 1,MX1)的转录水平均显著上调,PRV-Ⅱ的复制发生了抑制,这一研究首次从lncRNA的角度对宿主与PRV-Ⅱ相互作用的机制进行了探索。2021年,Fang等[41]基于RNA-Seq、实时荧光定量PCR、间接免疫荧光试验、敲低和过表达技术发现,lnc_000641是由PRV感染显著诱导的,对PRV体外复制有深远影响,通过抑制JAK/STAT1途径下调IFN-α的产生来抑制对PRV感染的先天免疫应答,从而增加PRV的复制。CTO-S是位于PRV基因组的lncRNA,苏乐等[42]根据CTO-S的全长序列设计了相关引物并成功构建了CTO-S的缺失株和回复突变株,感染PK-15细胞后发现CTO-S诱导了细胞的凋亡;进一步利用RNA pulldown联合质谱方法分析发现,病毒的lncRNA-CTO-S与泛醇细胞色素C还原酶的组成部分互作。
2.3 lncRNA与脑心肌炎病毒
脑心肌炎病毒(Encephalomyocarditis virus,EMCV)是一种非包膜单链RNA病毒,具有直径为30 nm的二十面体衣壳。EMCV不仅会引起心肌炎,而且会对许多哺乳动物的神经系统造成破坏,导致母猪在受到病毒感染后发生流产现象[43]。对于EMCV相关的lncRNA,目前只有Nishitsuji等[44]于2016年做过相关研究,结果发现,lncRNA#32的沉默显著降低了ISG的表达水平,导致细胞对EMCV感染具有敏感性。基于RNA pulldown联合质谱和RNA免疫沉淀发现,lncRNA#32与核内不均一核糖核蛋白U(heterogeneous nuclear ribonucleoprotein U,hnRNP U)直接结合;使用生物素化的lncRNA#32进行pulldown测定发现,hnRNP U和激活转录因子2(activating transcription factor 2,ATF2)是相互作用的蛋白质。lncRNA#32在先天免疫反应中很重要,且在抗病毒免疫中具有重要作用。EMCV是一种对人畜都有危害的重要的病原体,但目前通过lncRNA来研究EMCV和宿主关系的报道很少,还需要进行深入的探索。
2.4 lncRNA与日本脑炎病毒
日本脑炎病毒(Japanese encephalitis virus,JEV)是一种经蚊子传播的嗜神经性黄病毒,归类为黄病毒科黄病毒属,由1个长约10 kb的正义RNA基因组组成。JEV感染对猪的影响最为明显,易导致猪的流产、死产和出生缺陷等重大生殖问题[45]。2017年,Li等[46]利用微阵列平台、实时荧光定量PCR、GO功能及KEGG通路分析、lncRNA-mRNA共表达网络分析的整合进行了基因组学和生物信息学研究,揭示了与JEV感染相关的宿主lncRNA表达模式,表明已鉴定的lncRNA可用作JEV的潜在治疗靶点。为了探究JEV介导的炎症反应,李运川[47]用JEV感染了小鼠的脑组织,对热图和火山图的数据进行分析,并利用实时荧光定量PCR验证了相关差异表达的lncRNA,其中对lncRNA E52329和N54010进行了干扰,通过Western blotting试验证明了lncRNA E52329和N54010调控MKK4/7-JNK信号通路中相关转录因子的活性。2021年,Zhou等[48]以猪lncRNA-SUSAJ1作为研究目标,实时荧光定量PCR结果显示,lncRNA-SUSAJ1在感染后36 h显著增加,但在感染后48 h显著降低,过表达或敲低lncRNA-SUSAJ1后的数据证实lncRNA-SUSAJ1会使JEV的增殖受到抑制;进一步基于抑制剂的筛选、lncRNA-SUSAJ1启动子区域的数据库分析和Western blotting分析证实,CCR1下调SP1的mRNA水平并减少了SP1在lncRNA-SUSAJ1启动子区域的募集,从而实现对lncRNA-SUSAJ1表达的调控。为了获得PK-15细胞在受到JEV感染后lncRNA差异表达的数据,朱静静等[49]首先利用测序技术获得了所有发生上调与下调的lncRNA,并通过实时荧光定量PCR验证了测序结果;随后通过GO功能及KEGG通路分析发现,先天性免疫反应的相关基因是lncRNA的主要靶基因,这些靶基因富集于100多条信号通路,但主要富集于炎症和免疫相关的信号通路,为进一步研究lncRNA和JEV的关系提供了理论依据。
2.5 lncRNA与CSFV
CSFV是一种对猪的繁殖有重大危害的病毒,它是一种ssRNA病毒且具有包膜,属于黄病毒科瘟病毒属。研究发现,CSFV可以感染多种细胞,包括树突状细胞和巨噬细胞,导致养猪业的重大经济损失。但在CSFV感染的细胞中没有明显的细胞病变效应,相反持续的感染会导致宿主免疫抑制[50]。孟星宇[51]利用猪的外周血单个核细胞,通过CSFV感染细胞后获得的测序结果发现4万多个新的lncRNAs分子;基于GO功能及KEGG通路分析、敲低或过表达试验成功筛选出1个新的功能性lncRNAs_2522,当1ncRNAs_2522在细胞内过表达后,它会使2′,5′-寡腺苷酸合成酶2(2′,5′-oligoadenylate synthase 2,OAS2)在细胞内的转录水平下降,而OAS2是一种通过干扰素诱导的抗病毒蛋白,它具有抑制CSFV复制的作用[52]。目前关于CSFV复制的研究报道较多,但其发病机制尚不明确,且CSFV相关的lncRNA研究报道较少,lncRNA与CSFV的关系仍有待进一步的研究。
3 宿主lncRNA与病毒的互作及相关调控通路
lncRNA对先天免疫和病毒复制既具有积极影响,又具有消极的影响。有的lncRNA参与抗病毒反应,而有的lncRNA可能对病毒有益[53]。针对病毒的感染,lncRNA参与先天免疫反应和特异性免疫,许多功能性的lncRNA通过调节转录因子(transcription factor,TFs)的活性、细胞因子的转录或ISG的表达参与抗病毒先天免疫反应[54](图3)。NF-κB是经过深入研究的促炎转录因子之一,其活性失调会导致炎症及癌症等许多疾病的发生[55]。

A,Lethe、MALAT1和lincRNA-p21通过与p65直接结合调节促炎转录因子NF-κB的活性。B,HOTTIP通过与c-jun结合来促进IL-6的表达;CASC11过表达抑制IL-9的表达;lncRNA NeST反式招募WDR5促使IFN-γ的表达;PVT1通过海绵化miR-211-3p上调TNF-α;IVRPIE通过与hnRNP U的相互作用,调控IFN-β1和几个ISGs的转录
宿主lncRNA作为脚手架、诱饵或翻译后修饰调节转录因子的活性,如Lethe、MALAT1和lincRNA-p21主要位于细胞核,与p65直接结合并阻止p65/p50异源二聚体与靶启动子结合[56]。lncRNA调控产生的细胞因子包括白介素(interleukin,IL)、IFN-γ和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)[57]。lncRNACASC11是几种癌症的癌基因,CASC11基因的过表达导致了血管平滑肌细胞的凋亡率增加和IL-9的下调,而IL-9的激活可能导致大量下游lncRNA的表达改变[58]。lncRNA HOTTIP是评估多种癌症预后的重要生物标志物,在卵巢癌细胞中,HOTTIP通过与c-jun结合来促进卵巢癌细胞IL-6的表达和分泌,分泌的IL-6通过与癌细胞周围嗜中性粒细胞表面的IL-6受体结合来刺激PD-L1的表达,从而进一步促进细胞凋亡,导致卵巢癌细胞的免疫逃逸[59]。lncRNA NeST位于小鼠和人的IFN-γ编码基因附近,核lncRNA NeST主要进行反式作用的调控,它招募WDR5(H3K4甲基转移酶复合物的组分)以增加IFN-γ编码DNA的组蛋白3甲基化,然后促进其邻近基因的转录[60]。PVT1是一种促进肿瘤的lncRNA,在调节炎症方面发挥作用,通过海绵化miR-211-3p上调滑膜细胞中的TNF-α,并诱导软骨细胞凋亡[61]。甲型流感病毒(Influenza A virus,IAV)感染患者血液免疫细胞后,鉴定出一种新型的lncRNA IVRPIE,参与抗病毒先天免疫。IVRPIE对hnRNP U进行了识别与结合,形成的复合物对IFN-β1和几个ISG启动子区的组蛋白进行了修饰,从而调控了IFN-β1和几个ISG的转录[62]。
4 小 结
lncRNA在生物体内发挥着重要的调节功能,在某些发育阶段、组织和疾病状态中发生特异性表达,可以作为生物标记物和新兴的治疗靶点。研究表明,一些猪流产相关病毒可经胎盘感染胎儿,但机制尚不明确,对lncRNA与猪流产相关病毒关系的研究有望从新的视角揭示病毒经胎盘感染胎儿的作用方式及机制。目前,关于lncRNA与猪流产相关病毒感染的关系已取得了一定进展,但仅有作者介绍的这些猪流产相关病毒涉及lncRNA的研究,且相关研究处于早期阶段,通过试验验证的功能性lncRNA有限,猪的lncRNA数据库尚不完整,猪流产病毒感染期间lncRNA介导的抗病毒调节网络尚不清晰。今后应深入研究lncRNA与猪流产相关病毒的关系,挖掘更多的功能性lncRNA,完善猪的lncRNA数据库,并详细阐明猪流产相关病毒感染期间lncRNA介导的抗病毒调节网络。相信随着越来越多的功能性lncRNA被挖掘,以及lncRNA介导的抗病毒调节网络被阐明,lncRNA作为流产相关疾病的诊断标记分子和作为靶点治疗的作用将会越来越凸显。
