新型鸭呼肠孤病毒分离鉴定及其σC基因序列分析
2022-09-22阴雅洁李松励侯绍华
张 薇,武 华,阴雅洁,李松励,侯绍华
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.河北农业大学动物医学院,保定 071000)
新型鸭呼肠孤病毒病是由新型呼肠孤病毒(Novel duck reovirus,NDRV)感染番鸭、半番鸭和北京鸭等多品种鸭引起的一种以肝脏和脾脏出现肿大坏死、出血为主要病理变化的一种免疫抑制性鸭传染病[1]。自2017年以来,该病在中国多地鸭场相继暴发,与以往报道的鸭呼肠孤病毒相比,NDRV的致病性更强,宿主范围更广,死亡率更高,给中国养鸭业造成严重的经济损失[2-4]。NDRV属于呼肠孤病毒科正呼肠孤病毒属成员,粒子直径为70~80 nm,基因组由10个节段的双链RNA组成[5-6]。NDRV σC蛋白由S1基因编码,是病毒外衣壳的次要成分,是病毒结合细胞受体的作用位点,能够诱导宿主产生中和抗体[7-8]。对水禽源呼肠孤病毒的研究表明,外衣壳蛋白(μB、σB和σC)编码基因的序列变异性显著高于其他基因节段,σC蛋白编码基因节段的变异性最高,因此,σC基因更适合于不同毒株的鉴别[9]。
目前,国内外鲜有预防和治疗NDRV的生物制品[10]。尽管抗禽呼肠孤病毒(Avian reovirus,ARV)和番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)的疫苗可以降低呼肠孤病毒感染的风险,但NDRV与禽呼肠孤病毒、番鸭呼肠孤病毒抗原是否有交叉保护,相关禽呼肠孤病毒和番鸭呼肠孤病毒的疫苗能否有效预防新型鸭呼肠孤病毒病,有待进一步研究。由于呼肠孤病毒科的核酸属于多节段基因,以及RNA聚合酶缺乏校正功能,导致病毒容易发生基因重组或抗原变异,产生新的致病性毒株,呼肠孤病毒的这个特性为研制有效的疫苗提出了挑战[11]。因此,NDRV的分离与鉴定对疫苗毒株候选苗的筛选具有重要意义。为了掌握病毒病原特点及遗传进化规律,本研究从河北某鸭场采集疑似NDRV感染病鸭的肝脏和脾脏,通过RT-PCR、透射电镜观察、间接免疫荧光法(IFA)鉴定病毒,并对分离得到的病毒进行σC基因测序和遗传进化分析,以确定病毒来源及进化规律,以期为新型鸭呼肠孤病毒病的防控和疫苗的研发提供依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 10份肝脏和脾脏病料采自河北某养殖场的疑似NDRV感染的鸭。
1.1.2 鸡胚、细胞、试验动物 10枚9日龄SPF鸡胚(北京勃林格殷格翰维通生物技术有限公司);鸡肝癌细胞(LMH)和仓鼠肾成纤维细胞(BHK)(中国农业科学院北京畜牧兽医研究所兽医公共卫生实验室保存)。10只7日龄北京鸭(北京南口北京鸭育种中心)。
1.1.3 主要试剂及仪器 AxyPrep病毒DNA/RNA小量试剂盒(北京三博志业生物技术有限公司);EasyScript One-Step RT-PCR SuperMix (+dye)、Trans2K®Plus DNA Marker(北京全式金生物技术有限公司);50×TAE(北京萃锋科技有限公司);琼脂糖(北京康润诚业生物科技有限公司);特级胎牛血清(FBS)、牛血清白蛋白(BSA)、青-链霉素(北京中创宏达科技有限公司);F12培养基(北京依珊汇通科技有限公司);DMEM培养基(英潍捷基(上海)贸易有限公司);NDRV阳性血清由中国农业科学院北京畜牧兽医研究所兽医公共卫生实验室制备并保存。FITC-兔抗鸭IgY IgG(H+L)(苏州博特龙免疫技术有限公司);Triton X-100(北京索莱宝科技有限公司);DAPI Fluoromount-GTM 抗荧光淬灭封片剂(翌圣生物科技(上海)股份有限公司)。透射电子显微镜(型号:HT770);激光共聚焦显微镜(型号:TCS SP8)。
1.2 病料的处理
剖检发病鸭可见肝脏和脾脏出现坏死,出血,采集肝脏和脾脏,剪碎并研磨,与生理盐水按照1∶5的比例用匀浆机制成匀浆,加入1 000 IU青霉素、链霉素处理12 h后,―80 ℃反复冻融3次,8 000 r/min离心20 min,取上清无菌分装,―80 ℃保存备用。
1.3 病毒的分离及鉴定
1.3.1 病毒的分离 将上述过滤后的病毒上清液经尿囊腔无菌接种9日龄SPF鸡胚,0.2 mL/枚,并用等量的加有双抗的生理盐水作为阴性对照,37 ℃温箱继续培养,每天观察2次,弃去24 h内死亡的鸡胚,连续观察5 d,收集死亡鸡胚,4 ℃展示柜放置过夜,观察剖检死亡鸡胚,在鸡胚上连续传3代,无菌收获鸡胚和尿囊液,-80 ℃保存备用。
1.3.2 病毒的血凝特性鉴定 对收获的第3代鸡胚尿囊液参照《中华人民共和国兽药典》[12]进行血凝试验,以新城疫病毒为阳性对照。具体步骤如下:在96孔微量板上,从第1至10孔,每孔加入PBS 25 μL,随后吸取第3代鸡胚尿囊液25 μL,从第1孔起,依次做2倍系列稀释(稀释度依次为1∶21、1∶22、1∶23、1∶24、1∶25、1∶26、1∶27、1∶28、1∶29、1∶210)。每孔加入1%鸡红细胞25 μL,并设不加第3代鸡胚尿囊液的红细胞为对照,立即在微量板振摇器上摇匀,室温静置30 min,倾斜96孔微量板,观察分离株是否能凝集鸡红细胞。
1.3.3 病毒PCR鉴定 根据GenBank上已公布的NDRV σC基因序列(登录号:KJ879930.1),选择保守区域运用Oligo 7.0设计NDRV特异性检测引物,引物序列:F:5′-ATCAAATCCCTCC-AAAGC-3′;R:5′-CAGCCATAAAGGAAGCAG-3′,预期扩增片段大小为727 bp。引物由苏州金唯智生物技术有限公司合成。根据AxyPrep病毒DNA/RNA小量试剂盒说明书提取第3代鸡胚尿囊液中病毒RNA,以RNA为模板,RNase-free ddH2O代替RNA模板作为阴性对照,利用EasyScript One-Step RT-PCR SuperMix (+dye)进行RT-PCR扩增。PCR反应体系20 μL:RNA模板5 μL,上、下游引物(10 μmol/L)各0.4 μL,2×ES One-Step Reaction Mix 10 μL,EasyScript®One-Step Enzyme Mix 0.4 μL,RNase-free ddH2O补至20 μL。PCR反应程序:45 ℃孵育30 min;94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸42 s,共35个循环;72 ℃延伸10 min。将PCR产物进行1.0%琼脂糖凝胶电泳检测。同时,参考李静[13]禽呼肠孤病毒、鸭病毒性肝炎病毒(DHV)、鸭坦布苏病毒(DTMUV)、鸭瘟病毒(DPV)、禽腺病毒4型(FAdV-4)的引物对上述提取的第3代鸡胚尿囊液中的病毒RNA进行PCR检测。
1.3.4 病毒纯化及电镜观察 将第3代鸡胚尿囊液4 ℃、8 000 r/min离心1 h,取上清,4 ℃ 32 000 r/min离心3 h,弃上清,用少量PBS重悬沉淀,4 ℃、12 000 r/min离心10 min取上清,即为纯化的病毒液,用3%磷钨酸负染后通过透射电镜观察病毒粒子的形态及大小。
1.3.5 病毒的间接免疫荧光鉴定 将BHK细胞培养于放有爬片的24孔板中,长满单层后接种第8代病毒液,以不接种病毒液为阴性对照,当接种病毒液的细胞出现明显病变时,用适量4%多聚甲醛覆盖细胞室温固定15 min,PBS洗3遍,在冰上用0.1% Triton X-100孵育15 min透化细胞,PBS洗3次,用5% BSA孵育1 h,加入NDRV阳性血清(1∶400稀释),4 ℃孵育过夜,PBS洗3次,加入FITC标记的兔抗鸭IgY IgG(H+L)(1∶1 000稀释)37 ℃避光孵育1 h,PBS洗3次,最后取细胞爬片倒放于滴有抗荧光淬灭封片剂(含DAPI)的载玻片上进行封片,置于激光共聚焦显微镜下观察并拍照。
1.4 病毒的体外细胞培养
取经PCR鉴定为NDRV阳性并纯化的病毒液分别接种BHK和LMH细胞,每12 h观察1次,继续培养3 d或当细胞病变达到70%~80%时收获病毒,反复冻融3次,连续盲传8代,同时设正常细胞作为阴性对照,观察病毒增殖产生的细胞病变。
1.5 动物回归试验
将1.3.1中无菌收获的鸡胚,按照1∶5(W/V)的比例加入生理盐水制成匀浆,用青-链霉素处理12 h,―80 ℃反复冻融3次,8 000 r/min离心1 h,取上清用0.22 μm滤器过滤除菌。将10只7日龄健康雏鸭分为试验组和对照组,每组5只。试验组皮下接种纯化的病毒(1 mL/只),对照组注射等体积生理盐水。隔离饲养7 d,每天观察雏鸭发病情况,接种后第7天全部处死,剖检观察其肝脏和脾脏的病理变化。
1.6 病毒σC基因的扩增与序列分析
根据GenBank上NDRV σC基因序列(登录号:KJ879930.1),选择两端保守区域设计扩增σC基因完整开放阅读框(ORF)的特异性引物,引物序列为:F:5′-ATGGATCGCAACGAGGTGA-3′;R:5′-ATGAA-TAGCTCTTCTCATCGC-3′,预期扩增片段大小为997 bp,引物由苏州金唯智生物技术有限公司合成。提取第3代鸡胚尿囊液RNA,以RNase-free ddH2O代替RNA模板作为阴性对照,参照1.3.3 RT-PCR扩增体系和扩增程序进行扩增,用胶回收试剂盒回收扩增产物,连接pMD19-T克隆载体,转化大肠杆菌DH5α感受态细胞,挑取菌落进行PCR鉴定后将阳性菌株送至苏州金唯智生物技术有限公司测序。利用Mega 7.0对NDRV σC基因与GenBank中已发表的其他NDRV σC基因序列进行遗传进化分析和相似性比对。同时比对分离株与灭活疫苗TH11株(KC493571.1)和弱毒疫苗JS01-105P株(V202168)σC蛋白氨基酸序列并进行分析。
2 结 果
2.1 病毒的分离
由图1可知,鸡胚在接毒后出现死亡,死亡鸡胚全身出血,充血严重,有弥散针尖样出血点,剖检病变可见肝脏出血肿大,脾脏有出血点。
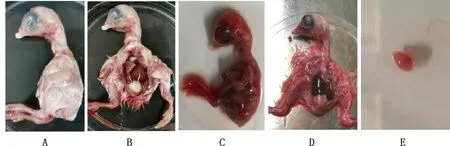
A、B,正常鸡胚;C、D,死亡鸡胚;E,死亡鸡胚的脾脏
2.2 病毒的血凝特性鉴定
由图2可知,NDRV分离株反应孔均呈线状流下,阳性对照反应孔呈完全无线状流下(100%凝集)的最高稀释倍数为1∶24,即血凝效价为1∶24,该NDRV分离株对鸡红细胞不具有血凝活性。

图2 NDRV分离株血凝特性的测定
2.3 病毒PCR鉴定
病料上清液PCR鉴定结果显示,在约727 bp处可见NDRV条带,与预期大小一致,禽呼肠孤病毒、鸭病毒性肝炎、鸭坦布苏病毒、鸭瘟病毒、禽腺病毒血清4型检测结果均为阴性(图3)。说明成功分离NDRV,命名为BD/CHN/2020。

M,DL5000 DNA Marker;1,NDRV;2,阴性对照;3,禽呼肠孤病毒;4,鸭病毒性肝炎病毒;5,鸭坦布苏病毒;6,鸭瘟病毒;7,禽腺病毒4型
2.4 病毒的透射电镜鉴定
由图4可知,病毒经3%磷钨酸染色后,透射电镜观察可见直径为60~80 nm、无囊膜、球形的病毒粒子,与NDRV形态和大小相符。

图4 BD/CHN/2020株透射电镜观察结果(40 000×)
2.5 病毒的间接免疫荧光鉴定
由图5可知,接种BD/CHN/2020株的BHK细胞在细胞质显现特异性绿色荧光,未接种BD/CHN/2020株的BHK细胞无特异性绿色荧光。说明病毒感染BHK细胞后能够表达相关蛋白。

图5 BD/CHN/2020株间接免疫荧光检测结果(200×)
2.6 病毒的体外细胞培养
由图6可知,BD/CHN/2020株接种BHK细胞传至第5代后,48 h出现明显细胞病变,细胞聚集成团,形成大量的合胞体,然后细胞逐渐拉网脱落;接种LMH细胞传至第2代后,72 h出现明显细胞病变,细胞圆缩、聚集,形成合胞体。

A,BD/CHN/2020株接种BHK细胞盲传至第5代,接种48 h;B,BD/CHN/2020株接种LMH细胞盲传至第2代,接种72 h;C,正常BHK细胞培养48 h;D,正常LMH细胞培养72 h
2.7 动物回归试验
将过滤除菌的鸡胚上清液皮下注射7日龄健康的北京鸭,接种后第2天发病鸭精神沉郁,眼周湿润、泪痕明显,排白色稀粪,至第7天5只全部发病,死亡3只。试验组发病率为100%,死亡率为60%。由图7可知,剖检死亡鸭可见脾脏肿大、呈暗红色,有大小不一的白色坏死灶,部分出现肝脏肿大,有白色坏死灶和出血斑。对照组肝脏和脾脏无明显病变。

图7 BD/CHN/2020株感染雏鸭脾脏和肝脏剖检病变
2.8 病毒σC基因的扩增与序列分析
由图8可知,第3代鸡胚尿囊液经RT-PCR扩增,在约997 bp处得到单一σC基因条带,与预期大小一致。利用Mega 7.0将本研究分离的BD/CHN/2020株与GenBank中其他已发表的禽源呼肠孤病毒毒株进行σC基因的遗传进化分析,由图9和表1可知,NDRV σC基因核苷酸系统进化树分为2大进化分支,鸡源支和水禽支,BD/CHN/2020株与NDRV不同毒株在同一分支,相似性高达92.9%~99.7%,其中与NDRV SY亲缘关系最近,相似性达99.7%,而与番鸭呼肠孤病毒、禽呼肠孤病毒相似性较低,分别为52.0%~53.5%、27.0%~27.6%;BD/CHN/2020株与灭活疫苗TH11株和弱毒疫苗JS01-105P株相比,与灭活疫苗TH11株核苷酸相似性为98.2%,而与弱毒疫苗JS01-105P株相似性略低,为97.7%。经σC蛋白氨基酸相似性比对,BD/CHN/2020株与其他NDRV参考株相似性为86.0%~97.7%。由表2可知,与TH11株相比,BD/CHN/2020株第93位氨基酸由S变为T,第132位氨基酸由T变为A,第158位氨基酸由Q变为H,第253位氨基酸由V变为A,第298位氨基酸由A变为V,与JS01-105P株相比,BD/CHN/2020株第120位氨基酸由P变为T。

M,DL5000 DNA Marker;1,第3代鸡胚尿囊液;2,阴性对照

图9 基于NDRV σC基因核苷酸序列的遗传进化树

表1 σC基因核苷酸和氨基酸序列相似性比对
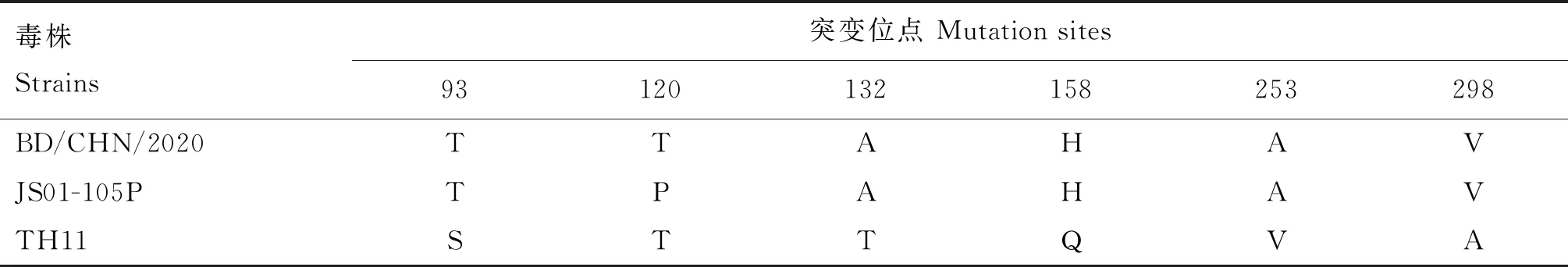
表2 BD/CHN/2020株氨基酸突变位点
3 讨 论
NDRV由于其高致病性和广泛的宿主谱而严重损害了水禽业,该病毒最早发现于南方,近几年中国北方地区相继有关于新型鸭呼肠孤病毒病的报道,感染鸭早期无明显特异性症状,剖检特征性病变为脾脏出血或坏死,耐过病鸭生长发育缓慢[14-16]。因此,了解NDRV的病原学和流行病学对于控制该病发生十分重要。本研究通过PCR、透射电镜观察、间接免疫荧光法鉴定,并对分离毒株进行了σC基因的测序和遗传进化分析,以了解其病原学特性和流行情况。在病毒的分离试验中,BD/CHN/2020株对SPF鸡胚有致病性,且能引起与鸭感染NDRV相似的病理变化,与刘晓丽等[17]报道一致,提示BD/CHN/2020株有垂直传播感染鸡群、导致雏鸡免疫抑制的可能。因此,在实际的养殖过程中,尤其是种鸡场、孵化场,要防止鸭呼肠孤病毒对鸡胚的污染,切断传播途径,预防鸡群感染鸭呼肠孤病毒的可能性。最先采用BHK细胞进行病毒培养发现,该毒株在BHK细胞上适应5代以上才能产生细胞病变,这可能会导致毒力减弱或基因突变,基于此,尝试采用LMH细胞进行病毒分离培养,结果发现,传至第2代即出现明显的细胞病变,建立了NDRV低代次分离培养的方法,为其病原学特性的评价奠定基础。动物回归试验结果表明,攻毒鸭全部发病,剖检后发现与鸭场发病鸭相似的病理变化,主要表现为脾脏肿大坏死出血,部分肝脏出现肿大,有白色坏死灶和出血斑,与Farkas等[3]报道的以肝脏和脾脏表面有针头大的白色坏死点为病理特征的番鸭呼肠孤病毒有所不同,与武鸿等[18]报道的以脾脏肿大、坏死,呈暗红色为主要病变的NDRV分离毒株一致,更符合NDRV的病理变化。BD/CHN/2020株可能与南方NDRV的传播密切相关,NDRV最早发生于南方,北方较南方少,近几年NDRV流行范围从南方扩散到北方,北方多地相继出现NDRV感染的报道[19],遗传进化分析结果显示,该毒株与NDRV不同毒株在同一分支,与2018年由晁锦等[20]在江苏省沭阳某发病鸭场分离得到的NDRV SY株核苷酸序列相似性最高,为99.7%,所以推测BD/CHN/2020株的出现可能与南方NDRV的传播有关。
σC蛋白是病毒外衣壳的次要成分,能够诱导机体产生保护性中和抗体,σC蛋白作为病毒结合细胞受体的主要位点,对病毒的吸附、合胞体的形成有重要影响,并促进病毒的侵袭[21-22]。目前商品化的鸭呼肠孤病毒病疫苗仅有番鸭呼肠孤病毒活疫苗(CA株),对NDRV σC基因序列分析显示,BD/CHN/2020株与番鸭呼肠孤病毒核苷酸序列相似性为52.0%~53.5%,相似性较低,在免疫过程中产生的中和抗体可能会有所不同,导致番鸭呼肠孤病毒活疫苗(CA株)对NDRV保护不完全,其他NDRV疫苗还处于试验研究阶段。比对BD/CHN/2020株与灭活疫苗TH11株(KC493571.1)和弱毒疫苗JS01-105P株(V202168)σC氨基酸序列均发生了突变,有文献表明2017年及以后的NDRV分离株在σC氨基酸位点132A、138R、158H和258A处存在特异性突变[23],NDRV分离株可能正在不断的变异和进化,BD/CHN/2020株与2011年发现的TH11株(KC493571.1)相比发生了5个氨基酸突变位点中132A、158H印证了这一点。σC蛋白氨基酸位点的突变有可能改变病原的感染能力,从而引起病原的抗原发生变异,引起疫苗保护不完全的问题。因此,应加强对NDRV的流行情况和病原特点的掌握、早期落实综合防治措施和改善养鸭管理制度、研发新疫苗等,控制该病的暴发和流行,使中国养鸭业健康发展。
4 结 论
本研究成功分离得到1株NDRV,其可在BHK、LMH细胞上稳定增殖产生细胞融合病变并致死鸡胚,感染雏鸭后产生典型的NDRV病理变化,与国内NDRV疫苗株相比第93、120、132、158、253和298位氨基酸处发生了突变,结果为进一步研发有效的NDRV新疫苗及其防控奠定基础。
