二花脸猪ABCG8基因的蛋白功能与组织表达分析
2022-09-21周欣怡张金璧陈宽凤倪佳怡徐世永程泽信
周欣怡,张金璧,陈宽凤,倪佳怡,丁 悦,徐世永,程泽信
(金陵科技学院动物科学与食品工程学院, 江苏 南京 210000)
二花脸猪是原产于江苏中南部地区的特色地方猪种,不仅性情温和,耐粗饲,而且肉质优良,肌内脂肪含量高,风味浓郁。此外还具有产子率高、繁殖寿命长等优异的繁殖性能。但在优势明显的同时,二花脸猪具有生长速度慢、背膘厚、瘦肉率较低的特点[1-2]。相对于西方猪种,如大白猪等稳定较低的肌内脂肪含量(约2%),成年二花脸猪的肌内脂肪含量可高达5%。Maria等[3]发现ABC转运蛋白(ATP-binding cassette transporter)超家族成员之一的ABCG8不仅是猪脂质代谢关键基因,同时与肌内脂肪沉积有关。Henry等[4]发现饲料转化率高的猪在营养物质代谢循环速度上具有优势,而ABCG8在饲料转化率高的猪中表达量偏低。因此,ABCG8可能在二花脸猪较慢的生长速度和高脂含量的肉质特色性状形成中起到重要作用。
ABC转运蛋白(ATP-binding cassette transporter),又称ATP结合盒式蛋白,是目前已知规模最大的一类跨膜转运蛋白超家族,在所有原核生物和真核生物中均有分布,且一般广泛存在于细胞质膜中,担负着细胞物质转运功能[5]。已知的人类基因组总共含有48个ABC基因,根据不同的结构可分为7个家族,即ABCA、ABCB、ABCC、ABCD、ABCE、ABCF和ABCG。在人类和小鼠研究中发现,ABCG8能与ABCG5在内质网中组装形成异源二聚体,该二聚体移动到细胞膜发挥作用,作为将胆固醇分子向细胞外运输的通道,是维持动物体内胆固醇代谢平衡的重要分子[6]。目前对该基因的研究在植物甾醇血症的相关研究中报道较多,而在肝细胞中,ABCG8和ABCG5的功能主要是将胆固醇分泌到胆汁中,从而抑制胆固醇的吸收,与负责胆固醇摄取的关键蛋白NPC1L1(胆固醇转运蛋白)作用相反,二者共同维持机体胆固醇平衡[7-8]。ABCG8在猪分子育种和改良中具有较大潜力,然而其在猪脂质代谢中的功能研究关系尚未见报道。
本研究旨在以低生长速度和高脂含量的二花脸猪为研究对象,通过生物信息学方法对ABCG8编码蛋白的高级结构、理化性质以及生物学功能进行分析,并通过PCR技术分析ABCG8基因在猪内脏和肌肉组织中的表达特征,为进一步研究ABCG8在猪脂质代谢中的生物学功能,并加以利用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1试验动物 3头约200日龄的健康雄性二花脸猪,于宿迁市沭阳县生猪定点屠宰场常规屠宰后,采集肝、肺、肾、脾、胰、小肠、背最长肌组织样本,用生理盐水冲洗干净,迅速投入液氮中保存并运回实验室后,转入-80℃超低温冰箱中保存。
1.1.2主要试剂与仪器 组织RNA提取试剂盒购自北京全式金生物技术股份有限公司,PrimeScript RT Master Mix反转录试剂盒购自南京诺唯赞公司,AceQ®qPCR SYBR Green Master Mix试剂盒购自南京诺唯赞公司。
1.2 试验方法
1.2.1生物信息学分析 根据NCBI上猪ABCG8基因的预测序列(登录号:XM_021087570.1)及相应预测蛋白序列(XP_020943229.1)进行生物信息学分析。ABCG8的理化性质由ProtParam(https://www.expasy.org/resources/protparam/)进行分析;ABCG8蛋N-糖基化位点及O-糖基化位点分别由NetNGlyc 1.0 Server(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)和YinOYang 1.2(https://services.healthtech.dtu.dk/service.php?YinOYang-1.2)进行预测;信号肽位点由SignalP-5.0 Server(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)进行分析;蛋白磷酸化位点由NetPhos3.1 (http://www.cbs.dtu.dk/services/NetPhos/)进行预测;亚细胞定位分析由PSORT II Prediction TargetP-2.0(https://psort.hgc.jp/form2.html)进行;蛋白质跨膜结构域使用DeepTMHMM(https://services.healthtech.dtu.dk/service.php?DeepTMHMM)进行预测;ABCG8编码蛋白的二级机构和三级空间构型分别由SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(http://swissmodel.expasy.org/interactive)进行预测;蛋白质相互作用由SWISS-MODEL(https://swissmodel.expasy.org/interactive)数据库(http://www.string-db.org/)进行分析。
1.2.2组织总RNA的提取和cDNA的合成 采用组织RNA提取试剂盒进行猪肝、肺、肾、脾、胰、背最长肌组织的总RNA提取,调整浓度后用PrimeScript RT Master Mix反转录试剂盒,按照说明书步骤进行第一链cDNA的合成,最后将溶解于超纯水中cDNA样品置于-20℃冰箱保存备用。
1.2.3引物设计与组织表达分析 根据NCBI上猪ABCG8基因的预测序列(登录号:XM021087570)和内参基因猪GADPH序列(登录号:AF017079),利用Primer Premier 6.0 软件设计qRT-PCR引物,引物具体信息见表2。
荧光定量PCR反应体系20 μL:10 μL SYBR Green Master Mix(2×),上下游引物(10 μmol·L-1)各0.8 μL,4 μL cDNA模板,4.4 μL ddH2O。反应条件:95℃预变性2 min、95℃变性15 s、60℃退火30 s、72℃延伸30 s,40个循环,每个样品3个重复。每个组织设置3个重复。运用2-ΔΔCt方法分析qRT-PCR数据,使用Excel进行显著性检验统计分析。P<0.05和P<0.01分别被认为差异显著和极显著。
2 结果与分析
2.1 ABCG8理化性质分析
根据ProtParam分析得出,猪ABCG8共编码730个氨基酸,分子式为C3638H5712N982O1027S35,分子量为80 761.43 kD,理论等电点(pI)值为8.73,为不稳定蛋白(不稳定系数为46.26)。所含氨基酸种类较多,含量较高的有亮氨酸(12.6%)、甘氨酸(8.2%)、丝氨酸(7.9%)、丙氨酸(7.7%)、精氨酸(5.9%)和异亮氨酸(5.9%)等,色氨酸(1.1%)含量较低。带负电荷残基总数谷氨酸(Glu)+天冬氨酸(Asp)为57个,正电荷残基总数赖氨酸(Lys)+精氨酸(Arg)为65个。ProtScale亲疏水性分析结果见图1,ABCG8第535位缬氨酸(Met)疏水性最强(3.011),第330位精氨酸亲水性最强(-2.678),疏水性总平均值(GRAVY)为0.071,属于疏水蛋白。

图1 猪ABCG8的亲疏水性分析Fig.1 Hydrophobicity analysis of ABCG8 in pig
2.2 ABCG8磷酸化位点分析
利用NetPhos 3.1对ABCG8进行在线分析,结果表明该蛋白存在109个潜在的N-磷酸化位点,包括73个丝氨酸(Serine)、26个苏氨酸(Threonine)和10个酪氨酸(Tyrosine)(图2)。YinOYang 1.2预测结果显示该蛋白含有6个O-糖基化位点(图3)。
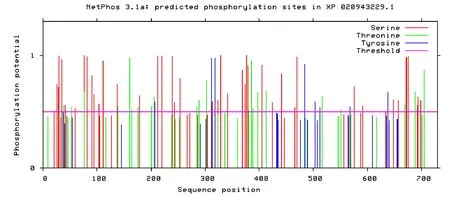
图2 ABCG8的N-磷酸化位点预测Fig.2 N-phosphorylation site prediction of ABCG8
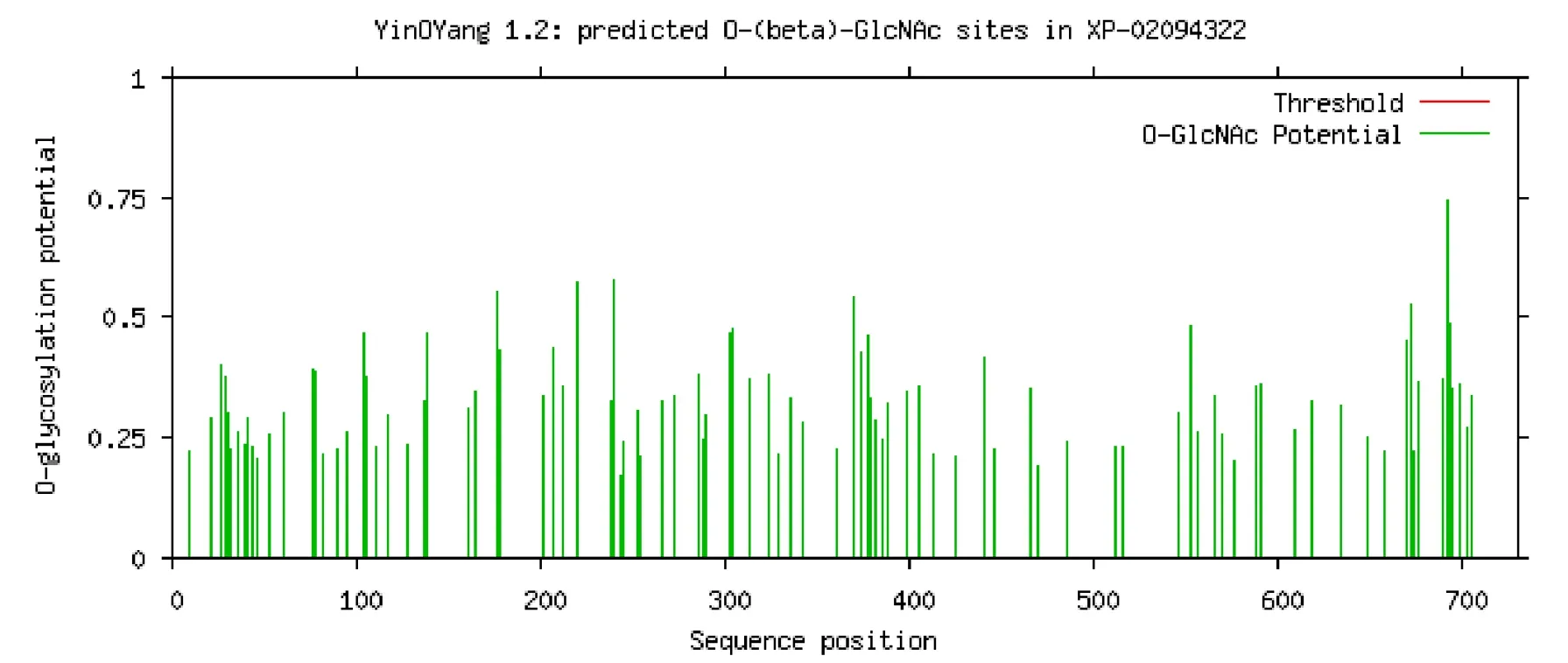
图3 ABCG8的O-磷酸化位点预测Fig.3 O-phosphorylation site prediction of ABCG8
2.3 ABCG8糖基化位点及信号肽分析
NetNGlyc1.0分析显示,ABCG8在88、158和616位上存在3个N-糖基化位点,其中158位的糖基化可能性极高(图4)。但SignalP-5.0信号肽分析结果显示,ABCG8分泌信号肽概率极低,为0.001(图5),说明ABCG8不存在信号肽序列,因此即使它们含有潜在的糖基化基序,在动物体内大概率并不会被糖基化。
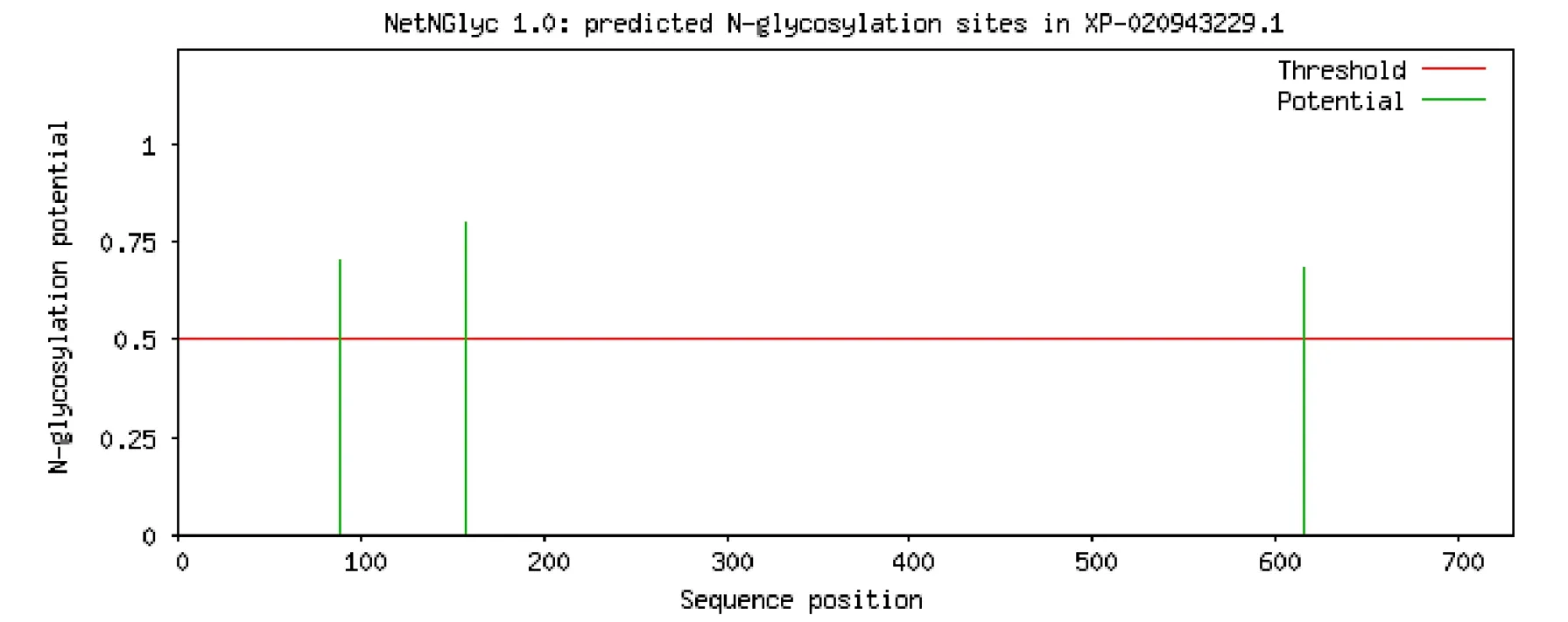
图4 ABCG8的N-糖基化位点预测Fig.4 N-glycosylation site prediction of ABCG8
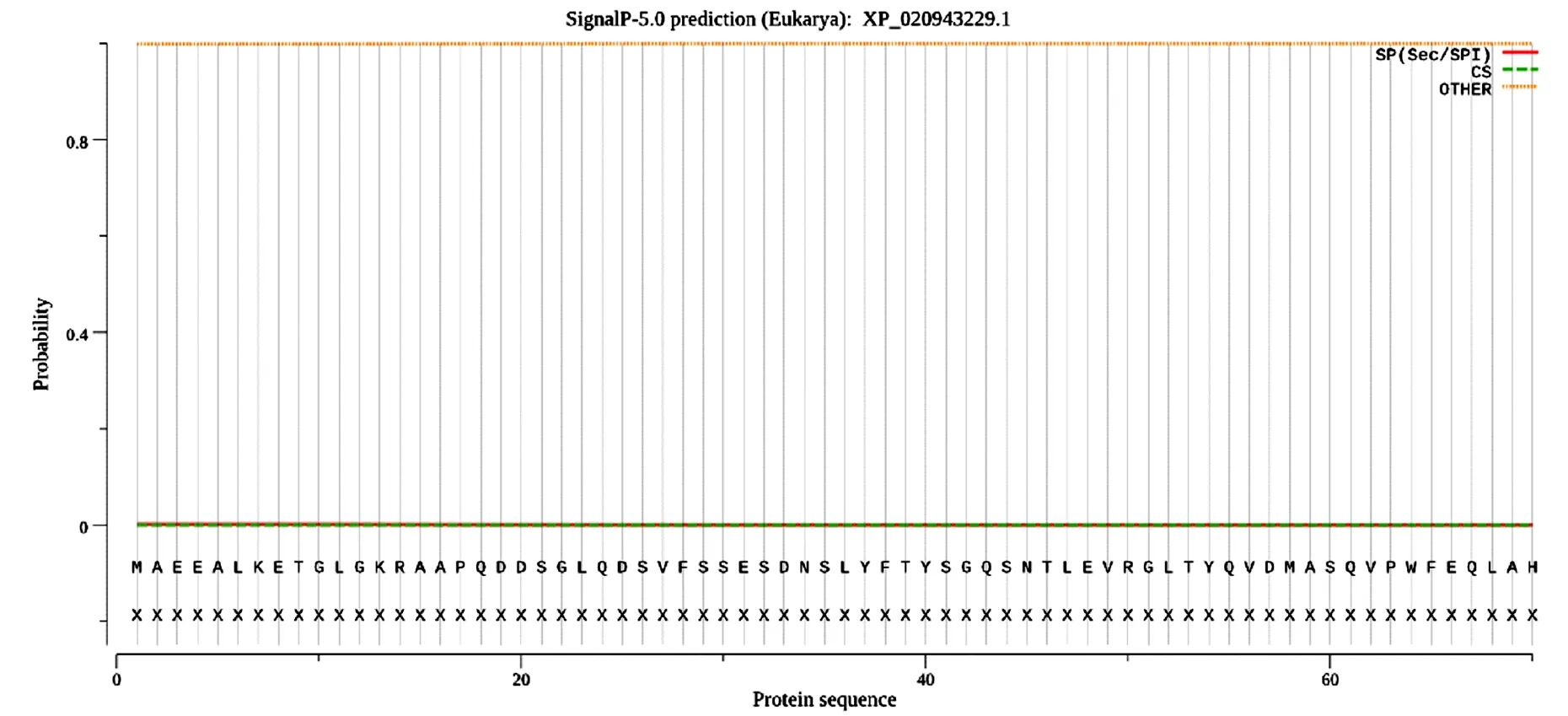
图5 ABCG8的信号肽位点预测Fig.5 Site prediction of the signal peptide of ABCG8
2.4 ABCG8的亚细胞定位及跨膜结构域分析
利用PSORT II亚细胞定位结果显示,ABCG8主要定位于细胞膜(43.50%)和内质网(26.10%),在细胞质中分布极少(4.30%),因此推测其为膜蛋白。使用TMHMM 2.0预测跨膜结构域,发现ABCG8存在6个显著的跨膜结构域(图6),是一个多次跨膜蛋白。
2.5 ABCG8的高级结构及蛋白互作分析
SOPMA软件分析ABCG8二级结构,分析显示α-螺旋、βv转角、延伸链和无规卷曲分别占43.01%、6.16%、14.52%、36.30%(图7)。SWISS-MODEL在线进行三级结构建模显示结果和二级结构预测一致(图8)。用STRING交互式数据库预测,ABCG8可能与ABCG5、NPC1L1、CYP7A1、NR1H3、SCARB1、SREBF2、APOA1、NR1H2、SQLE、NR1H4等10种蛋白存在相互作用关系(图9)。
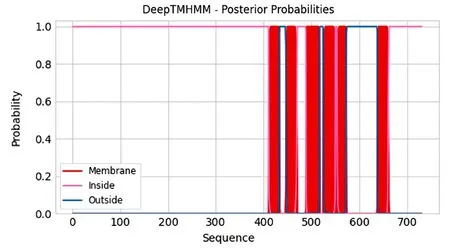
图6 ABCG8的跨膜结构域预测 Fig.6 Prediction of the transmembrane domain ofABCG8

注:蓝色竖线为α-螺旋,紫色竖线为无规卷曲,红色竖线为延伸链图7 ABCG8的二级结构预测Fig.7 Secondary structure prediction of ABCG8

图8 ABCG8的三级结构建模Fig.8 Tertiary structure modeling of ABCG8
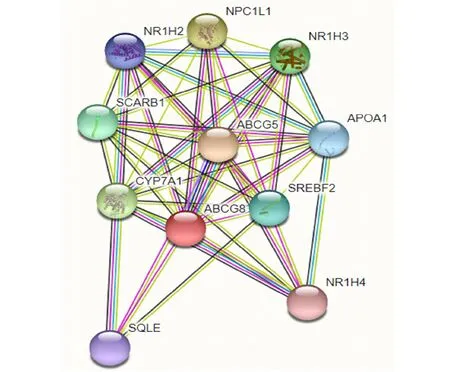
图9 ABCG8的蛋白质互作分析Fig.9 Protein interaction analysis of ABCG8
2.6 ABCG8基因的组织表达谱分析
利用qRT-PCR技术检测ABCG8基因在二花脸猪肝、肺、肾、脾、胰、小肠、背最长肌组织中的表达规律。结果显示,以组织混合样为参照,猪ABCG8基因仅在肝脏中高表达,在肺和肾脏中有痕量表达,而在其他组织中几乎无法检出,肝脏与其他组织表达量间差异极显著。
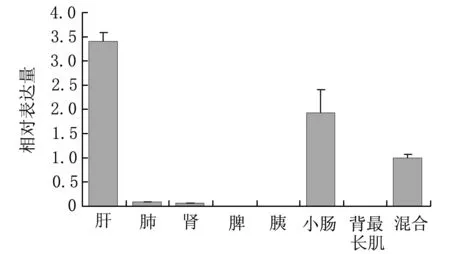
图10 ABCG8基因的组织表达分析Fig.10 Tissue expression analysis of ABCG8 gene
3 讨论与结论
本研究通过生物信息学方法对二花脸猪ABCG8的理化性质、结构域、亚细胞定位、蛋白互作等进行了预测分析。在生物学功能方面,首先ABCG8的疏水性能和6个跨膜结构域提示该蛋白属于一种膜蛋白,而亚细胞定位预测中细胞膜分布比率最高的结果进一步肯定了这一结论。其次,预测显示ABCG8在内质网中也有较高分布,这与人、小鼠相关研究中显示的ABCG8和ABCG5在内质网上形成异源二聚体的生物学过程相符[2]。这一结果进一步与蛋白互作分析结果,即ABCG5显示为与ABCG8互作最为紧密的蛋白相互印证。最后,表达谱分析显示了其肝脏和小肠中的显著表达,可见猪ABCG8参与细胞膜上的胆固醇转出这一基本功能与其在人和小鼠中基本一致[9]。
蛋白互作分析提示了猪ABCG8可能存在的其他生物学功能。如该蛋白与几种转录因子,即固醇调节元件结合转录因子SREBF2和3个核受体超家族的NR1亚家族成员NR1H2、NR1H3和NR1H4均可能产生互作。这3种核受体互为旁系同源蛋白,且与SREBF2都主要在肝脏中起作用。其中NR1H2可直接与DNA的顺式作用元件结合,参与脂肪生成相关基因的转录[10];NR1H3通过与视黄酸受体(RXR)的结合激活其转录因子活性,参与相关基因转录,促进极低密度脂蛋白(VLDL)的生成[11];NR1H4的功能更为广泛,主要作为胆汁酸的受体,反馈调节参与胆汁酸合成和转运的基因的表达[12]。可见猪ABCG8作为甾醇调节基因,位于几种转录因子下游,可能在多种信号的触发下启动转录并发挥作用。此外,NPC1L1一般通过囊泡内吞作用将游离胆固醇吸收到细胞中,在肠道胆固醇的吸收中起关键作用[13],因此其与ABCG8的互作最可能发生在内质网中,可能对ABCG8/ABCG5二聚体的组装产生影响。另外,与ABCG8互作的清道夫受体B1基因SCARB1是高密度脂蛋白胆固醇(HDL)的质膜受体,介导胆固醇与HDL的结合和分离[14];载脂蛋白APOA1,是血浆中HDL的主要蛋白质成分,促进胆固醇从组织运送到肝脏进行排泄,并且是卵磷脂胆固醇酰基转移酶(LCAT)的辅助因子[15],由此可见ABCG8可能与多种蛋白在脂质代谢中相互协作,是脂质代谢的核心蛋白之一,可能在猪的脂类沉积过程中起重要作用。
综上,本研究以生物信息学方法分析了二花脸猪ABCG8的理化性质、高级结构和基本功能,预测了其在猪脂质代谢中的生物学功能和互作通路,为进一步研究ABCG8自身功能以及发掘其在猪生长性能和肉质性能调控中的机理,开发其在育种中的应用潜力研究奠定了基础。
