基于TCGA 数据库分析SLC5A1 在胰腺癌中的表达及潜在促癌作用
2022-09-21陈谱袁黎玥雷雨阳张曈欣袁佳郭辉施秉银强薇
陈谱,袁黎玥,雷雨阳,张曈欣,袁佳,郭辉,施秉银,强薇
胰腺癌以胰腺导管癌(pancreatic ductal adenocarcinoma,PDAC)最为常见,是恶性程度最高的消化系统实体肿瘤,近年来其发病率在全球范围内持续上升。胰腺癌预后极差,5 年生存率仅约6%[1-2]。分析主要原因是:疾病早期缺乏典型症状,确诊时往往已丧失根治性手术的机会;同时,其具有高侵袭转移特性,易于复发和转移;对现有化疗药物产生耐药,缺乏有效的化疗及靶向药物。因此,寻找胰腺癌转移之前的诊断方法以及胰腺癌治疗的有效靶点尤为重要。
葡萄糖是哺乳动物细胞的基本能量来源。截至目前,哺乳动物中葡萄糖转运体(glucose transporter,GLUT)和钠-葡萄糖转运体(sodium-glucose cotransporter,SGLT)2 个家族的葡萄糖转运体已被鉴定[3-4]。人类GLUT 家族在所有的组织中均有表达,以顺浓度梯度(易化扩散)的形式转运葡萄糖。而SGLTs 表达于人体代谢活跃的细胞,借助细胞膜两侧的钠离子浓度梯度实现葡萄糖的逆浓度梯度转运。SGLT 家族成员研究最多的是溶质载体家族5-成员1(solute carrier family 5-member 1,SLC5A1)和钠-葡萄糖协同转运蛋 白2(sodium - dependent glucose transporters 2,SGLT2)。SGLT2 由溶质载体家族5-成员2(solute carrier family 5-member 2,SLC5A2)基因编码,主要分布于肾皮质,是肾脏葡萄糖重吸收的关键分子[5]。SGLT1 由SLC5A1 基因编码,在小肠和肾近端小管细胞负责葡萄糖摄取。肿瘤细胞需要大量的葡萄糖来维持其增殖,代谢重编程已被认为是肿瘤的特征之一[6]。而SLC5A1 和SLC5A2 的高表达在结肠/结直肠、肺、卵巢、头部、颈部和口腔鳞状上皮癌中已有相关报道[4]。靶向代谢治疗癌症被认为极具前景。葡萄糖摄取增高也是胰腺癌代谢重编程的重要环节。新近研究发现,SLC5A2 在胰腺癌中表达亦增高,而其抑制剂可抑制小鼠胰腺癌移植瘤生长[7]。本课题组的另一篇文章已对SLC5A2 进行了分析研究。本研究通过对癌症基因组图谱(the cancer genome atlas,TCGA)数据库中胰腺癌患者的数据与临床病理资料进行分析,明确SLC5A1 在胰腺癌中的表达情况,探讨其异常表达与临床病理及肿瘤发生、发展的相关性。
1 资料与方法
1.1 数据来源 胰腺癌的RNA 测序数据是从TCGA 数据库(https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)中获取,正常胰腺组织的RNA 测序数据是从TCGA 数据库及基因组织表达(genotype-tissue expression,GTEx)数据库中共同获取的。
1.2 基因共表达、信号通路富集及数据分析cBioPortal(http://www.cbioportal.org/)是一个开放获取资源,可进行多维癌症基因组学交互分析,LinkedOmics(http://www.linkedomics.orglogin.php)是一个包含32 种TCGA 癌症多组学数据的开放资源网站。利用cBioPortal 和LinkedOmics 数据库进行胰腺癌中SLC5A1 共表达基因的分析。利用可视化注释和集成探索在线数据库DAVID(https://david.ncifcrf.gov/)及KEGG(https://www.kegg.jp/)进行功能注释和通路富集分析。通过基因表达谱交互分析在线数据库GEPIA(http://gepia.cancer-pku.cn/index.html)获取TCGA 及GTEx 数据库中的RNA 测序数据,并比较SLC5A1 在胰腺癌(179 例)与正常胰腺组织(171 例)中mRNA 的表达,并分析SLC5A1 mRNA 表达水平与不同临床特征的相关性,如患者的种族、肿瘤的病理分期、淋巴结转移、组织学分型等。胰腺癌根据基因分型可分为4 种类型:(1)鳞状型;(2)胰腺祖细胞型;(3)免疫原性型;(4)异常分化的内分泌外分泌型(aberrantly differentiated endocrine exocrine,ADEX)。本研究对4 种亚型相关基因胰岛素(insulin,INS)、核受体亚家族5-组A-成员2(nuclear receptor subfamily 5-group A-member 2,NR5A2)、蛋白酶-丝氨酸-3(protease-serine-3,PRSS3)、叉头框A3(forkhead box A3,FOXA3)、肝细胞核因子1α(hepatocyte nuclear factor 1-alpha,HNF1A)、叉头框A2(forkhead box A2,FOXA2)、肝细胞核因子1β(hepatocyte nuclear factor1β,HNF1B)、胰十二指肠同源框因子-1(pancreatic and duodenal homeobox 1,PDX1)、肝细胞核因子4-γ(hepatocyte nuclear factor 4-gamma,HNF4G)、肝细胞核因子4-α(hepatocyte nuclear factor 4-alpha,HNF4A)、多毛和增强子断裂1(hairy and enhancer of split 1,HES1)等与SLC5A1 的表达进行相关性分析。
1.3 统计学处理 采用SPSS 17.0 软件(Chicago,IL,USA)进行统计学分析。计量资料采用±s表示,2 组数据间的比较采用独立样本t检验。相关性分析采用Spearman 分析。采用Log rank 检验进行生存分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 SLC5A1 在胰腺癌的表达及其与临床病理特征的相关性 如图1A 所示,对TCGA 数据库中的数据分析发现,在胰腺癌组织中的SLC5A1 mRNA表达高于正常胰腺组织(P<0.05)。SLC5A1 的表达与患者的种族相关(P=0.002),但与年龄、临床病理阶段、病理TNM 分期、组织学分型、淋巴结转移等无相关性。见表1。如图1B 所示,相较于SLC5A1低表达的患者,SLC5A1 高表达的患者总生存时间虽呈现减低趋势,但差异无统计学意义(P=0.075)。而如图1C 所示,SLC5A1 高表达及低表达患者的无病生存时间比较差异无统计学意义(P=0.870)。
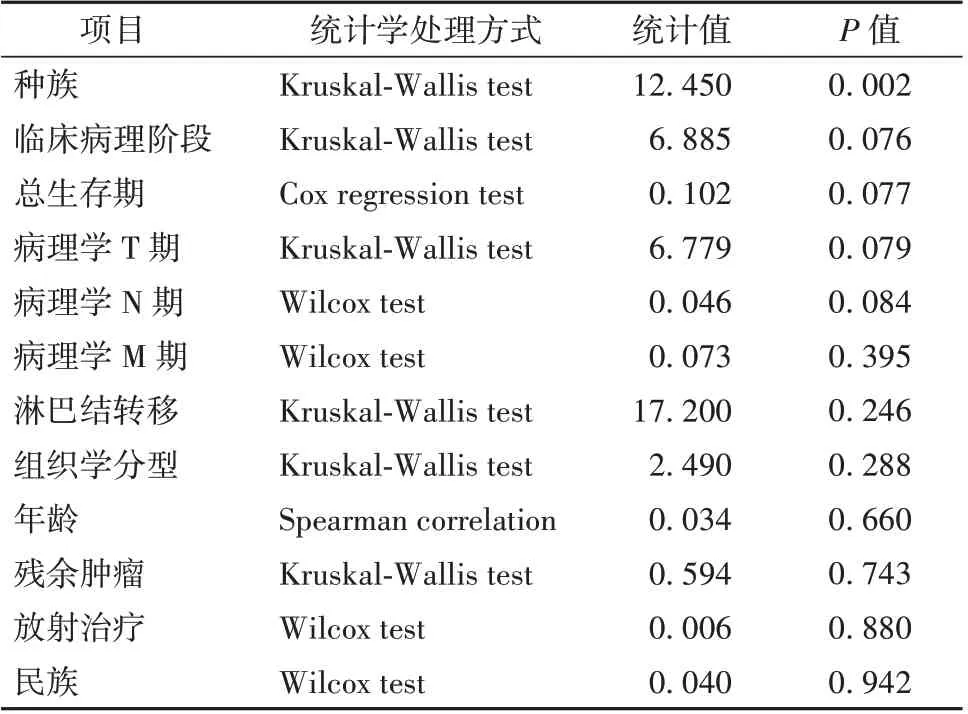
表1 SLC5A1 的表达与胰腺癌临床病理特征的相关性

图1 TCGA 数据库分析在胰腺癌组织中的SLC5A1 mRNA 表达
2.2 与SLC5A1 表达相关的基因 进一步用cBioPortal 分析胰腺癌中与SLC5A1 表达呈正相关以及负相关的基因,见图2A;GO 分析显示大多数与SLC5A1 相关的基因位于细胞膜和细胞核,负责蛋白和离子的结合,参与细胞生物功能和代谢调节,见图2B。KEGG 分析进一步提示,SLC5A1 的高表达与包括葡萄糖摄取、糖酵解信号通路等细胞代谢相关的通路以及细胞色素P450 介导的药物代谢激活呈正相关。SLC5A1 的高表达还与青少年发病的成年型糖尿病的信号通路激活呈正相关,见表2。

表2 胰腺癌中与SLC5A1 表达正相关及负相关的信号通路
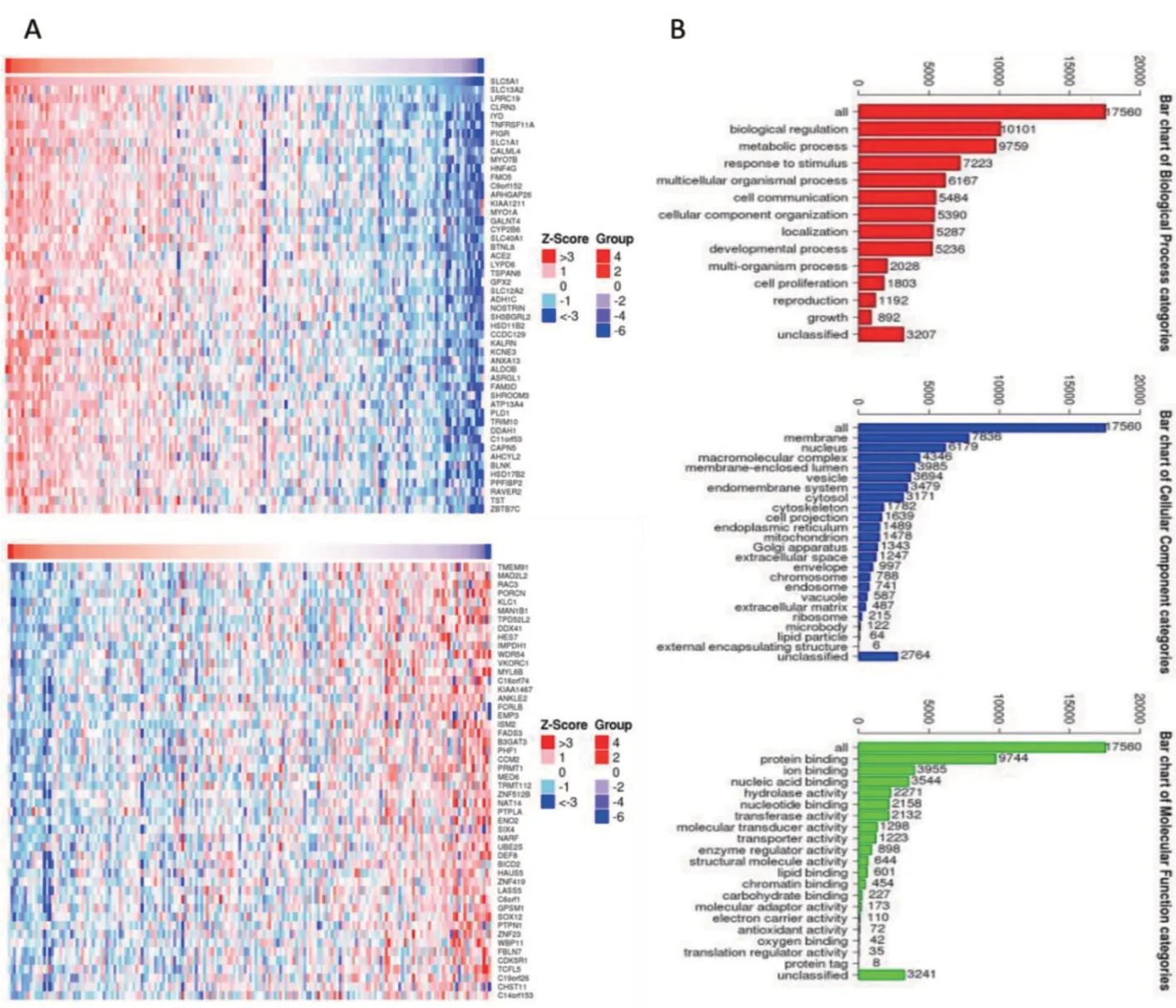
图2 胰腺癌中SLC5A1 相关基因
2.3 SLC5A1 表达与胰腺癌不同亚型基因的相关性分析 本研究对胰腺癌4 种亚型相关基因与SLC5A1 的表达进行相关性分析,结果发现SLC5A1的表达与ADEX 型胰腺癌相关基因中的INS(r=0.174 8,P<0.05)、NR5A2(r=0.331 7,P<0.001)、PRSS3(r=0.207 7,P<0.05)表达呈正相关。见图3。SLC5A1 表达与胰腺祖型胰腺癌中糖代谢关键基因FOXA3(r=0.294 4,P<0.001)、HNF1A(r=0.234 0,P<0.05)、FOXA2(r=0.193 5,P<0.05)、HNF1B(r=0.545 4,P<0.001)、PDX1(r=0.370 1,P<0.001)、HNF4G(r=0.628 3,P<0.001)、HNF4A(r=0.473 2,P<0.001)、HES1(r=0.300 1,P<0.001)表达呈正相关。见图4。与鳞状型、免疫原性型无明显相关性。

图3 SLC5A1 表达与ADEX 型胰腺癌相关性分析
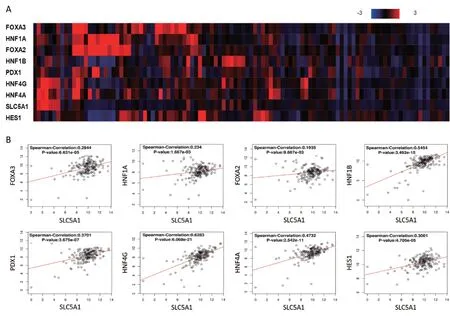
图4 SLC5A1 表达与胰腺祖细胞亚型胰腺癌相关性分析
3 讨论
葡萄糖摄取增高是胰腺癌代谢重编程的重要特征之一,由介导葡萄糖顺梯度异化扩散的GLUT家族和介导葡萄糖逆浓度梯度主动摄取的SGLT 家族介导。SGLT1 是由SLC5A1 编码的,本研究分析TCGA 中的数据发现,SLC5A1 在胰腺癌组织中的表达显著高于正常胰腺组织,遗憾的是本研究未能有临床样本进行进一步的组织学验证,但这一结果与其他研究结果一致[8-9],均提示其可能作为潜在治疗靶点,有待后续进一步研究。
本研究进行GO 分析发现,大多数与SLC5A1相关的基因位于细胞膜和细胞核,负责蛋白和离子的结合,参与细胞生物功能、代谢及应激反应调节。利用KEGG 分析发现,SLC5A1 高表达除与葡萄糖摄取信号通路呈正相关,也与糖酵解信号通路正相关。糖酵解改变被认为是胰腺癌的主要代谢改变。许多糖酵解酶与PDAC 预后不良有关,而通过遗传学途径或用药抑制糖酵解关键因子如己糖激酶2(hexokinaseⅡ,HK2)、磷酸果糖激酶1(phosphofructokinase-1,PFK1)和乳酸脱氢酶A(lactate dehydrogenase A,LDHA)等已被证明能抑制胰腺癌恶性程度。最近,糖酵解增强还被发现与胰腺癌对吉西他滨丧失敏感性有关[10]。此外,本研究还发现SLC5A1 高表达与胰腺分泌、青少年的成年型糖尿病发病的信号通路激活呈正相关。2 型糖尿病患者并发肿瘤的风险增加,其中胰腺癌的风险增加了1.5~2.0 倍[11],合并糖尿病的胰腺癌患者的死亡率显著高于无糖尿病的患者[1]。此外,患有糖尿病的胰腺癌患者的肿瘤常较大,中位生存期短[13]。高胰岛素血症和高糖已被证明能促进胰腺癌的增殖、上皮-间充质转换及转移潜能[5]。SLC5A1 表达与葡萄糖摄取、糖酵解等信号通路的正相关提示其所编码的SGLT1 可能参与胰腺癌发生、进展的机制。通过对SGLT1 的抑制有望降低肿瘤对葡萄糖的吸收,进而抑制胰腺癌的代谢、生长,具有临床前景。
胰腺癌是胰源性糖尿病的重要病因,一项对PDAC 患者的对照研究发现,高血糖出现可能早于PDAC 诊断,提示新发糖尿病可作为胰腺癌的早期预警指标[11]。同时,靶向高血糖也可能有利于胰腺癌防治,经典降糖药物二甲双胍已被证明与PDAC合并糖尿病患者生存延长有关,而现今SGLT2 抑制剂及部分SGLT1 及SGLT2 双抑制剂被作为降糖药物广泛应用于临床[14]。此类药物对糖尿病患者心衰及慢性肾脏病的改善作用确切,具有减重、低血糖风险低等优势[11],被美国、欧洲及我国等国家的2 型糖尿病指南推荐[15-17]。与慢性胰腺炎导致的胰源性糖尿病相比,胰腺癌相关胰源性糖尿病的胰岛素水平相对较高,且外周胰岛素抵抗更为显著[18]。如SGLT1 及SGLT2 双抑制剂对胰腺癌有抑制作用,那么在胰腺癌所致胰源性糖尿病患者中应用此类药物有望达到降糖及抗肿瘤的双重效果。
精准治疗是肿瘤治疗的重要发展趋势。PDAC 具有高度异质性,最近的大规模转录分析将其划分为不同亚型,每种亚型表现为不同临床特征及代谢特征[11]。本研究分析发现,SLC5A1 的表达与胰腺祖细胞型和ADEX 型胰腺癌的关系更为密切,在胰腺祖细胞型胰腺癌中SLC5A1 的表达与FOXA3、HNF1A、FOXA2、HNF1B、PDX1、HNF4G、HNF4A 及HES1 表达均呈正相关,其大多与肝脏及胰岛β 细胞的调节相关;同时,SLC5A1 的表达与ADEX 型胰腺癌相关基因中的INS、NR5A2、PRSS3 表达呈正相关。NR5A2 调控炎症基因的表达,增加胰腺癌的风险[19];PRSS3 在胰腺癌等消化道肿瘤中高表达,促进人胰腺癌肿瘤的生长与转移,认为其可能在肿瘤的进展过程中参与了肿瘤的侵袭与转移[20],同时,有研究表明在结直肠癌患者中PRSS表达水平与癌细胞对西妥昔单抗的敏感性呈显著负相关[20],提示在上述亚型胰腺癌中抑制SLC5A1 可能达到更好的效果,这一发现需要后续进一步的研究以探讨其作用的靶点。
综上所述,本研究基于TCGA 胰腺癌数据分析发现SLC5A1 在胰腺癌中高表达,其高表达与葡萄糖摄取、糖酵解、胰腺分泌的基因信号通路呈正相关;SLC5A1 高表达与胰腺祖细胞型及ADEX 胰腺癌型密切相关,有可能成为胰腺癌代谢治疗的新靶点。
