藏羚Y染色体雄性特异区遗传多样性
2022-09-21成若通陈一博孟祥琼陈家瑞魏青
成若通 陈一博 孟祥琼 陈家瑞 魏青
(青海大学生态环境工程学院,西宁 810016)
遗传多样性反映了物种应对环境变化与进化的潜力,遗传多样性越高,对环境变化的适应能力就越强(沈浩和刘登义,2001)。对于经历过人类猎杀导致种群危机的野生物种,随着短时间内大量个体的消亡,很多潜在的优良基因单倍型也会丧失,在后续种群数量恢复过程中,这些单倍型并不会随着种群个体数量的增加而迅速恢复,即遗传多样性的恢复明显滞后于种群数量的恢复(Frankhamet al.,2002)。张志和(2006)研究发现华南虎(Panthera tigris amoyensis)虽仍维持较高的遗传多样性,但很多稀有单倍型仅存于一个或两个个体,极易因携带者死亡而丢失,其遗传多样性难以维持;朱鹮(Nipponia nippon)作为濒危物种种群恢复的典型案例,1982年被发现时仅有7只,现在虽已恢复至7 000 多只,但由于种群奠基者数量太少,导致现有朱鹮种群近亲繁殖系数高、遗传多样性低(Zhanget al.,2004)。因此,种群遗传多样性监测是物种保护的重要内容之一。
藏羚(Pantholops hodgsonii)是青藏高原动物区系的典型代表,主要分布在以羌塘为中心的高原地区。20 世纪中期疯狂的盗猎行为使数十万只藏羚丧生,其种群数量在2003年降到了最低的5万只左右(Leclercet al.,2015),现已恢复至约30 万只(陈建伟和刘璐,2021)。近年来对藏羚线粒体基因和常染色体基因的STR 遗传标记分析表明藏羚种群仍然具有丰富的遗传多样性(Zhanget al.,2013;Duet al.,2016)。然而,对藏羚性染色体的基因多样性研究目前仍处于空白。已有的研究表明,藏羚种群性别比例明显偏雌(夏霖和杨奇森,2015),即雄性藏羚在其生活史中面临更高的死亡风险,且藏羚的婚配制度为一夫多妻(Blanchardet al.,2004),Y 染色体遗传多样性特征对于全面掌握藏羚种群遗传特征具有重要意义。Y染色体作为雄性特有的染色体,具有突变率低、遵循父系遗传、不易受重组影响等特点(Clark,2014;Cortezet al.,2014),基于Y 染色体的单核苷酸多态性(Y-SNP)是研究家养动物常用的遗传标记,已被广泛应用于人(Keet al.,2001)、普通牛(Götherströmet al.,2005)、牦牛(马志杰,2019)、绵羊(王玉涛等,2011)等物种的遗传多样性、父系起源、分化和分类等相关研究。然而,针对野生动物Y-SNPs 的相关研究还相对较少。
为探索藏羚的Y染色体遗传多样性,更加全面掌握藏羚种群遗传特征,本研究基于已发表的牛科动物Y-SNP位点信息,筛选出藏羚特异性Y-SNP位点并进行测序,利用多态性位点对藏羚Y染色体遗传多样性进行分析,为深入了解藏羚种群遗传多样性水平、群体遗传结构及父系起源等提供理论支撑,同时为藏羚种群的保护提供科学参考。
1 研究方法
1.1 样品采集
2014 年和2021 年在三江源国家公园可可西里卓乃湖区域(北纬35°27′~ 35°29′,东经91°50′~92°03′)共收集意外死亡藏羚肌肉和新生幼仔胎盘组织样品77 份;2021 年在新疆阿尔金山国家级自然保护区兔子湖区域(北纬36°38′~ 36°42′,东经87°13′~87°15′)共收集肌肉组织和新生幼仔胎盘组织样品8份。野外收集样品后保存于95%乙醇中带回实验室,于冰箱中4℃保存。
1.2 实验方法
藏羚基因组DNA 的提取。参照Strauss (1999)的氯仿异戊醇(24∶1) 法抽提制备藏羚基因组DNA,NanoDrop 核酸检测仪测定其浓度和纯度,无菌水稀释至80 ng/μL备用。
藏羚样品性别的鉴定。参考牛科动物性别鉴定通用引物SE47/SE48 (Weikardet al.,2006),Y1/Y1 (Raoet al.,1995) 对样品进行性别鉴定,引物由上海生工生物工程有限公司合成。雄性样品用于后期Y染色体遗传多样性分析。
藏羚Y-SNP 位点的筛选和测序。查阅相关文献并整理已在其他牛科动物Y 染色体上验证具有多态性的SNP 位点,选择SRY15、SRY17、ZFY10、ZFY11、AMELY3、DDX3Y、UTY1、SRYOY1、DBY(Meadowset al.,2004)、UTY19(Götherströmet al.,2005)、SRY(Meadowset al.,2006)、ZFY1、ZFY2、ZFY3、SRY4、SRY5、SRY6(Nijmanet al.,2008)、ZFY9、ZFY10-2、DDX3Y1、DDX3Y7(Ginjaet al.,2009)、USP9Y、ZFY(Bonfiglioet al.,2012)、SRY18(蒋利,2013)、OFD1Y1、OFD1Y9、SRY3、AMELY1、AMELY2、AMELY4(Liet al.,2014)等30个牛科动物多态性Y-SNP位点,由上海生物工程股份有限公司合成引物后,筛选出藏羚Y染色体可用引物。筛选流程为:利用雄性藏羚基因组DNA 对所有引物进行温度梯度PCR 确定最佳扩增温度;以雌性样品DNA 为阴性对照,ddH2O为空白对照,5个雄性藏羚样品建立混池DNA,对具有单一扩增条带的引物进行二次筛选;取雄性特异性扩增产物送至测序公司进行基因测序,筛选出多态性引物后再对所有雄性样品进行扩增、测序。测序由金唯智生物科技有限公司完成。PCR扩增体系(25 μL)为:gDNA 80 ng,上下游引物各1 μL,2 ×Taq Mix 12.5 μL,ddH2O 补足。PCR 扩增程序:94℃预变性5 min,94℃变性30 s,X℃退火30 s(X为退火温度),72℃延伸1 min,共30个循环。
数据统计分析。测序结果基于SeqMan 软件进行人工核对,MEGA11 软件(Tamuraet al.,2011)对序列结果进行比对分析,DnaSP V6 分析单倍型及多态性信息(Libradoet al.,2009),利用Arlequin 3.1 计算藏羚青海种群和新疆种群之间基于Y 染色体的遗传分化指数(FST)(Excoffieret al.,2005)。
2 结果
2.1 藏羚Y染色体特异性引物筛选
经筛选,30 对牛科动物多态性Y-SNP 位点引物中,有16 对引物在藏羚中具有扩增条带,其中11 对为藏羚Y 染色体特异性引物(表1),部分引物扩增条带电泳检测结果见图1。

表1 藏羚Y染色体特异性引物信息表Table 1 Tibetan antelope Y chromosome specific primer information table

图1 藏羚SRYOY1 位点PCR 扩增条带.M:Marker;♂:雄性样品;♀:雌性样品;CK:空白对照Fig.1 SRYOY1 locus PCR amplification bands of Tibetan antelope.M:Marker;♂:Male samples;♀:Female sample;CK:Control check
2.2 藏羚Y染色体遗传多样性分析
使用藏羚雄性特异性引物对混池DNA 进行PCR 扩增,将扩增产物送至测序公司测序,结果显示:SRY6、SRYOY1、SRY4、AMELY4、ZFY2、AMELY3、DDX3Y7、DDX3Y、USP9Y、UTY19、ZFY3等11 对引物获得的有效测序基因长度分别为452 bp、551 bp、791 bp、607 bp、546 bp、801 bp、262 bp、143 bp、423 bp、237 bp、587 bp;11个基因片段中AMELY3和SRYOY1两个位点具有多态性。AMELY3在723 碱 基 处 存 在C >T 转 换 突 变;SRYOY1在167 碱基处存在G >A 转换突变。使用AMELY3及SRYOY1两对引物对藏羚雄性样品进行扩增测序,AMELY3测序结果包含2 个单倍型,其中g.723 T 仅在一个样品中出现,为稀有单倍型,基于AMELY3位点计算得到藏羚Y染色体单倍型多样性为0.048±0.045,核苷酸多态性为0.00006±0.00005;SRYOY1共得到51个有效样品测序结果,包含2个单倍型,其中单倍型H1(g.167 G)占总样品的68.6%,为优势单倍型,单倍型H2(g.167 A)占总样品的31.4%;基于SRYOY1位点计算得到藏羚Y 染色体单倍型多样性(Hd) 为0.439 ± 0.050,核苷酸多样性(Pi)为0.0008±0.0004(图2)。
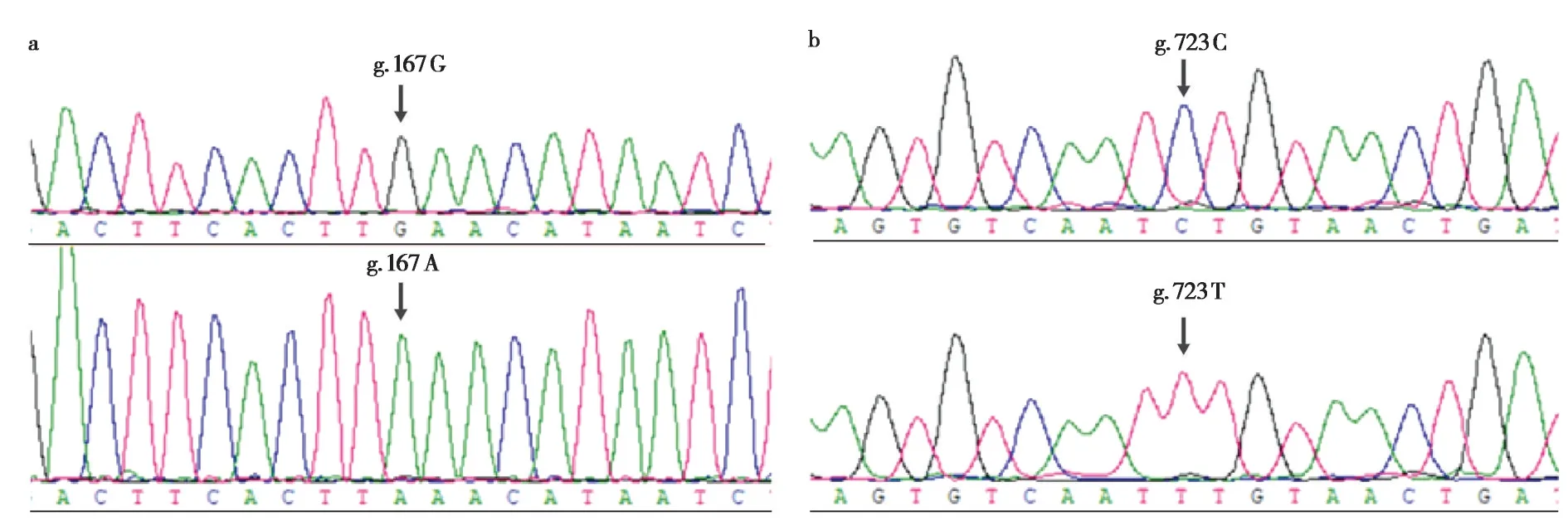
图2 藏羚多态性位点测序峰图.a:SRYOY1(g.167 G >A);b:AMELY3(g.723 C >T)Fig.2 Sequencing peak map of polymorphic sites in Tibetan antelope.a:SRYOY1(g.167 G >A);b:AMELY3(g.723 C >T)
2.3 藏羚父系起源分析
基于SRYOY1测序结果,采用最大似然法构建雄性藏羚的系统发育树(图3),显示所有雄性样品聚为两个分支,推断藏羚种群可能具有两个父系起源。基于SRYOY1对雄性藏羚青海种群和新疆种群Y 染色体种群遗传分化指数进行计算得出,FST为0.6846 ± 0.0389,即两个地区藏羚雄性种群之间已经产生了明显的种群分化。

图3 基于SRYOY1 位点的最大似然法构建雄性藏羚系统发育树.QH:青海样品;XJ:新疆样品Fig.3 Maximum Likelihood tree of male Tibetan antelopes based on the sequencing of the SRYOY1 loci.QH: Qinghai samples;XJ: Xinjiang sample
3 讨论
研究表明,Y染色体遗传多样性显著低于常染色体和线粒体基因(Hellborget al.,2004)。本研究从30对牛科动物Y染色体多态性引物中筛选出11对藏羚雄性特异性引物,共获得AMELY3和SRYOY1两个多态性位点。藏羚Y 染色体核苷酸多样性高于绵羊(Pi=0.00009 ± 0.00005) (Meadowset al.,2004)、建昌马(Pi=0.00038 ± 0.00008) (刘敏,2021)、中国马(Pi=0.000 4) (张钦,2015)、梅花鹿(Pi=0.000 36) (周永娜等,2018) 等哺乳动物。藏羚Y染色体单倍型多样性低于建昌马(Hd=0.767±0.090)(刘敏,2021)、马鹿(Hd=0.877)(房瑞新,2021)、梅花鹿(Hd=0.696 80)(周永娜等,2018)、家牦牛(Hd=0.6946 ± 0.0143) (马志杰,2019)、野生马鹿(Hd=0.865) (房瑞新,2021)、野牦牛(Hd=0.8214 ± 0.1007) (马志杰,2019) 等哺乳动物。提示藏羚Y 染色体核苷酸多样性较高,单倍型多样性偏低。基于SRYOY1位点,将来自青海和新疆的51份样品分为H1(g.167 G)和H2(g.167 A)两种单倍型,且两种单倍型在青海和新疆两地的样品中均有出现,系统发育树提示现有的藏羚种群可能具有2个父系起源。不同于利用线粒体和常染色体STR 遗传标记显示的藏羚青海种群和新疆种群间极弱的遗传分化(Duet al.,2010),青海藏羚雄性种群与新疆藏羚雄性种群间已经产生了显著的遗传分化。青海和新疆藏羚种群之间基于不同遗传标记分析得出的遗传分化程度差异,与雌性藏羚和雄性藏羚不同的迁徙行为有很大的关系。三江源国家公园可可西里园区的太阳湖—卓乃湖一带是青海、新疆及西藏雌性藏羚种群共同的重要产羔地(刘务林,2008),由此在产羔期带来的混群效应及基因流(Zhanget al.,2013)在一定程度上弱化了不同地理种群间的遗传差异,再加上线粒体基因为母系遗传,因此在基于常染色体和线粒体遗传标记分析藏羚不同地理种群间的遗传分化时,其分化程度较弱;而雄性藏羚不参与或者不完全参与雌性藏羚的产羔迁徙行为(Schalleret al.,1998,2006),地理隔离效应显著,使得两个地区基于Y 染色体遗传标记的雄性藏羚种群遗传分化显著。
基于以上认识,本研究在藏羚中发现2 个YSNP 位点具有多态性,分别为AMELY3(g.723 C >T)和SRYOY1(g.167 G >A),最大似然树提示藏羚可能有2个父系起源。Y染色体遗传多样性分析显示藏羚具有较低的Y 染色体单倍型多样性(Hd=0.439 ± 0.050) 和较高的Y 染色体核苷酸多样性(Pi=0.0008±0.0004),青海藏羚雄性种群与新疆藏羚雄性种群间已经产生了显著的遗传分化,提示藏羚的保护依然任重道远,跨区域的物种保护势在必行,且从另一个层面提示我们今后对野生动物种群遗传多样性的评价中需提高对性染色体的关注。
