高原低氧胁迫对小鼠肝脏功能及基因表达的影响
2022-09-21陶海萍李双贾功雪张璐瑶方有贵陈永伟杨其恩
陶海萍 李双 贾功雪 张璐瑶 方有贵 陈永伟 杨其恩*
(1 中国科学院西北高原生物研究所,中国科学院高原生物适应与进化重点实验室,西宁810001)(2 中国科学院大学,北京100049)(3 中国农业大学农业生物学院生物技术国家重点实验室,北京100193)(4 中国科学院西北高原生物研究所,青海省动物基因组学重点实验室,西宁810001)(5 玛多县农牧综合服务中心,果洛813599)(6 青海省畜牧总站,西宁 810008)
低氧是以青藏高原为代表的高海拔低气压环境的显著特征之一。短期的低氧应激可在细胞和器官水平激活多种复杂途径,以促进机体氧稳态的恢复(Bogdanovaet al.,2016;Patelet al.,2018),而长期的低氧胁迫则对人和非习服动物的心肺系统(Jinet al.,2009;冯恩志等,2014)、消化系统(杜继曾和张家兴,2004)、免疫系统(程守科等,2001)和生殖系统(廖卫公等,2006)等产生显著持续的负影响,进而引起多种代谢疾病的发生。低氧暴露还会通过代际效应影响小鼠后代胚胎发育、基因表达和精子发生(Taoet al.,2022;Li and Yang,2022)。研究低氧生理对深入了解动物适应进化和低氧引起的病理过程有重要的意义。
肝脏是维持全身稳态、蛋白质合成、糖脂代谢、凝血因子合成和解毒等多种活动的中枢器官(Madrigal-Santillánet al.,2014;Wattet al.,2019),而这些生物代谢过程均需要大量的氧气摄入来发挥正常功能。同时,由于血液供应的特殊性,肝脏内形成的氧分压呈梯度代谢,导致肝脏对缺氧损害极为敏感(荣黎等,2009)。供氧不足可能会直接引起多种肝脏疾病的发生(Nath and Szabo,2012)。缺氧是肝癌发生所有阶段的关键微环境因素,因为缺氧影响肝脏中的所有细胞类型(Yuen and Wong,2020)。由于缺氧使肝细胞损害,导致肝细胞充血、水肿和脂肪变性,高原肝病患者均存在不同程度的肝肿大和肝功能异常,高原地区脂肪肝发病率也高于平原地区(荣黎等,2009)。动物实验表明,低压低氧可引起大鼠、狗的肝脏损伤(Reedet al.,1964;Shinguet al.,1982)。慢性低氧通过引起肝脏血管内皮细胞功能紊乱,引起大鼠发生肝纤维化和非酒精性脂肪肝(Hernández-Bustabadet al.,2022)。肝脏遭受缺氧损伤后主要表现为肝细胞及其线粒体肿胀和死亡等形态学改变以及与代谢功能相关酶的变化(杜继曾和李庆芬,1982)。既往研究认为凋亡相关基因p53、fas、cjun、Bcl-2等参与了缺氧所诱导的肝细胞凋亡,也有研究表明Hif-1α有促凋亡作用,Hif-1α可通过上调促凋亡蛋白P53、BNIP3、Noxa等的表达水平引起细胞凋亡(Piretet al.,2002;Cursioet al.,2008;Yuen and Wong,2020;Xionget al.,2020)。目前低氧引起肝脏损伤机制的研究主要集中于急性或慢性低氧暴露后亲本的肝脏损伤,但由于生物体对高原低氧环境具有适应性,这些损伤是否继续影响子代肝功能,仍然未知。
本研究通过建立高原低氧暴露(海拔3 220 m)小鼠模型,对低氧处理小鼠及其后代肝功能和血液生化等项目进行检测,分析低氧胁迫对小鼠及其子代肝脏功能的影响。同时,通过对低氧小鼠及其子代肝脏进行转录组测序及分析,探究动物肝脏基因表达调控对低氧暴露的应激与适应机制。
1 研究方法
1.1 实验动物
8 周龄健康ICR 小鼠,购自北京维通利华实验动物中心。动物实验经中国科学院西北高原生物研究所动物伦理与福利委员会批准。
1.2 动物分组和处理
经过1周适应性饲养后,将小鼠随机分为常氧对照组和低氧处理组。常氧对照组(常氧第0~5代)饲养于中国农业大学(北纬40°01′44″,东经116°17′04″,海拔51 m),低氧处理组(低氧第0~ 5 代)饲养于中国科学院海北高寒草甸生态系统定位站(北纬37°32′50″,东经101°24′27″,海拔3 220 m)。将雌雄小鼠合笼交配,繁殖子代(第1~5代)饲养至成年(18周龄)。各组均采用标准化饲养设施,环境温度控制在20℃~25℃,湿度50%~60%,光控条件昼、夜各12 h,自由取食饮水。
1.3 样品收集和处理
常氧和低氧第0~ 5 代雄性小鼠饲养至18 周,称重后颈椎脱臼处死,取心、肝和肺称重(精确到0.1 mg)。器官比重=器官重/体重×100;右心指数=右心室重/ (左心室重+室间隔重) (Chenet al.,2019)。使用4%多聚甲醛固定部分肝脏组织,经脱水、透明、石蜡包埋后用于组织形态学分析。使用无抗凝剂采血管收集血液,静置20 min 后以4 000 r/min离心15 min,收集血清并使用自动生化分析仪(Cobas 513/1730-01)检测血液生化指标。
1.4 组织形态学分析
将石蜡组织块切成4 μm 的切片,经二甲苯脱蜡,乙醇梯度复水后,使用HE(南昌雨露实验器材有限公司,YLYLSMJ-001)染色,自来水冲洗,晾干后使用封片剂(中性树胶与二甲苯1∶1 混合)封片,光学显微镜下观察组织形态,每组5个重复。
1.5 葡萄糖和胰岛素耐量试验
为验证肝脏代谢功能的恢复程度,分别对3组小鼠(常氧第0 代、低氧第0 代和低氧第1 代)进行葡萄糖耐量试验(glucose tolerance test,GTT) 和胰岛素耐量试验(insulin tolerance test,ITT) 来观察机体血糖变化的敏感性。3 组雄性小鼠饲养至18 周,断粮12 h 后称重,并依体重注射2 mg/g 的葡萄糖(Sigma-G-6152) 或0.75 IU/g 的胰岛素(Sigma-I2643)试剂。于注射葡萄糖后0 min、15 min、30 min、60 min 和120 min 时,分别由尾静脉取血,使用血糖仪检测血糖浓度。眼球采血,并以4 000 r/min离心15 min 取血清,使用小鼠胰岛素ELISA 试剂盒(江苏酶标生物科技有限公司,MB-3315A)测定血清胰岛素浓度。于注射胰岛素后0 min、30 min、60 min、90 min和120 min时,分别由尾静脉取血,使用血糖仪检测血糖浓度。每个样本技术重复2次。
1.6 肝脏转录组分析
为探究高原低氧暴露对小鼠肝脏基因表达的影响,利用RNA-seq 对3 组小鼠肝脏的基因表达进行分析。每组(常氧第0 代、低氧第0 代和低氧第1 代)各取部分肝脏组织,随后使用PBS 溶液冲洗干净表面血液并加入1 mL TRIzol (ThermoFisher,15596026)试剂,冻存于液氮中。采用酚氯仿法提取总RNA,使用NanoPhotometer® 分光光度计(IMPLEN,CA,USA)、Qubit®3.0 Flurometer (Life Technologies,CA,USA) 和安捷伦2100 RNA Nano 6000 Assay Kit (Agilent Technologies,CA,USA) 对样品进行质检,质检标准为OD260/280 ≥1.8,OD260/230 ≥1.8,25S/18S ≥1.5,RIN 完整性接近10。通过Oligo (dT) 磁珠富集纯化,将得到的mRNA随机打断进行PCR,构建cDNA文库。将文库稀释至1 ng/μL,RT-PCR 对文库的有效浓度进行准确定量(文库有效浓度>10 nmol/L)。将构建的文库送至安诺优达基因科技(北京) 有限公司使用Illumina 平台进行双端测序。原始下机数据经过滤后比对到小鼠参考基因组mm10,使用HTSeq软件统计每个基因的reads 数后使用FPKM 法计算基因表达量。使用DESeq2 软件进行差异表达分析,差异表达基因筛选阈值为|log2(Fold Change)| ≥1 和P<0.05。使用DAVID 软件对差异基因进行GO 和KEGG富集分析。每组3个重复。
1.7 数据分析
采用SPSS 23.0 统计软件对数据进行统计分析。低氧和常氧小鼠体重、右心比重、肺脏比重和肝脏比重均采用独立样本t检验分析,肺脏比重和肝脏比重数据不符合正态分布,因此在t检验前在EXCEL中使用公式“=DEGREES(ASIN(SQRT(原变量)))”对数据进行反正弦转换;血液生化指标、MAPK相关基因mRNA FPKM表达量、血糖和胰岛素浓度均采用单因素方差分析和多重比较对数据进行分析,结果以平均值± 标准差(mean ± SD) 表示,P<0.05具有统计学意义。
本文常氧第0~5代所有数据均无显著性差异,高原低氧胁迫对低氧第1代小鼠肝功能的影响最严重,且从低氧第2 代开始出现恢复,因此结果2.3~ 2.5 中均以常氧第0 代作为对照组,低氧第0代和低氧第1代作为处理组。
2 结果
2.1 高原低氧暴露对小鼠体重及器官比重的影响
低氧第0 代(0.39 ± 0.02vs.0.33 ± 0.01,P<0.05)、第1 代(0.41 ± 0.01vs.0.33 ± 0.01,P<0.01) 和 第2 代(0.45 ± 0.02vs.0.37 ± 0.02,P<0.05)的右心指数均显著高于常氧第0 代。证实了高原低氧暴露后,低氧小鼠模型的有效性(图1A)。高原低氧会导致成年小鼠体重下降,与常氧第0代(41.38 g ± 0.47 g) 和第1 代(41.17 g ± 0.42 g) 相比,低氧第0代体重(39.94 g±0.50 g)和低氧第1代体重(39.56 g ± 0.64 g) 分别显著下降了3.5%和4.0% (P<0.05) (图1B)。另外,低氧胁迫使肺脏比重在第0 代和第1 代显著增加了13.99%(0.72%± 0.03%vs.0.63% ± 0.02%,P<0.05) 和29.80% (0.82% ± 0.80%vs.0.63% ± 0.02%,P<0.05)(图1C)。低氧小鼠体重和肺脏比重从低氧第2 代开始有恢复至常氧小鼠的趋势。与肺脏不同,低氧组的肝脏比重从第0 代至第3 代都显著高于常氧 组10% 以 上 (5.49% ± 0.12%vs.4.94% ±0.16%;5.39% ± 0.12%vs.4.67% ± 0.30%;5.42% ± 0.24%vs.4.72% ± 0.19%;5.26% ±0.22%vs.4.56% ± 0.23%,P<0.05),第4 代和第5代恢复至常氧组(图1D)。

图1 高原低氧环境对小鼠体重及器官比重的影响.右心指数(A)、18周体重(B)、肺脏比重(C)和肝脏比重(D). n=9.*P <0.05,**P <0.01Fig.1 Effects of plateau hypoxic environment on body weight and organ proportion of mice.Right heart index (A),body weight at 18 weeks (B),lung specific gravity(C)and liver specific gravity(D). n=9.*P <0.05,**P <0.01
2.2 高原低氧暴露对小鼠肝脏组织形态的影响
肝脏HE 染色如图2,常氧小鼠(第0~ 5 代)肝细胞围绕中央静脉均匀分布,细胞间界限非常清晰。而经低氧暴露后,低氧第0 代小鼠肝细胞结构开始紊乱,局部肝细胞发生肿胀,中央静脉和肝索间出现大量红细胞浸润(图2 中黄色箭头)。在低氧第1代中,肝脏组织形态变化更为明显,肝细胞界限明显紊乱,出现大量肿胀的肝细胞,肝索间红细胞显著增多,肝小叶内可见脂滴空泡(图2 中绿色三角)。低氧第2 代至第5 代,肝脏组织形态逐渐恢复,但中央静脉和肝索间仍可见红细胞。

图2 高原低氧环境对小鼠肝脏组织形态的影响.常氧和低氧第0~5代肝脏HE染色代表性图.标尺=15 μm.红细胞浸润(黄色箭头),肝小叶内脂滴空泡(绿色三角)Fig.2 Effects of plateau hypoxic environment on liver tissue morphology of mice.Representative images of HE staining of normoxic and hypoxic livers from generation 0 to generation 5.Scale bars represent 15 μm.Red blood cell infiltration(yellow arrow),intralobular lipid vacuoles(green triangle)
2.3 高原低氧暴露对小鼠血液生化指标的影响
低氧第0 代的血清谷丙转氨酶(alanine aminotransferase,ALT)(93.00 U/L±7.55 U/L)和谷草转氨酶(aspartate aminotransferase,AST) (283.67 U/L ±40.38 U/L)浓度均显著高于常氧第0代(46.33 U/L±2.52 U/L;132.67 U/L± 3.51 U/L,P<0.05),在低氧第1代中ALT浓度明显降低(70.00 U/L±8.89 U/L),但AST 浓度提高(385.00 U/L±111.67 U/L),这证实了肝脏细胞损伤的发生(图3A、B)。此外,血清白蛋白、球蛋白、总胆红素和总胆固醇等指标均在低氧第0 代中下降,且分别降低了21.6%、27.3%、63.5%和29.0%,但是在低氧第1 代中出现回升,除血清白蛋白指标外,其他3项同对照组相比降低不显著(图3C~F)。

图3 高原低氧环境对小鼠血液生化指标的影响.谷丙转氨酶(A),谷草转氨酶(B),白蛋白(C),球蛋白(D),总胆红素(E),总胆固醇(F). n=3.不同字母代表各组间有显著性差异(P <0.05)Fig.3 Effects of plateau hypoxic environment on biochemical indexes of mice.Alanine aminotransferase (ALT) (A),aspartate aminotransferase(AST) (B),albumin (C),globulin (D),total bilirubin (E),total cholesterol (F). n=3.Bars with different letters were significantly different (P <0.05)
2.4 高原低氧暴露对小鼠血糖和胰岛素水平的影响
空腹12 h 后,3 组的基础血糖值基本保持一致(4.37 mmol/L ± 0.74 mmol/L,5.58 mmol/L ±0.22 mmol/L,5.6 mmol/L± 1.85 mmol/L) (图4A),表明3组小鼠在饥饿刺激下具备类似的血糖代偿能力。注射葡萄糖后,常氧第0 代小鼠血糖浓度在15 min时增高了428%,在之后2 h内回落至基础血糖值(5.35 mmol/L ± 0.75 mmol/L);注射胰岛素后,常氧第0 代小鼠血糖值在30 min 时降低至1.97 mmol/L± 0.33 mmol/L,在之后的2 h 内未恢复;然而低氧第0 代和低氧第1 代小鼠的血糖浓度在2 h 内均未出现明显波动,说明低氧暴露后小鼠的葡萄糖耐受能力和胰岛素敏感性均大幅减弱。血清ELISA试验结果也证明了上述结论(图4B)。

图4 高原低氧环境对小鼠血糖水平和胰岛素水平的影响.GTT 血糖浓度(A),GTT血清胰岛素水平(B)和ITT血糖浓度(C). n=3.不同字母代表各组间有显著性差异(P <0.05)Fig.4 Effects of plateau hypoxic environment on blood sugar and insulin levels of mice.GTT blood glucose concentration(A),GTT serum insulin level(B),ITT blood glucose concentration(C). n=3.Bars with different letters were significantly different(P <0.05)
2.5 高原低氧暴露小鼠肝脏转录组学分析
小鼠常氧第0 代、低氧第0 代和低氧第1 代两两比对差异表达基因数量,分别为:低氧第0 代与常氧第0 代相比较,230 个基因下调,922 个基因上调(图5A、D);低氧第1 代与常氧第0 代相比较,246 个基因下调,769 个基因上调(图5B、E);低氧第1 代与低氧第0 代相比较,68 个基因下调,121 个基因上调(图5C、F) (P<0.05)。通过绘制维恩图统计低氧第0 代和低氧第1 代独有的差异基因,分别是660个和491个(图6A)。通过差异表达基因KEGG 通路分析,发现低氧环境暴露后,对肝脏的影响主要集中在MAPK、细胞因子受体相互作用、脂肪酸代谢、TNF 信号通路、抗原呈递和胰岛素抵抗等信号通路(图6B~D)。

图5 低氧和常氧小鼠肝脏差异表达基因分析.低氧第0代vs. 常氧第0代,低氧第1代vs. 常氧第0代和低氧第1代vs. 低氧第0代差异表达基因数量(A~C)和热图(D~E)Fig.5 The differentially expressed gene analysis of mice liver in Hypoxic group and Normoxic group.Numbers of differentially expressed gene(AC)and Heatmap(D-E)of Hypoxic generation 0 vs. Normoxic generation 0,Hypoxic generation 1 vs. Normoxic generation 0 and Hypoxic generation 1 vs. Hypoxic generation 0
另外,低氧第0 代和低氧第1 代共有的差异表达基因共有459 个(图6A),这些基因主要与凋亡、脂质代谢、蛋白磷酸化的信号转导和MAPK 级联调控等生物学过程密切相关(图7A)。对低氧第1 代特有的46 个差异表达基因进行GO 分析,这些差异基因主要与内质网、蛋白质转运的调控、脂质代谢、白细胞激活等生物学过程相关(图7B)。低氧暴露导致MAPK 信号通路激活,随低氧暴露时间延长,与MAPK 信号通路相关的基因:Madd、Map4k2、Tab1、Fgfr1、Mapk12、Ccl25和Map2k6显著上调(P<0.05)(图7C)。
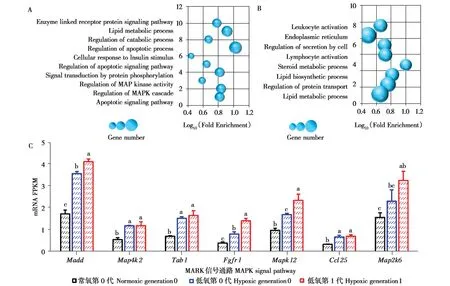
图7 低氧小鼠肝脏差异基因表达分析.低氧第0 代与低氧第1 代差异表达基因的GO 分析(A,B),MAPK 信号通路相关基因的mRNA FPKM表达量(C).不同字母代表各组间有显著性差异(P <0.05)Fig.7 Effects of exposure to high altitude hypoxia on next generation liver.GO analysis of differentially expressed gene between Hypoxic generation 0 and Hypoxic generation 1(A,B),mRNA FPKM expression level of genes related to MAPK signaling pathway(C).Bars with different letters were significantly different(P <0.05)
3 讨论
高原地区资源丰富,但环境恶劣,非习服动物长期生活在高原环境面临低压性缺氧问题。本研究通过在高海拔环境(3 220 m)建立低氧小鼠模型,发现长期低氧环境暴露后,低氧组小鼠肝脏比重增加,肝细胞肿胀,肝索间红细胞浸润;AST和ALT 水平显著上升,肝功能紊乱,并且这种影响在子一代加剧。除上述损伤外,低氧组亲代和子代的差异基因显著富集在MAPK、细胞凋亡、脂质代谢和内质网等信号通路。
肝脏不仅是能量代谢的关键决定器官,也是排泄毒物的重要器官(Corless and Middleton,1983)。本研究小鼠在受到低氧胁迫后肝细胞膜通透性及结构完整性受到破坏,AST 和ALT 从细胞中溢出至血液,血清中AST 和ALT 含量升高。此结果与低氧环境下大鼠(Liet al.,2014) 和牦牛(Liuet al.,2015)血清中ALT 和AST 活力均上升的研究结果一致。通常根据血清中这两种转氨酶的活性变化判断肝脏等组织器官的功能状况,它们被认为是反映肝细胞损伤的金标准(李永慧等,2016)。正常情况下血液中ALT 和AST 参与小鼠机体蛋白质代谢和能量转换,在机体肝组织出现损伤和病变时,两者的稳态被打破,呈现快速上升的趋势,此为适应低氧和寒冷的环境,蛋白质代谢率加强导致。另外,结合本研究低氧组肝脏组织切片中肝细胞出现脂肪变性和肝细胞肿胀的结果,推断高原环境低氧暴露可能破坏了小鼠脂质代谢过程,并诱发肝脏组织损伤。血清中的蛋白质承担着动物体免疫功能和正常生理的维持作用,其中血清白蛋白和球蛋白是与物质运输、能量供给和免疫力相关的两种重要蛋白质。本研究中这两种蛋白的水平随低氧暴露时间增加呈现先降低后升高趋势,暗示低氧暴露小鼠在低氧第1代时损伤加剧,对肝脏物质代谢和免疫系统影响加剧。
针对低氧导致的机体葡萄糖稳态,本研究主要从糖耐量和胰岛素敏感性来进行探讨。糖耐量试验已成为检测血糖耐受和胰岛素分泌最广泛应用的生理测试之一,与常氧组相比,低氧组在注射葡萄糖和胰岛素后2 h 内血糖无显著波动,由此可见,低氧暴露小鼠出现糖耐量异常的现象。另外,低氧组胰岛素水平显著低于对照组,2 h 内无明显波动,说明胰岛素已经不能充分发挥其正常生理功能,可以确定已出现胰岛素抵抗的现象。差异表达基因的KEGG 通路图分析发现,胰岛素抵抗受影响。胰岛素抵抗作用导致机体血糖代谢进入恶性循环中。机体出现胰岛素抵抗,胰腺β细胞分泌更多胰岛素,高胰岛素反过来进一步加重胰岛素抵抗,胰岛素抵抗和高胰岛素血症是2型糖尿病发病的基础,也是代谢综合征等疾病发生的重要根源(Tianet al.,2016)。另外,高原低氧暴露也影响了丝裂原活化蛋白激酶(Mitogen Activated Protein Kinase,MAPK)信号通路。MAPK和氨基末端激酶 (phosphorylated Jun N-terminal kinases,JNK)在功能上相似,两者的激活均具有负调控作用,导致细胞损伤和死亡(Cargnello and Roux,2011;Kanget al.,2017)。我们挖掘与MAPK 通路相关的基因,发现Madd、Map4k2、Tab1、Fgfr1、Mapk12、Ccl25和Map2k6等的表达量显著上调。其中CC 趋化因子受体9 (CC chemokine receptor 9,Ccr9) 是CC 趋化因子配体25 (CC chemokine ligand,Ccl25) 的独特受体,主要表达于淋巴细胞、树突状细胞和巨噬细胞(Vicariet al.,1997;Zaballoset al.,1999)。Ccr9介导炎性细胞趋化,参与炎性疾病的病理进展,Ccl25或Ccr9与肿瘤的发生及发展密切相关(Chenet al.,2012)。Ccr9敲除小鼠研究中发现,心肌梗死小鼠心脏中Ccl25和Ccr9表达量显著上调,Ccr9通过NF-κB 和MAPK 信号通路调控心肌梗死后的病理进展(Huanget al.,2016)。此结果与本研究Ccl25在肝脏中的表达量显著上调的结果一致。说明低氧暴露导致肝功能受损,同时也将影响心脏功能。
低氧诱导因子1(Hif-1)是从低氧的肝癌细胞株核提取物中发现的一种关键转录调节因子,可诱导细胞对低氧微环境的适应性反应并激活低氧反应基因(ke and Costa,2006)。Hif-1由氧调节的Hif-1α亚基和组成型表达的Hif-1β亚基组成。在常氧条件下,Hif-1α通过依赖氧的泛素化作用持续降解,从而保持低浓度的Hif-1α。缺氧时,氧依赖性降解途径被抑制,Hif-1α与Hif-1β形成二聚体并进入细胞核与靶基因的缺氧反应元件(Hypoxia response element,HRE) 结合,从而使细胞在缺氧状态下存活(Troeger and Schwabe,2011;Nath and Szabo,2012)。最近研究显示,MAPK 参与了Hif-1α活性的调节(Myloniset al.,2008;Wanget al.,2013)。像其他应激源一样,缺氧也可激活p38 (p38α,p38β,p38δ,p38γ)信号通路,这是MAPK 超家族的一部分。
在小鼠低氧第1 代特有的差异表达基因的GO通路分析中发现,低氧影响了内质网功能。研究发现缺氧、缺血、氧化应激、热休克、过量游离脂肪酸(脂肪毒性) 和营养过剩等应激条件,可改变内质网稳态,导致肝血脑屏障内质网应激(endoplasmic reticulum stress,ERS) (Henne,2019)。内质网应激导致肝细胞凋亡,这也是严重肝脏疾病的一个标志(Huanget al.,2014)。为了减轻ERS,机体激活了未折叠蛋白反应(unfolded protein response,UPR) 信号通路(Riuset al.,2017)。适应性UPR 可以保护细胞免受应激和重建细胞稳态;然而,持续的ERS 和UPR 激活促进细胞死亡(Xionget al.,2020)。大量证据表明,UPR 和ERS 参与肝脏并发症的各种病理过程(Lebeaupinet al.,2018;Lukaset al.,2019)。此外,缺氧被认为是激活ERS相关通路的重要应激源(Houet al.,2017)。值得注意的是,内质网稳态和UPR 的破坏所激活的信号通路与凋亡密切相关(Song and Malhi,2019),这与GO分析中细胞凋亡通路受影响结果一致。
综上所述,本文在高海拔环境建立低氧小鼠模型,发现长期处于低氧环境会引起亲代和子代肝脏组织受损,引起MAPK 和内质网应激通路受阻,肝细胞凋亡,引发炎症损伤,导致肝功能受影响。因此,本研究对高海拔肝病患者的子代遗传研究具有重要的借鉴意义。
