B7-H3与肺腺癌EGFR-TKI靶向治疗继发性耐药的相关性研究
2022-09-21刘欢欢樊星语陈礼文
杨 英,丁 萌,唐 伟,刘欢欢,樊星语,陈礼文
肺癌是目前世界上癌症相关性死亡的主要原因之一,其发病率在男性肿瘤中位居第一,在女性肿瘤中位居第二[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌的80%~85%,其中最常见的组织学亚型为腺癌[2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)为原癌基因c-erbB1的表达产物,是NSCLC的常见驱动因素和治疗靶点之一。对于EGFR突变的晚期肺癌患者,中国临床肿瘤协会(CSCO)推荐使用EGFR酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKI)作为一线治疗药物[3]。EGFR最常见的敏感型突变为外显子19位点缺失(DEL E746-A750)和外显子21位点突变(L858R),分别占比所有EGFR突变约50%和40%[4]。与放化疗等传统治疗比较,EGFR-TKI临床获益的患者表现为无疾病进展期(progression-free survival,PFS)延长,客观反应率(objective response rate,ORR)提高,生活质量得到极大改善。但肺癌患者在接受EGFR-TKI靶向治疗后不可避免的产生了获得性耐药性,这给肺癌的治疗带来了另一个挑战。
B7-H3(CD276)是B7家族的一员,属于B7-CD28通路的免疫检查点分子。B7-H3已被报道在多种恶性肿瘤中高表达,在肺腺癌中的阳性表达率约为60%,与患者的临床预后成负相关[5]。课题组前期研究结果显示B7-H3对EGFR-TKI靶向治疗具有调控作用,B7-H3基因敲除H3255和HCC827细胞对吉非替尼敏感性显著增加[6],但其对EGFR-TKI靶向治疗继发性耐药的作用目前尚未见报道。鉴此,该研究将围绕B7-H3对EGFR-TKI靶向治疗继发性耐药作用进行研究。
1 材料与方法
1.1 研究对象收集2016年9月—2021年5月在安徽医科大学第二附属医院接受外科切除或穿刺活检且有完整资料记录的肺腺癌患者。患者纳入标准:① EGFR敏感突变并接受EGFR-TKI标准化治疗,直至疾病进展或出现无法忍受的不良反应;② 数据分析时,治疗时间至少为3个月。排除标准:① 临床资料统计不全;② 严重心肺疾病。本研究经安徽医科大学第二附属医院医学伦理委员会批准,受试者签署书面知情同意书。
1.2 实验材料兔抗人单克隆抗体CD276、β-actin购于英国Abcam公司;羊抗兔二抗、DAB显色剂、柠檬酸盐修复液均购于北京中杉金桥生物技术有限公司;肺腺癌细胞系HCC827和H3255 购于上海富衡细胞库;RPMI 1640培养基购自美国 Gibco 公司; 胎牛血清购于美国Lonsera公司;吉非替尼购自美国MCE公司;蛋白裂解液 RIPA购于上海碧云天生物技术有限公司;蛋白酶抑制剂PMSF购于美国Sigma公司。
1.3 方法
1.3.1免疫组织化法检测B7-H3的表达 收集肺腺癌患者的石蜡切片,脱水、脱蜡后将柠檬酸修复液倒入高压锅进行加热修复抗原,3%过氧化氢阻断10 min,PBS冲洗后加入适当稀释(1 ∶100)的一抗(50 μl),37 ℃孵育60 min;滴加已标记的酶标抗鼠/兔聚合物,室温孵育15 min左右后PBS冲洗。新鲜配置酶底物显色液DAB,显微镜下控制显色,室温下染色3~5 min。脱水、透明、封片、显微镜观察拍照。癌细胞B7-H3表达强度定义为0(无)、1(弱)、2(中)、3(强)。本实验评估了B7-H3在肿瘤细胞膜和胞浆中的表达,对每一种B7-H3强度下的肿瘤细胞百分比进行评分。根据染色强度和阳性细胞百分比将标本分为低B7-H3表达组(1和2均<50%且3<25%)和高B7-H3表达组(1或2≥50%或3≥25%)进行统计分析。
1.3.2人EGFR敏感型突变肺腺癌细胞HCC827和H3255的培养及构建吉非替尼耐药细胞株HCC827/GR和H3255/GR 人肺腺癌细胞HCC827和HCC827/GR、H3255、H3255/GR放入含胎牛血清(10%)、青霉素(100 KU/L)及链霉素(100 mg/ml)的RPMI 1640培养基,在37 ℃,5% CO2培养箱(HF90/HF240,Heal Force)中常规培养传代。在人肺腺癌吉非替尼敏感细胞株HCC827的培养基中,按0.001、0.002、0.005、0.01、0.012 5、0.015、0.017 5、0.02 μmol/L浓度梯度逐步增加吉非替尼浓度,用浓度为0.02 μmol/L的吉非替尼维持细胞耐药性,以构建吉非替尼耐药株HCC827/GR;在人肺腺癌吉非替尼敏感细胞株H3255的培养基中,按0.001、0.002、0.005、0.01、0.02、0.05、0.075、0.1 μmol/L浓度梯度逐步增加吉非替尼浓度,用浓度为0.1 μmol/L的吉非替尼维持细胞耐药性,以构建吉非替尼耐药株H3255/GR。
1.3.3流式细胞术分析 将生长状态良好的H3255、H3255/GR、HCC827、HCC827/GR细胞用胰蛋白酶消化;收集1×106个细胞,PBS清洗2次,最后用100 μl重悬;取5 μl Anti-B7-H3-PE单克隆抗体处理细胞,在4 ℃冰箱里孵育30 min进行染色,避光;PBS清洗2次后上机,采用XL-MCL流式细胞术分析计数1×104个细胞,用FIOWJO软件进行数据分析和图形输出。
1.3.4Western blot实验 用PBS冲洗后各孔加含1%PMSF和磷酸酶抑制剂的RIPA裂解液,冰上摇晃裂解30 min后刮取细胞至EP管,离心(14 000 r/min,30 min,4 ℃)后收集上清液并使用BCA法进行蛋白定量,加入5×蛋白上样缓冲液,100 ℃煮沸10 min后冰上冷却。使用SDS-PAGE(10%分离胶+5%浓缩胶)电泳分离蛋白质,然后用电转膜仪转膜至PVDF膜,放入TBST洗去膜上的转膜液后,封闭2 h。TBST洗膜3次后加入一抗(抗CD276,1 ∶100)中4 ℃震荡孵育过夜。室温孵育二抗1~2 h,ECL两种试剂1 ∶1混匀后均匀滴加在膜上,使用ECL仪曝光显色,以β-actin作为内参。
1.3.5评价肺癌对EGFR-TKIs获得性耐药标准 患者接受单药EGFR-TKI治疗(吉非替尼或埃克替尼);同时具有以下情况则视为获得性耐药:EGFR-TKI治疗后评估到的客观临床获益;在过去30 d内持续接受吉非替尼或埃克替尼治疗后出现全身疾病进展[实体肿瘤反应评价标准(RECIST)或WHO定义的疾病进展];停止吉非替尼或埃克替尼与开始新疗法之间没有介入全身治疗[7]。

2 结果
2.1 人口特征基线分析本研究共纳入56例肺腺癌患者,年龄32~82(62.32±11.53)岁。除2例曾经吸烟者外,其余患者(n=54)均无吸烟史(戒烟时间超过1年)。患者B7-H3表达与年龄(<65岁vs≥65岁)、性别、肿瘤大小(≤25 mmvs>25 mm)、肿瘤分期(ⅢvsⅣ)、EGFR突变模式(19 Delvs21 L858R)以及EGFR-TKI靶向药物选择(吉非替尼vs埃克替尼)之间差异无统计学意义(P>0.05)。具体见表1。
2.2 肺腺癌患者B7-H3表达分析癌组织细胞膜和细胞浆B7-H3表达强度定义为0(无)、1(弱)、2(中)和3(强)(图1 A~D)。根据染色强度和阳性细胞百分比将标本分为低B7-H3表达组和高B7-H3表达组,结果显示高表达患者25例(44.6%),低表达患者31例(55.4%)。

图1 肺腺癌细胞B7-H3表达的免疫组化分析 HE ×200
2.3 肿瘤B7-H3表达水平与EGFR-TKI靶向治疗耐药分析截止本研究观察终止时间,B7-H3低表达和高表达患者继发性耐药分别为12例(38.7%)和14例(56.0%),其中位耐药时间分别为13.2个月和5.1个月,差异有统计学意义(t=3.193,P=0.004),表明高B7-H3组患者继发性耐药发生比例有所增加且耐药发生时间显著缩短(图2)。
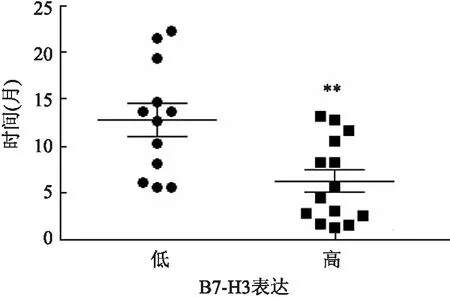
图2 不同B7-H3表达水平肺腺癌患者EGFR-TKI耐药比例和耐药时间
2.4 吉非替尼耐药细胞B7-H3表达分析流式细胞术和Western blot分析结果显示,EGFR突变细胞株H3255和HCC827本身B7-H3表达水平较高,但诱导建立的吉非替尼耐药株H3255/GR和HCC827/GR,与非耐药株比较,其B7-H3表达水平进一步上调(P>0.05,因为B7-H3在肺癌耐药与非耐药细胞株本身表达都很高,导致统计分析显示差异无统计学意义,但与非耐药株比较,其B7-H3表达水平仍然进一步上调,图3A、B),进一步提示了B7-H3与EGFR-TKI获得性耐药的相关性。根据蛋白条带做灰度值分析结果显示两种耐药株B7-H3的表达较非耐药株均上调,但灰度值之间差异无统计学意义(F=0.505、0.426,P=0.517、0.550,图3C)。
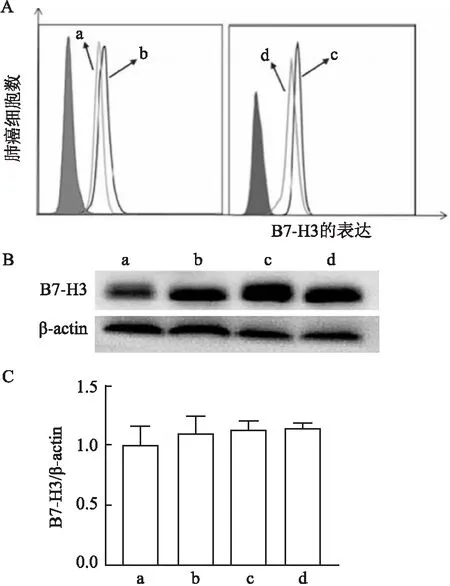
图3 流式细胞术和Western blot及蛋白条带灰度值分析吉非替尼耐药H3255和HCC827细胞株B7-H3表达
3 讨论
在56例病例中研究了具有EGFR敏感型突变且接受EGFR-TKI靶向治疗的肺腺癌患者B7-H3的表达和人口学特征对其表达的影响。免疫组化结果显示B7-H3表达水平在肺腺癌患者中存在明显差异,结果与Inamura et al[8]基本一致,Inamura et al研究表明EGFR野生型患者B7-H3表达水平高于EGFR突变型,并且吸烟患者高于不吸烟患者。此外本研究还发现B7-H3表达水平与患者年龄、性别、肿瘤大小与分期、EGFR突变亚型等差异均无统计学意义,结果与Sun et al[9]研究结果一致。
本研究发现高B7-H3表达与患者更易出现耐药性成正相关,尽管接受EGFR-TKI靶向治疗的肺腺癌患者大部分最终都会不可避免的发展为获得性耐药,50%~60%都与T790M管家基因出现突变有关,T790M突变使EGFR对ATP的亲和力增加,从而导致与ATP竞争的TKIs的置换[10]。本研究中B7-H3高表达组与低表达组存在明显差异,高表达组患者更易出现临床耐药性,发展为耐药的时间较低表达组明显缩短,提示B7-H3可能为EGFR-TKI耐药的另一机制。B7-H3诱导的信号转导可促进EGFR突变的肺腺癌细胞的存活,并降低其对吉非替尼的敏感性,并且有研究表明肺腺癌患者在接受EGFR-TKI靶向治疗前后其肿瘤微环境发生了改变[11]。本研究推测抑制B7-H3可能对肺癌肿瘤微环境也会产生有利影响,促进肺癌患者对靶向药物的敏感性,从而降低患者临床耐药率。
本研究成功诱导培养吉非替尼耐药的EGFR突变肺腺癌细胞株H3255和HCC827,并进行Western blot分析,EGFR突变细胞株H3255和HCC827本身B7-H3表达水平较高,与野生型细胞株比较,耐药株B7-H3表达水平进一步增加。B7-H3在肺腺癌等多种恶性肿瘤中与肿瘤转移复发和临床预后不良密切相关,B7-H3除了在免疫调节方面可以抑制肿瘤微环境中抗原特异性CD8+T细胞和NK细胞活性而促进肿瘤免疫逃逸,本身又可通过非免疫性机制促进肿瘤细胞的增殖、侵袭及转移[12]。另外,B7-H3诱导的信号通路包括3个级联通路:PI3K/AKT、JAK2/STAT3和Raf/MEK/ERK1/2,其促进肿瘤侵袭、迁移、血管生成和降低对药物的敏感性[13],它们也参与肺腺癌细胞EGFR触发的信号通路,表明B7-H3诱导的信号通路与EGFR信号通路部分具有共同的下游信号级联,这促使本研究推测B7-H3是否能成为EGFR-TKI耐药潜在的治疗靶点。并且课题组前期研究证明了B7-H3基因敲除H3255和HCC827细胞对吉非替尼敏感性显著增加[6],这进一步证实了B7-H3抑制可能是治疗EGFR-TKI耐药的一个有前途的选择。
综上所述,本研究证明共信号分子B7-H3在肺腺癌的表达水平存在明显差异,并且B7-H3高表达与肺腺癌患者EGFR-TKI靶向治疗的获得性耐药存在相关性,提示抗B7-H3治疗可能是预防EGFR-TKI耐药一个有前途的治疗策略,但关于B7-H3是如何影响耐药性及其相关作用机制有待后续实验进一步研究证明。
