慢性肾脏病患者小肠细菌过度生长情况及危险因素分析
2022-09-21晋竹青齐向明吴永贵
晋竹青,张 瑾,张 培,齐向明,吴永贵
肠道微生态与慢性肾脏病(chronic kidney disease,CKD)的密切联系是近年来的研究热点[1]。小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)指小肠微生物的数量增加和(或)菌群种类改变,可能导致营养吸收不良、脂溶性维生素缺乏和骨质疏松,或表现为腹痛、腹胀、腹泻等胃肠道非特异性症状[2]。既往诊断SIBO的金标准是小肠液抽吸物培养中微生物量≥103CFU/ml[3],由于这种操作的成本和侵袭性远高于粪便取样,人们对于小肠菌群的了解程度落后于大肠。乳果糖氢-甲烷呼气试验(lactulose hydrogen-methane breath test,LHMBT)是目前SIBO的一线诊断方法[2],其具有无创、简单快捷、高性价比等优势。Simenhoff et al[4]及Strid et al[5]曾用小肠置管的方法观察到肾衰竭患者十二指肠及空肠抽吸液培养中厌氧菌和需氧菌大量增加,但LHMBT在CKD患者中的应用仍较为有限[6],目前尚无研究探讨CKD患者发生SIBO的危险因素。该研究旨在通过LHMBT检测CKD患者SIBO的发生情况,并探讨其可能的危险因素,以期为临床改善CKD患者胃肠道症状提供新思路。
1 材料与方法
1.1 研究对象选取2019年6月—2021年6月在安徽医科大学第一附属医院肾脏内科住院的CKD患者92例。纳入标准:① 年龄>18岁;② 符合慢性肾脏病KIDGO诊断标准,根据CKD-EPI公式计算肾小球滤过率(estimated glomerular filtration rate,eGFR) ,定义有肾脏结构或功能异常不伴有eGFR下降或eGFR在45~89 ml/(min·1.73 m2)超过3个月以上为早期CKD(CKD1~3a期),eGFR<45 ml/(min·1.73 m2)且未接受肾脏替代治疗为中晚期CKD(CKD3b~5期);③ 腹膜透析患者需满足规律透析时间>6个月,未变更透析方式,且近3个 月未发生腹膜透析相关性腹膜炎。排除标准:① 有消化系统疾病史(急性胰腺炎、肝硬化、炎症性肠病、胃肠道肿瘤等)或胃、小肠、结肠、直肠手术史;② 伴随局部炎症、全身性感染者,有免疫功能缺陷或低下患者;③ 近1个月内使用抗生素、免疫抑制剂、质子泵抑制剂、肠道微生态制剂,近1周内使用止泻药或促胃肠动力药;④ 无法配合或耐受LHMBT检查。本研究经安徽医科大学第一附属医院伦理委员会批准(批件号:PJ2019-08-10),所有受试者签署知情同意书。
1.2 方法
1.2.1一般资料收集与实验室检查 采用面对面询问及查询病案系统的方法收集患者的一般资料,包括姓名、年龄、饮食习惯、吸烟史及饮酒史、合并症等。所有受试者均在空腹状态下接受腹部超声检查以确定有无脂肪肝。入院后24 h内采集清晨空腹血液,应用自动生化检测仪器检测白细胞、血红蛋白、白蛋白、磷、钙、钾、钠、血肌酐、血尿素氮、血尿酸、估算的肾小球滤过率、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、总胆红素、总胆固醇、三酰甘油、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、血沉、C反应蛋白等实验室指标。
1.2.2胃肠道症状评估 采用胃肠道症状评定量表(gastrointestinal symptoms rating scale,GSRS)评估过去1周患者的胃肠道症状,包括反流(反酸、烧心)、腹痛(上腹痛、饥饿痛)、消化不良(恶心、肠鸣、腹胀、嗳气、排气增多)、腹泻(腹泻、大便稀、排便紧迫感)和便秘(便秘、大便干结、排便不尽感)5个维度15种症状,选用Likert 7点等级评定法,1分表示完全没有,7分表示特别严重。计算各维度平均分,当平均分>1分即被认定有该维度相关症状。
1.2.3小肠细菌过度生长诊断 在患者入院后第2~4天内使用纳库仑呼气分析仪(型号Sunvou-CA4458,无锡尚沃医疗电子股份有限公司)检测呼气样本中氢气(H2)及甲烷(CH4)含量,浓度单位用ppm表示。确认受试者近1个月未使用抗生素,告知其在测试前1 d避免进食复合碳水化合物、乳制品、粗纤维蔬果,测试前需空腹8~12 h,且避免在测试当日吸烟和过度体力活动。测试开始前将D型接口与呼气仪相连校准,无误后先检测基础(空腹)H2、CH4浓度,嘱患者深吸气后屏气5~15 s,再匀速将全部气体吹入呼气仪接口内,获得基础呼气样本。将乳果糖10 g与200 ml温开水混合,嘱受试者快速饮服,随后每隔30 min呼气1次测定呼气中H2、CH4浓度,共计呼气4次,用时90 min。符合以下H2或CH4试验阳性标准任意一项即被认定为SIBO阳性[7]。H2呼气试验阳性:① 基础H2浓度>20 ppm;② 口服乳果糖90 min内H2浓度较基线上升≥20 ppm。CH4呼气试验阳性:基础或任意时间点测得CH4浓度>10 ppm。
1.2.4多频生物电阻抗人体成分分析 采用人体成分分析仪(型号BCM,费森尤斯医药用品有限公司)测定受试者人体成分参数。受试者尽量去除衣物和配饰,呈仰卧位,手背向上,将4个电极片置于非优势侧掌指关节、腕关节、跖趾关节及踝关节部,连接导线,输入受试者年龄、性别、身高、体质量等参数后,仪器基于多频生物电阻抗原理计算得到体质量指数(body mass index,BMI)、肌肉组织指数(lean tissue index,LTI)、脂肪组织指数(fat tissue index,FTI)等指标。

2 结果
2.1 一般资料及SIBO阳性率本研究共纳入患者92例,其中男52例,女40例,年龄22~65(43.65±10.11)岁,早期CKD(CKD 1~3a期)患者27例,中晚期CKD(CKD 3b~5期)患者34例,腹膜透析治疗患者31例。其中原发病为慢性肾小球肾炎59例,糖尿病肾病4例,其他原因(狼疮性肾炎、梗阻性肾病、单克隆免疫球蛋白肾病)3例,原因不明26例。92例患者中SIBO阳性44例(47.8%),早期CKD、中晚期CKD及腹膜透析治疗组间SIBO发生率的差异无统计学意义(χ2=3.821,P=0.148),见表1。在腹膜透析治疗组中根据腹透评估结果计算总Kt/V,将Kt/V≥1.7的患者分为透析充分组(17例),将Kt/V<1.7的患者分为透析不充分组(14例),两组在SIBO的发生率上的差异无统计学意义(41.2%vs50.0%,χ2=0.241,P=0.623)。
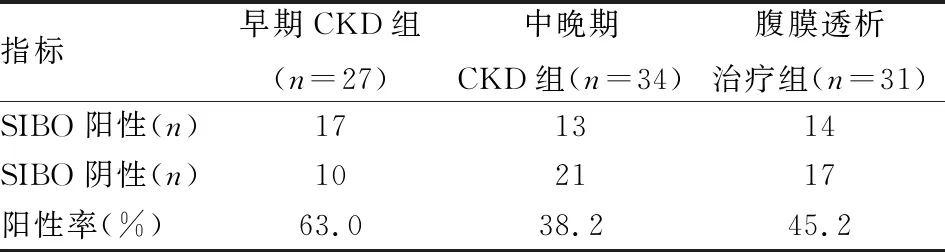
表1 CKD患者不同分组间SIBO发生率比较
2.2 SIBO阳性与SIBO阴性患者临床指标比较与SIBO阴性组比较,SIBO阳性组患者血钾水平明显降低、FTI明显升高(P<0.01),两组在血尿素氮和BMI上的差异有统计学意义(P<0.05),其余指标两组间差异无统计学意义,见表2。SIBO阳性组患者GSRS评分高于SIBO阴性组[(23.27±3.97)分vs(21.13±4.39)分,P=0.016],两组间在消化不良相关症状发生率上的差异有统计学意义(P=0.032),见表3。
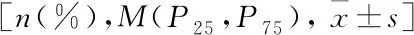
表2 SIBO阴性与SIBO阳性组患者临床指标比较
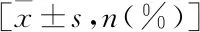
表3 SIBO阴性与SIBO阳性组患者胃肠道症状发生情况
2.3 CKD患者发生SIBO的危险因素以是否发生SIBO为因变量,以单因素分析有统计学意义的指标为自变量,纳入多因素Logistic逐步回归分析模型,结果提示低钾(OR=0.396,95%CI0.176~0.893,P=0.025)和高FTI (OR=1.182,95%CI1.037~1.348,P=0.013)是CKD患者发生SIBO的独立危险因素,见表4、5。
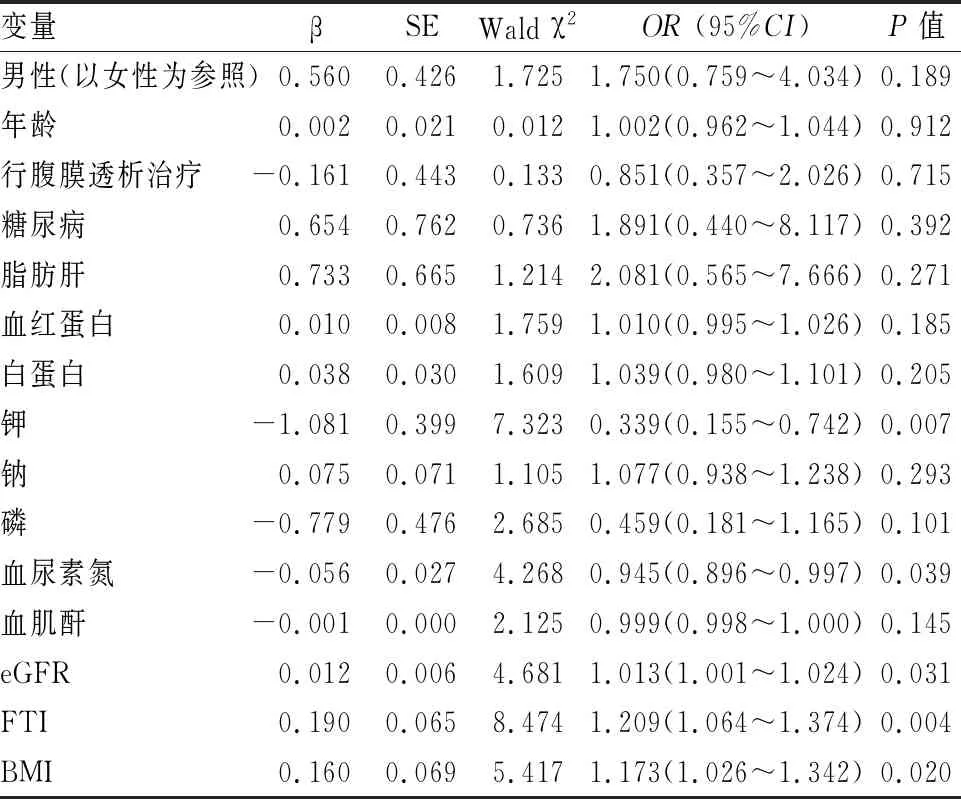
表4 CKD患者发生SIBO的单因素Logistic回归分析
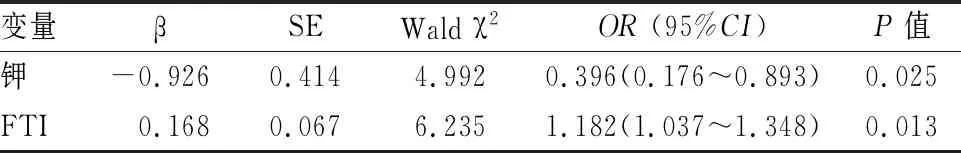
表5 CKD患者发生SIBO的多因素逐步Logistic回归分析
3 讨论
SIBO是肠道微生态改变的重要环节,已被发现与肠易激综合征、炎症性肠病、肝硬化等多种疾病相关[8]。尽管有限的小样本临床研究提示SIBO在尿毒症患者中较为常见[4-5],目前仍缺乏对更为广阔的CKD人群进行SIBO的相关探究。既往研究中SIBO在健康对照人群的发生率在0%~20%[9],本研究使用LHMBT检测CKD患者SIBO的阳性率为47.8%,表明SIBO在CKD患者中普遍存在,但早期与中晚期CKD患者SIBO的发生率并无明显差异,且腹膜透析治疗、透析充分性似乎与SIBO的发生无明显相关性。
本研究发现,SIBO阳性组GSRS评分高于阴性组[(23.27±3.97)分vs(21.13±4.39)分,P=0.016],主要表现在消化不良症状更为突出,这说明SIBO可能导致CKD患者出现更严重的胃肠道症状。原因可能在于与SIBO相关的小肠绒毛萎缩和上皮炎症反应导致肠道吸收表面积减少[10],细菌分泌毒素使小肠黏膜刷状缘双糖酶活性下降,致使碳水化合物吸收不良、发酵产气过多,更易导致腹胀、排气增多等消化不良症状[11]。值得关注的是,CKD患者SIBO的发生率并未随着肾功能的下降而呈上升趋势,肾功能下降与SIBO可能共同导致了CKD患者的非特异性胃肠道症状。随着疾病进展及接受透析治疗,CKD患者存在饮食结构、身体肌肉和脂肪成分的改变[12-13],多种因素参与使得SIBO发生率与肾功能之间并非简单的线性关系。
目前已知SIBO的危险因素包括:小肠解剖异常、运动功能障碍、免疫缺陷、胃酸过少和质子泵抑制剂的使用等[8],但这些因素不足以解释CKD患者SIBO现象。本研究发现血钾偏低是CKD患者发生SIBO的独立影响因素。在结构上,低钾可导致肠道黏膜和黏膜下层水肿,小肠绒毛充血,单核吞噬细胞浸润Peyer’s斑,从而影响肠道通透性及黏膜免疫功能;在功能上,低钾环境下肠道蠕动减缓,小肠微生物群易发生结肠样改变,表现出更大的多样性和丰度。在Shu et al[14]对持续不卧床腹膜透析患者的研究中,低钾血症组氢气呼气试验的阳性率略高,与本研究结果一致。
既往的荟萃分析提示肥胖个体的SIBO发病风险是非肥胖个体的3倍[15]。原因可能是肥胖患者更易发生肠道运动功能障碍。在针对肥胖患者的临床研究及高脂饮食诱导的动物模型中观察到小肠簇状收缩增加、肠道移行运动复合波Ⅲ期运动异常[16],这些现象可能共同引起近端小肠转运加速而远端小肠转运减慢[17],诱发SIBO。在多数SIBO的研究中,BMI是评估患者肥胖程度的常用指标[18],但其可能不足以准确区分CKD患者在脂肪、肌肉含量和容量状态上的差异。人体成分分析技术常用于评估透析患者的营养状况及容量负荷,但目前在SIBO患者的应用尚无文献报道。本研究显示,FTI是CKD患者发生SIBO的独立危险因素。FTI即脂肪质量/身高2,可以准确反映个体在全身脂肪含量上的差异。Fialho et al[19]曾提出相似观点,其利用腹部CT横断面测量法发现内脏脂肪与皮下脂肪比值升高与SIBO发生独立相关。尽管基于多频生物电阻抗技术获得的FTI无法区分脂肪的皮下及内脏分布情况,但其更为方便快捷且可以同时为评估患者容量负荷提供参考,更适用于CKD患者。
本研究的局限性在于:① 本研究为单中心横断面研究,无法验证SIBO与低钾及高FTI之间的因果关系,且缺乏与健康对照组、血液透析组比较;② 样本量较少,可能存在选择偏移;③ 受限于患者的个体差异性及依从性,难以避免膳食及药物带来的混杂因素。
综上所述,CKD患者中SIBO的发生率较高,SIBO阳性患者更易出现消化不良症状,避免较低的血钾水平和较高的脂肪含量可能有助于减轻CKD患者部分胃肠道症状。
