抗生素对大鼠肠道菌群和认知行为的影响
2022-09-21李艳丽杨小荣郭军红
李艳丽,杨小荣,张 策,郭军红
在人体肠道生活着100万亿个微生物,是人体细胞总数的10倍,被称为肠道微生物或肠道菌群[1]。抗生素作为干预肠道菌群的主要方式之一,会引起肠道菌群失调,影响认知行为。研究[2]表明,联合抗生素(氨苄青霉素、杆菌肽、美罗培南、新霉素和万古霉素)处理可使小鼠新物体识别记忆受损。氨苄青霉素处理引起小鼠空间记忆和新物体识别记忆缺陷[3]。但是这些研究并未报道抗生素处理后肠道菌群是否恢复以及对认知行为的长期影响。该研究通过4种广谱抗生素联合应用观察大鼠肠道菌群的改变、恢复及对认知行为的影响。
1 材料与方法
1.1 实验动物与分组3月龄SPF级雄性SD大鼠(n=12),体质量280~300 g,购自长沙天勤生物技术有限公司[许可证号为SCXK(湘)2014-0010]。所有大鼠在山西医科大学实验动物中心饲养,每笼2只,环境温度20~22 ℃,湿度50%,昼夜明暗交替时间为12 h/12 h。食物和水经高压灭菌,所有动物自由进食和水。
实验大鼠随机分两组,每组6只。一组为抗生素处理(AT)组,用抗生素混合液灌胃3 d。抗生素混合制剂为:氨苄青霉素[180 mg/(kg·d),山东鲁抗医药股份有限公司],万古霉素[72 mg/(kg·d),华北制药股份有限公司],甲硝唑[90 mg/(kg·d),陕西必康制药集团控股有限公司]和亚胺培南[90 mg/(kg·d),杭州默沙东制药有限公司],每天2次(间隔12 h),每次灌胃2 ml,持续3 d,之后常规饲养至2个月。另一组为对照(Control)组,灌胃等量的生理盐水持续3 d,之后常规饲养至2个月。在第4天(距最后一次抗生素处理24 h)收集粪便进行肠道菌群检测。在2个月时进行肠道菌群和认知行为的检测。
1.2 粪便样本采集在第4天(距最后一次抗生素处理24 h)和2个月时分别收集粪便进行肠道菌群检测。采集粪便前,紫外消毒通风橱处理30 min。采集时,带上无菌手套,在通风橱收集大鼠粪便0.5~10 g,装入无菌冻存管,立即放在冰上并做好标记,迅速放入液氮中,收集完后立即放入-80 °C冰箱保存。
1.3 16s rRNA基因测序用粪便DNA提取试剂盒(生产批号154041641,德国Qiagen公司)提取各样本微生物组总DNA,委托上海派森诺生物科技股份有限公司在Illumina MiSeq高通量测序平台进行高通量测序。使用QIIME2软件和VSEARCH软件进行序列去噪和可操作分类单元(operational taxonomic unit,OTU)聚类。使用R软件包(v3.1.1)计算OTU数量和Shannon多样性指数。使用R软件包进行基于加权UniFrac距离的非度量多维尺度(nonmetric multidimensional scaling,NMDS)分析,显示样本间OTU组成的差异。使用RDP Classifier软件v.2.2对OTU代表性序列进行物种水平的分类,置信阈值80%。在R(v3.1.1)软件进行统计分析[4]。
1.4 基于操作条件反射的延迟匹配样本任务(delayed matching to position,DMTP)检测在操作条件反射测试室(MED-007-CT,美国Med Associates公司,图1A),通过基于操作条件反射的DMTP检测大鼠的工作记忆(图1B)。在训练开始前5 d,限制大鼠饮食,使其体质量维持在原体质量的80%~85%,但不限制饮水,直至行为实验结束。
训练阶段程序:① 首先进行食槽训练,每次实验时长64 min,包括38粒食物颗粒,间隔(100±40)s;② 压杆训练,每次随机伸出左杆/右杆,老鼠压杆后获得一次食物奖励,每次实验时长30 min,包含50次压杆。
延迟匹配任务:包括3个阶段即样本阶段、延迟阶段和选择阶段(图1B)。样本阶段:房灯亮,实验开始,一个杆伸出(左右随机,此杆为“sample”杆),老鼠压杆,杆回缩,开始计时延迟。延迟阶段:鼠要鼻触食槽,延迟后的第1次鼻触,左右两杆同时伸出,进入选择阶段。选择阶段:① 鼠压正确杆(样本阶段“sample”杆为正确杆),两杆回缩,奖励食物颗粒,5 s间隔后,进行下一次测试;② 鼠压错误杆,两杆回缩,房灯灭5 s,即“timeout”期。开始训练时,延迟设为0 s。如果连续2次实验正确率达80%以上,进入延迟。延迟1,延迟设为0 s、1 s、2 s、3 s、4 s、5 s、6 s,7个延迟为一组(block),一组中每个延迟随机出现且每个延迟只出现一次,7个延迟后进入下一组。如果连续2次实验正确率达80%以上,进入延迟2。延迟2设为0 s、1 s、2 s、4 s、8 s、12 s、16 s。如果连续2次实验正确率达80%以上,开始测试实验,延迟设为0 s、2 s、4 s、8 s、12 s、18 s、24 s,连续测试5个实验,记录每个延迟的正确率。在抗生素处理后2个月时进行测试实验。
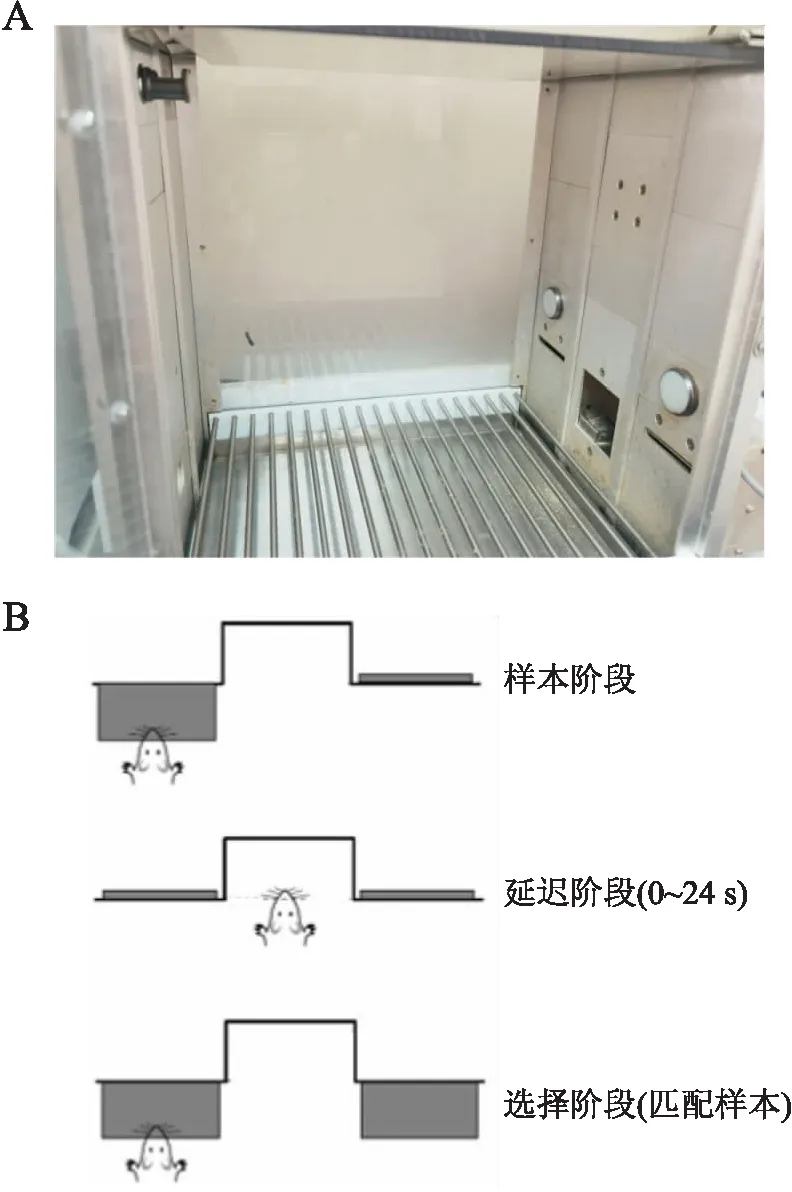
图1 基于操作条件反射的DMTP
1.5 Y迷宫检测Y迷宫(XR-XY1032,上海欣软信息科技有限公司)共3个臂,各个臂夹角120°,每一臂尺寸60 cm×10 cm×35 cm(长×宽×高)。实验时在迷宫各个臂内贴上不同几何图形,作为视觉标记。Y迷宫检测大鼠的空间记忆。实验分2个阶段。第1个阶段为训练期,用隔板挡住一个臂(此臂为新异臂),大鼠由起始臂背对迷宫的中心放入,在起始臂和其他臂自由探索10 min,然后取出;间隔1 h后,开始第2个阶段为测试期,打开新异臂,大鼠仍由起始臂放入,在3个臂探索5 min。记录大鼠进入每个臂的次数及在每个臂的持续时间。每次实验的新异臂与起始臂随机设置,且每组样本新异臂在起始臂的左侧和右侧动物数相等。在抗生素处理后2个月时进行。

2 结果
2.1 抗生素处理减少大鼠肠道菌群数量用氨苄青霉素、万古霉素、甲硝唑和亚胺培南4种抗生素联合处理3 d可减少大鼠肠道菌群数量。与Control组比较,AT组大鼠肠道菌群OTU数量明显减少(见图2A)。
从Rarefaction稀疏曲线可以看出,随测序量不断增加,稀疏曲线变缓,序列深度足够,可以反映当前样品所包含的多样性(见图2B)。Control组大鼠Shannon指数为(7.93±0.41),AT组大鼠Shannon指数(3.64±0.57)降低,差异有统计学意义(t=13.18,P<0.000 1)。
基于UniFrac距离的NMDS结果表明,AT组大鼠肠道菌群(AT-1)与Control组(Control-1)不同(见图2C)。在门水平,共检测出15个门。其中拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)之和占0.90以上,是大鼠粪便中主要的优势菌门。与Control组比较,AT组Bacteroidetes减少,差异有统计学意义(t=9.891,P<0.000 1,见图2D);Firmicutes减少,差异有统计学意义(t=7.397,P=0.000 1,见图2D);而变形菌门(Proteobacteria)增加,差异有统计学意义(t=18.37,P<0.000 1,见图2D)。在属水平,AT组大鼠Prevotella、Blautia、Phascolarctobacterium、Sutterella、Bacteroides、Ruminococcus、Parabacteroides数量减少(见图2E、F)。
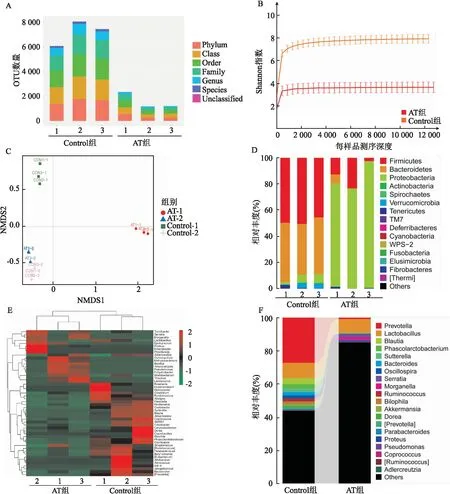
图2 第4天AT组和Control组大鼠的肠道菌群差异
2.2 抗生素处理后2个月大鼠肠道菌群恢复抗生素处理后2个月AT组大鼠肠道菌群OTU数量恢复,与Control组比较差异无统计学意义(见图3A)。肠道菌群多样性也恢复,Control组Shannon指数为(8.83±0.24),AT组Shannon指数为(9.13±0.34),两组比较差异无统计学意义(见图3B)。
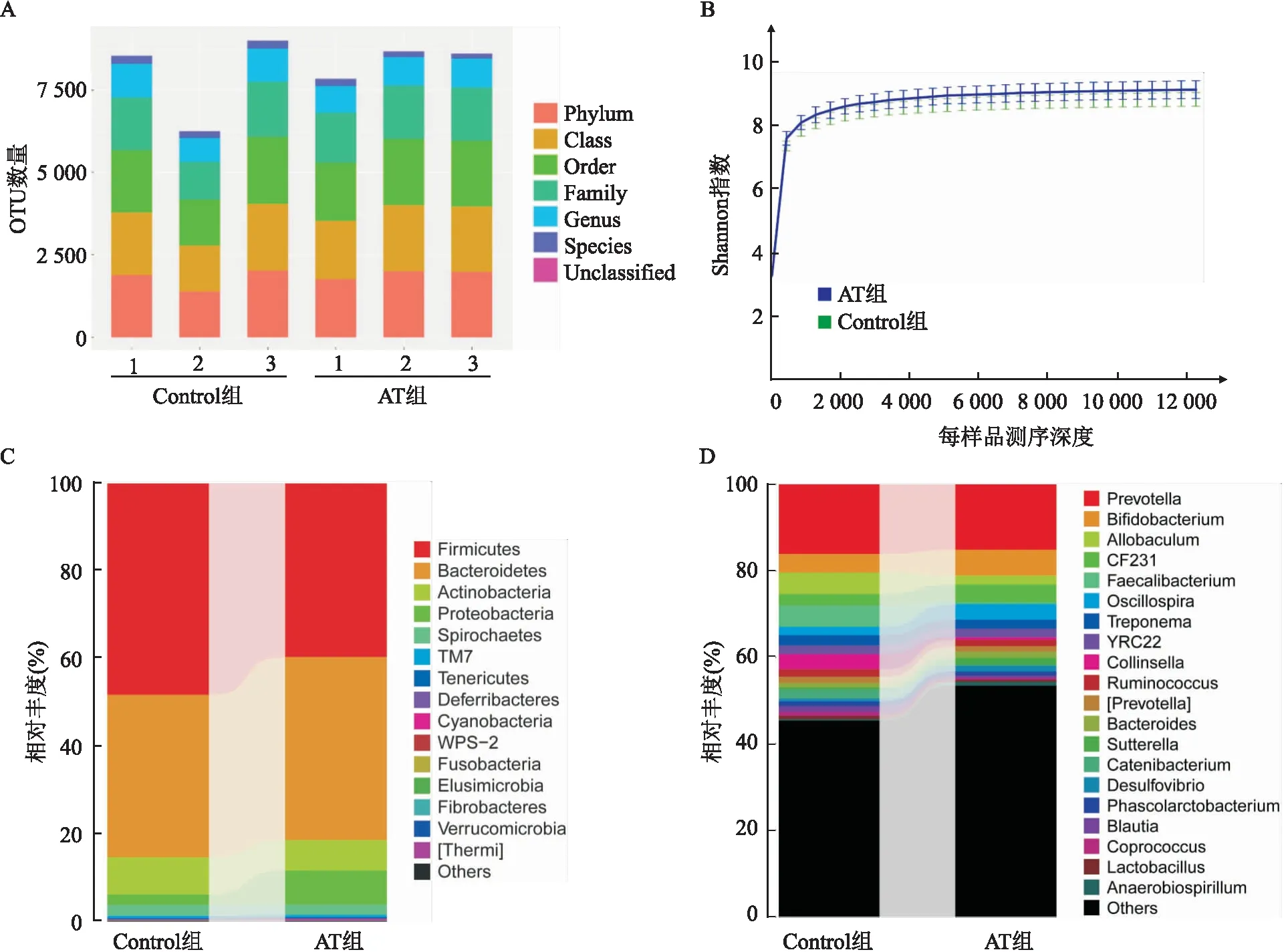
图3 抗生素处理后2个月AT组和Control组大鼠的肠道菌群
基于UniFrac距离的NMDS结果表明,抗生素处理后2个月AT组(AT-2)肠道菌群可以恢复,与Control组(Control-2)比较差异无统计学意义(见图2C)。在门水平,2个月后拟杆菌门和厚壁菌门数量恢复,与Control组比较差异无统计学意义(见图3C)。在属水平,2个月后Prevotella、Ruminococcus、Bacteroides、Sutterella、Phascolarctobacterium数量恢复,与Control组比较差异无统计学意义(见图3D)。
2.3 抗生素处理对工作记忆的影响通过基于操作条件反射的DMTP检测Control组和AT组大鼠的认知行为。结果显示,随着延迟的增加,Control组和AT组大鼠的正确压杆率均减少。Control组大鼠在0 s、2 s、4s、8 s、12 s、18 s、24 s延迟的正确压杆率分别为100.0%、99.5%、98.8%、93.0%、88.3%、81.5%、80.8%;AT组大鼠在0 s、2 s、4 s、8 s、12 s、18 s、24 s延迟的正确压杆率分别为98.8%、99.0%、96.0%、91.2%、83.7%、83.0%、77.3%。在各延迟,两组大鼠的正确压杆率比较差异无统计学意义(F=3.029,P=0.112,见图4)。
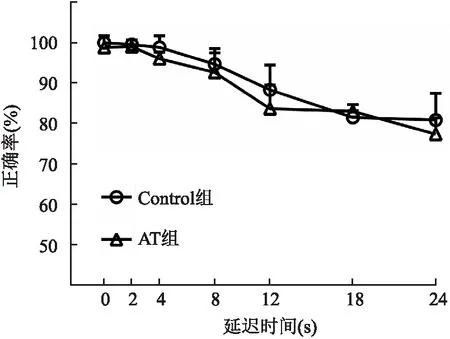
图4 利用DMTP检测Control组和AT组大鼠的工作记忆
2.4 抗生素处理对空间记忆的影响大鼠在探索Y迷宫新异臂的次数和时间反映其空间记忆功能。Y迷宫检测结果显示,两组大鼠探索新异臂的次数和时间比较差异无统计学意义。Control组大鼠探索新异臂次数占总探索次数的比率为(0.43±0.01),AT组为(0.46 ±0.02),两组比较差异无统计学意义(t=1.131,P=0.284,见图5A)。同样,Control组大鼠探索新异臂的时间占总探索时间的比率为(0.54± 0.03),AT组为(0.56±0.03),两组比较差异无统计学意义(t=0.381,P=0.711,见图5B)。
图5 利用Y迷宫检测Control组和AT组大鼠的空间记忆
3 讨论
健康成年人的肠道菌群有两个主要门:拟杆菌门和厚壁菌门,占0.90以上;其次为放线菌门、变形菌门、梭杆菌门和疣微菌门[5]。肠道菌群为人类的“第2基因组”,从出生开始定植于人体肠道[6]。微生物与宿主互利共生,在营养代谢、维持肠黏膜屏障功能和免疫调节中起着重要作用[7-8]。
肠道菌群在调控大脑功能及行为中发挥重要作用,因此提出了“微生物-肠-脑轴”的概念[9-10]。抗生素处理影响正常肠道菌群的数量和结构,引起菌群失调。研究[3]表明,氨苄青霉素处理的小鼠厚壁菌门数量减少,引起小鼠Morris水迷宫空间记忆和新物体识别记忆缺陷。万古霉素和氨苄青霉素处理短暂性前脑缺血小鼠会增加变形菌门的数量,加重其在Y迷宫、新物体识别和巴恩斯迷宫任务中的认知功能损害[11]。另一项研究[2]用氨苄青霉素、杆菌肽、美罗培南、新霉素和万古霉素5种抗生素组合处理的小鼠肠道菌群数量减少和细菌多样性下降,引起小鼠新物体识别记忆受损。这些研究表明一种抗生素或抗生素组合短期处理可能破坏肠道菌群而影响认知功能,但是停用抗生素后肠道菌群是否会恢复以及对认知行为是否有长期影响并未见报道。
本研究应用氨苄青霉素、万古霉素、甲硝唑和亚胺培南4种抗生素联合处理,观察到抗生素抑制大鼠肠道菌群,引起肠道菌群多样性减少,优势菌拟杆菌门和厚壁菌门数量均减少。与之前的研究[2]结果一致,氨苄青霉素、万古霉素、甲硝唑和和亚胺培南组合可以非选择性的去除肠道微生物,引起优势菌的普遍下调。因此,本研究进一步证实短期使用抗生素处理是一种有效的模型,可以探索微生物群及其依赖性脑功能和行为变化的因果关系。除了抗生素处理,无菌(germ free,GF)动物也是研究肠道菌群的一个有利工具[12]。因为GF动物不含有任何菌群,可以单独引入某一菌株来观察其对宿主健康的作用,或通过移植患者(或疾病模型动物)的粪便微生物来观察肠道菌群对疾病发生发展的影响。但是GF动物表现为永久性神经发育和认知行为缺陷[13],因此当前GF动物的相关研究仍有一些值得改进的地方。与GF动物研究比较,本研究证实广谱抗生素的短期应用并不会对认知行为造成长期影响。本研究结果进一步支持,通过广谱抗生素处理抑制宿主肠道菌群,然后移植患者或疾病模型动物的粪便微生物来观察其对认知功能的作用是一种更为理想的模型。
