慢性间歇性缺氧调控mTOR-自噬信号致小鼠焦虑和抑郁样行为机制研究
2022-09-21赵振涛程玉洁梅金玉
赵振涛,程玉洁,梅金玉,陈 明
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hyponea syndrome, OSAHS)是目前世界主要的公共卫生难题之一,被认为是心脑血管疾病、神经系统损伤、机体代谢功能损伤的独立危险因素[1],其神经精神症状主要表现为焦虑、抑郁以及阿尔兹海默症[2-3]。慢性间歇性缺氧(chronic intermittent hypoxia, CIH)是OSAHS的主要临床特征之一[4],海马及前额叶皮层作为情感的结构基础,易受到缺氧刺激的影响[5]。该课题组前期预实验结果提示CIH可导致小鼠出现焦虑及抑郁样行为,由此推测小鼠出现焦虑和抑郁样行为可能与其海马或前额叶皮层的分子机制改变以及结构损伤有关。但是关于OSAHS患者经过治疗后,其焦虑和抑郁症状的改善情况报道较少。因此,该研究拟通过CIH模拟OSAHS对小鼠焦虑和抑郁样行为的影响,并探索其机制,为防治OSAHS患者出现焦虑和抑郁样行为提供一定程度上的理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物 C57BL/6小鼠,雄性,体质量(20±1)g,购自杭州子源实验动物科技有限公司,生产许可证号:SCXK(浙)2019-0004。
1.1.2试剂 Western blot 一抗NLRP1(1 ∶1 000, 美国Abcam公司)、NLRP3(1 ∶800, 美国Abcam公司)、Atg7(1 ∶1 000, 美国CST公司)、p62(1 ∶1 000, 美国Affinity公司)、mTOR(1 ∶1 000, 美国Affinity公司)、p-mTOR(1 ∶1 000, 美国Affinity公司)、β-actin(1 ∶5 000, 美国Affinity公司),二抗(1 ∶10 000, 美国Affinity公司),BCA蛋白浓度检测试剂盒(美国Rockford Biotechnology Company公司)。
1.1.3主要仪器 全自动样品冷冻研磨仪(上海净信实业发展有限公司)、水平摇床(天津欧诺仪器股份有限公司)、电泳仪(美国Bio-Rad公司)、全波长酶标仪(美国Thermo Fisher公司)、电子天平(瑞士Mettler Toledo公司)、KDC-120HR高速冷冻离心机(安徽中科中佳科学仪器有限公司)、Chemi Doc TMMP Imaging System(美国Bio-Rad公司)、TST-100悬尾视频分析系统(成都泰盟软件有限公司)、旷场图像采集及分析系统(上海欣软信息科技有限公司)。
1.2 分组与动物模型建立小鼠常规适应性饲养1周后随机分为对照组(Ctrl组)和CIH组,每组7只。参照Zhang et al[6]的CIH造模方法,并根据本研究实际情况对造模方法进行适当调整。Ctrl组在正常空气环境中常规饲养。CIH组每天8:00—16:00 将小鼠置于动物间歇低氧舱中,舱内氧浓度维持在6%~21%(舱内氧气浓度30 s内由21%降低至6%并维持30 s,然后在12 s内升高至21%并维持18 s,每个循环90 s),持续8周,CIH组间歇性缺氧过程自由进食水。
1.3 小鼠行为评价试验
1.3.1小鼠运动功能和焦虑状态评价 使用旷场实验进行小鼠焦虑状态评价。测试箱(96 cm×96 cm×50 cm)分成9个相等的正方形。首先,将小鼠放置于测试箱中央区域,自由活动适应2 min后,拍摄3 min内小鼠在实验箱内的活动情况,分析运动轨迹,计算运动距离、平均速度、进入中央区域时间、穿线次数。每只小鼠实验后,清洁测试箱的四周和底壁,以消除嗅觉信号,并擦干测试箱,以消除嗅觉信号。
1.3.2小鼠抑郁状态评价 应用悬尾实验评价小鼠抑郁状态。实验时,从每组随机选取3~4只小鼠,用夹子夹住尾尖1 cm处,随后将小鼠倒立悬吊于实验舱内,小鼠腹部正对摄像机,测试时间为6 min,由监控系统拍摄记录小鼠实验后4 min内的活动情况,计算累积不动时间。
1.4 Western blot 检测小鼠海马及前额叶皮层的炎性小体、自噬相关蛋白行为测试结束后,先麻醉两组小鼠,然后断头处死动物,解剖脑组织,冰上取出海马及前额叶皮层组织。根据BCA蛋白质浓度检测试剂盒操作说明测定海马及前额叶皮层总蛋白浓度。根据总蛋白浓度确定上样量,10% SDS-PAGE用于分离样品。经过上样、电泳(75 V, 45 min;120 V, 1 h)、转膜(200 mA, 1 h;300 mA, 30 min) 、封闭(5%脱脂奶粉)、一抗4 ℃过夜、TBST洗膜、二抗孵育、TBST洗膜,最后加入显影液,使用Chemi Doc TMMP成像系统及专业分析软件进行分析。以β-actin为内参。

2 结果
2.1 CIH对小鼠旷场实验中行为的影响与Ctrl组比较,CIH组小鼠在旷场实验中的运动距离、穿线次数、平均运动速度降低(t=6.377、6.131、6.362,均P<0.001),表明CIH可以一定程度上影响小鼠的运动功能;此外,与Ctrl组比较,CIH组小鼠在旷场实验中的中央区域时间减少(t=9.295,P<0.001),表明CIH可导致小鼠出现焦虑样行为。见图1。
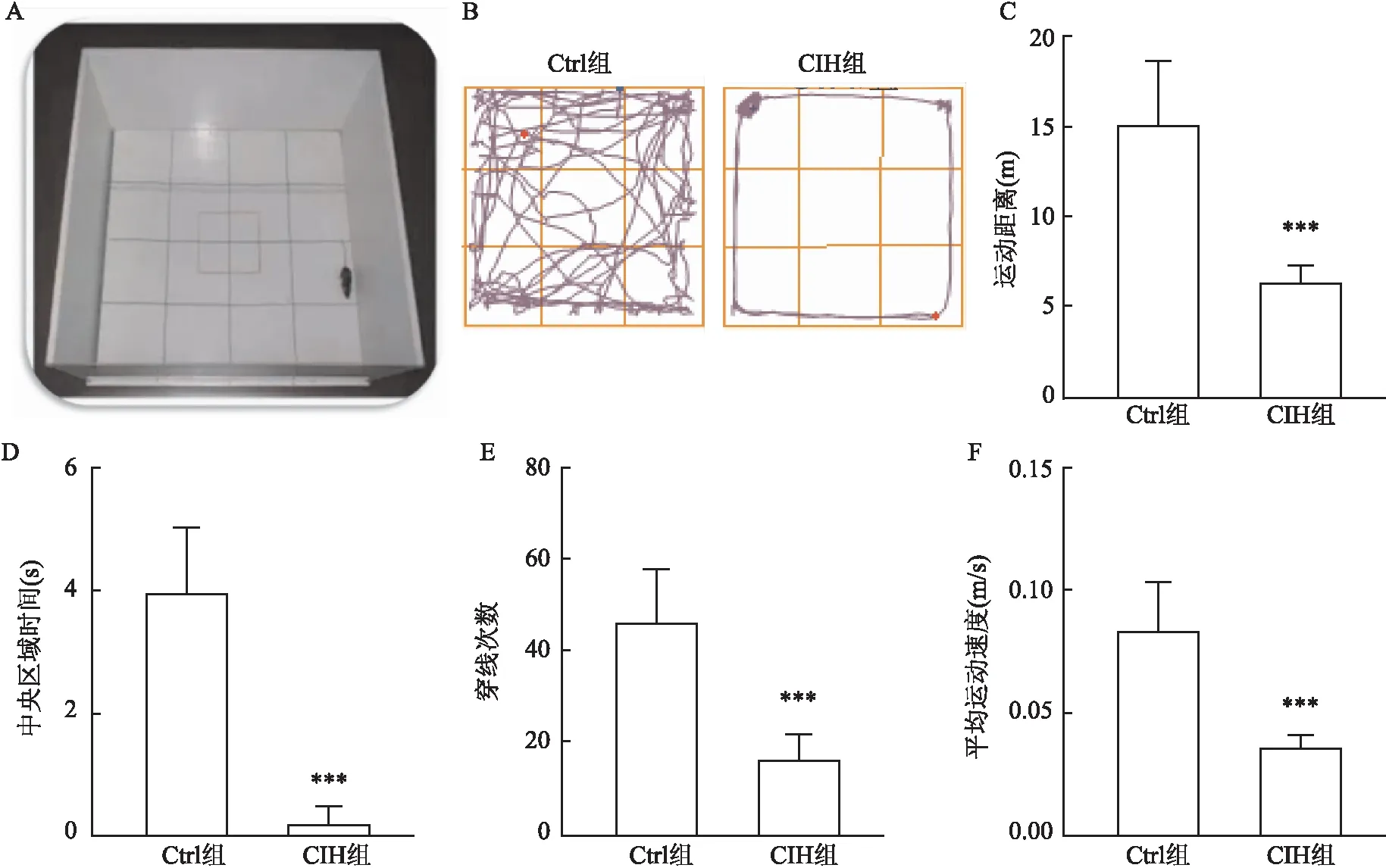
图1 旷场实验
2.2 CIH对小鼠悬尾不动时间的影响在悬尾实验中,与Ctrl组比较,CIH组小鼠的不动时间增加,差异有统计学意义[(68.59±35.75) svs(161.93±38.76) s,t=4.684,P<0.001],提示经过8周的CIH,小鼠出现抑郁样行为。见图2。
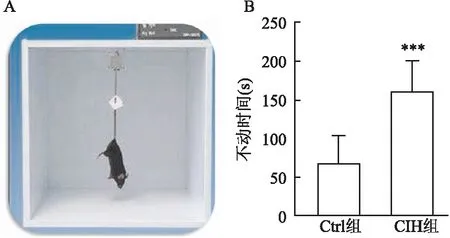
图2 悬尾实验
2.3 CIH对小鼠海马区神经炎症的影响采用Western blot方法检测两组小鼠海马及前额叶皮层组织中炎性小体含量,发现CIH组小鼠海马中的NLRP3(t=15.320,P<0.001)水平上调,而NLRP1(t=1.159,P>0.05)保持不变;CIH组小鼠前额叶皮层中NLRP3(t=0.049 15,P>0.05)、NLRP1(t=1.656,P>0.05)均无明显改变,表明CIH可诱导小鼠海马区发生神经炎症。见图3。
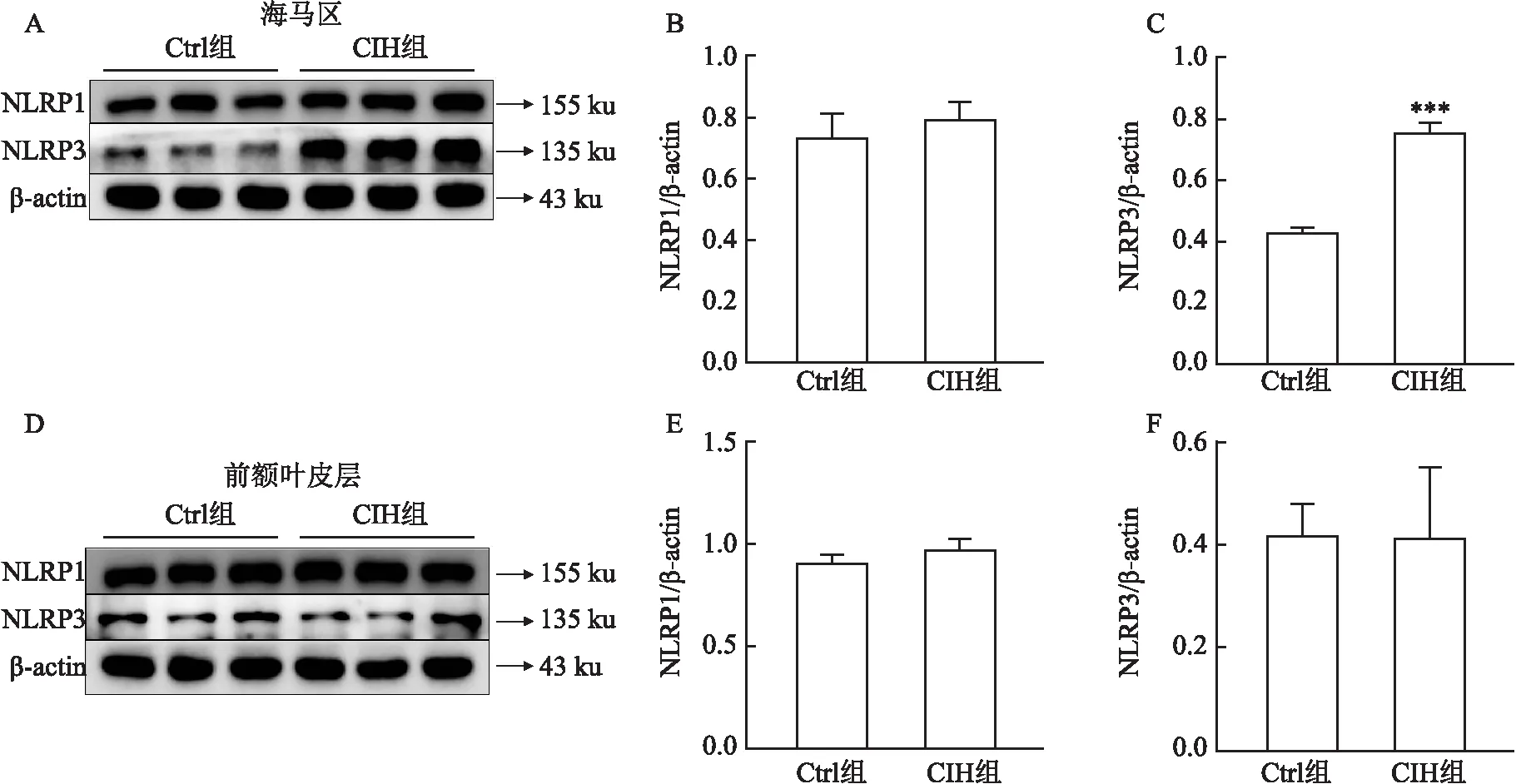
图3 CIH对炎症小体水平的影响
2.4 CIH对小鼠海马区自噬水平的影响通过Western blot检测了CIH后小鼠海马及前额叶皮层组织中自噬相关蛋白的水平,发现CIH组小鼠海马组织中Atg7水平下降(t=3.511,P<0.05),而p62(t=2.059,P>0.05)水平无明显改变;前额叶皮层中Atg7(t=0.170 3,P>0.05)、p62(t=0.813 3,P>0.05)水平均无明显改变,提示CIH可降低小鼠海马区自噬水平。见图4。
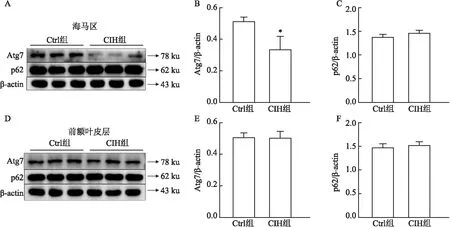
图4 CIH对自噬水平的影响
2.5 CIH对小鼠海马区mTOR信号的影响同时,AMPK促进自噬启动,m-TOR是自噬途径的负调节因子。AMPK通过直接磷酸化和抑制m-TOR磷酸化来激活细胞自噬,m-TOR磷酸化水平增加可抑制机体自噬水平。为了探讨CIH是否通过m-TOR途径影响自噬,本研究同时检测了CIH后小鼠海马区及前额叶皮层中m-TOR途径相关蛋白的水平,发现小鼠海马组织中p-mTOR水平上调(p-mTOR/β-actin、p-mTOR/mTOR的t值分别是4.709、5.076,均P<0.05),而前额叶皮层中mTOR(t=0.172,P>0.05)及p-mTOR(p-mTOR/β-actin、p-mTOR/mTOR的t值分别是0.623 3、0.907 7,P>0.05)水平均无明显改变,表明CIH可通过激活mTOR磷酸化,产生过量p-mTOR,从而推测p-mTOR抑制上述小鼠海马区的自噬水平。见图5。
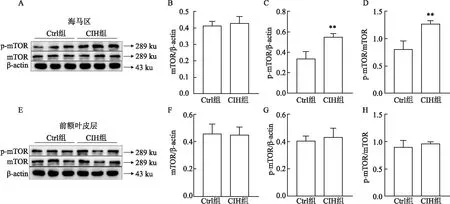
图5 CIH对mTOR-自噬途径蛋白水平的影响
3 讨论
本研究发现,CIH 8周后,小鼠出现焦虑抑郁样行为。Western blot 结果提示CIH组小鼠海马区NLRP3、p-mTOR增加,Atg7降低,由此推测,CIH通过激活mTOR磷酸化,从而抑制自噬水平,导致NLRP3累积增加,最终引起海马区损伤,出现焦虑抑郁样行为。这可能在一定程度上解释OSAHS患者罹患焦虑抑郁症的机制,为临床防治提供基础研究理论。
抑郁症是一种以心境低落为核心的情感障碍,可有焦虑、精力减退等多方面表现。研究[7]表明,OSAHS患者的焦虑抑郁症状患病率远高于非OSAHS人群,长期焦虑抑郁会导致睡眠质量不佳等,加重OSAHS症状,形成恶性循环。
目前焦虑、抑郁的发病机制假说主要包括炎症假说、细胞自噬假说等。炎症假说指出过度激活的炎症反应在抑郁症的发生发展中具有重要作用[8]。神经炎症是对组织损伤的一种先天免疫反应,在许多中枢神经系统疾病中发挥重要作用,其特点是小胶质细胞的激活,伴炎症因子和趋化因子水平的升高[9]。炎性小体是先天免疫反应的重要组成部分,参与炎症相关神经疾病的发生与发展[10],而NLRP3作为一种目前研究比较深入的炎性小体,由NLRP3蛋白、凋亡相关斑点样蛋白和Caspase-1组成,可被多种外源性及内源性刺激激活,如感染、损伤、代谢产物等。应激状态下,免疫细胞被激活,凋亡相关斑点样蛋白由胞核移位到胞浆,招募并活化Caspase-1前体蛋白,活化的Caspase-1能够促进pro-IL-1β、pro-IL-18的成熟活化并释放到胞外,引发炎症反应[11]。 炎症反应的发生又会进一步激活NLRP3,如此循环反复,进一步加重炎症反应,最终引起组织损伤,诱发疾病。另外,研究[12]表明,抑郁状态下海马区NLRP3水平呈过度激活状态,而敲除NLRP3基因的小鼠,在慢性刺激下不会出现抑郁样行为。本研究中,小鼠在CIH 8周后出现明显的焦虑和抑郁样行为,Western blot结果提示CIH组小鼠海马区NLRP3显著升高。这可能是由于CIH作为一种损害信号,能够激活NLRP3,最终驱动炎症反应的发生。而中枢神经系统中NLRP3主要表达于小胶质细胞[13],其过度激活,诱导产生神经炎症,最终引起海马区损伤。
自噬是真核细胞通过溶酶体途径降解和再利用细胞质成分的过程,是细胞自我保护的重要机制。自噬受多种信号分子的调控,mTOR是其中最重要的信号分子之一,是自噬的负调节因子,在正常生理条件下,磷酸化mTOR能够抑制细胞自噬[14]。机体处于稳态时,自噬处于低水平状态,但是在神经元中自噬处于活跃状态,有利于维持神经元的结构、功能、存活。有研究[15]表明,抑制神经元自噬水平,其存活率下降。本研究中,Western blot结果提示CIH 8周后,小鼠海马区p-mTOR水平增加,Atg7水平降低,提示CIH可通过激活mTOR,诱导其磷酸化,产生p-mTOR,最终抑制海马区自噬水平,从而引起海马区神经元的损伤。
本研究结果表明,CIH 8周后,小鼠海马区NLRP3、p-mTOR水平增加,Atg7水平降低,可能是由于CIH激活mTOR,抑制小鼠海马区自噬水平,导致神经炎症介质累积,NLRP3水平升高,引起海马区损伤。
综上所述,CIH通过激活mTOR抑制海马区自噬水平并累积过量的NLRP3,最终引起海马区损伤,出现焦虑和抑郁样行为。因此,提高海马区自噬水平及降低海马区NLRP3水平可能成为防治OSAHS患者出现焦虑及抑郁症状的新靶点。
