阿格列汀通过miR-497-5p/GPLD1信号通路抑制高糖诱导的心肌成纤维细胞纤维化的研究
2022-09-21杨俊静赵艳荣
常 杨,杨俊静,赵艳荣
(河北省秦皇岛市第二医院血液内分泌科,河北 秦皇岛 066600)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是由糖尿病引起的一种可导致心力衰竭的心肌病,主要病理特征为心肌纤维化引起的系列心功能不全[1]。糖尿病患者发生心力衰竭的概率在16%~29%,其病死率呈逐年上升趋势[2]。因为DCM的病理生理机制并未完全清楚,针对该病缺少有效的靶向药物。格列汀类药物是目前针对该病的一类临床高效治疗药物,阿格列汀是其中一种新开发的药物,2012年在日本被批准用于患者[3]。阿格列汀是一种氨基酸酰胺,对二肽基肽酶4(dipeptidyl peptidase 4,DPP-4)具有长期有效的抑制作用。DPP-4抑制剂通过增强β细胞的胰岛素分泌,抑制肠促胰岛素激素的降解,降低高血糖[4]。据报道,阿格列汀通过抑制DPP-4对核因子κB(nuclear factor κB,NF-κB)的激活,发挥对巨噬细胞、脂肪细胞和小鼠肝脏的抗炎活性[5]。但是其对DCM患者心肌纤维化的过程是否具有调控作用,及其发挥作用的机制均尚未有人研究。微小核糖核苷酸(microribonucleotide,miRNA)是长度在18~25个核苷酸之间的内源性保守稳定的单链非编码RNA,其通过阻滞靶基因的转录或翻译过程抑制靶基因表达而参与人类疾病的调控[6]。miR-497-5p是最近新发现的一种参与DCM发展的关键miRNA[7],但是其是否与阿格列汀的治疗功能有关尚未可知。本研究拟以高糖诱导的心肌成纤维细胞MCFs为研究对象,观察阿格列汀、miR-497-5p对MCFs细胞纤维化的作用,揭示阿格列汀通过上调miR-497-5p抑制其靶基因糖基磷脂酰肌醇特异性磷脂酶D(glycosylphosphatidylinositol specific phospholipase D,GPLD1)发挥抗纤维化的功效,为阿格列汀的临床推广提供依据。
1 材料与方法
1.1材料 小鼠心肌成纤维细胞(mouse cardiac fibroblasts,MCFs)购自北京北纳生物公司;RPMI-1640购自美国Gibco公司;胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司;阿格列汀(国药准字:H20130548;生产批号:121105)购自日本武田公司;RIPA裂解液购自(碧云天生物技术有限公司);兔抗α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)单克隆抗体、兔抗胶原Ⅰ(collagenⅠ,ColⅠ)多克隆抗体、兔抗ColⅢ单克隆抗体、辣根过氧化物酶标记的二抗均购自上海艾博抗公司;RT-qPCR试剂盒购自日本Takera公司;双荧光素酶报告基因检测试剂盒购自上海碧云天研究所。
1.2方法
1.2.1细胞的培养 使用90%的RPMI-1640+10%的FBS细胞培养液培养MCFs细胞,置于37 ℃、5% CO2的饱和湿度恒温培养箱培养。每2 d更换一次培养液。
1.2.2分组与处理 正常培养的MCFs细胞随机分为NG组(5.50 mmol/L葡萄糖)、HG组(25.00 mmol/L葡萄糖),使用5.50、25.00 mmol/L的葡萄糖培养MCFs。将HG组细胞分为阿格列汀低剂量(0.05 μmol/L)组、阿格列汀中剂量(0.10 μmol/L)组、阿格列汀高剂量(0.20 μmol/L)组,筛选0.10 μmol/L阿格列汀处理6 h的HG组细胞标记为阿格列汀最适浓度。使用LipofectamineTM3000将mimics-NC组(转染mimics-NC)、miR-497-5p组(转染miR-497-5p)、anti-NC组(转染anti-NC)、anti-miR-497-5p组(转染anti-miR-497-5p)、si-NC组(转染si-NC)、si-GPLD1组(转染si-GPLD1)、阿格列汀+mimics-NC组(转染mimics-NC)、阿格列汀+miR-497-5p组(转染miR-497-5p)、阿格列汀+miR-497-5p+pcDNA组(共转染miR-497-5p和pcDNA)、阿格列汀+miR-497-5p+pcDNA-GPLD1组(共转染miR-497-5p和pcDNA-GPLD1)转染至MCFs细胞,转染12 h后更换新培养液,再用25.00 mmol/L葡萄糖(处理48 h)或0.10 μmol/L的阿格列汀(处理6 h)培养。RT-qPCR法鉴定转染的效率,确定转染成功后再进行后续实验。
1.2.3WB实验 收集需要检测的各组细胞,将细胞使用RIPA裂解液冰上充分裂解30 min。提取总蛋白,定量变性。使用变性后的上清液进行SDS-PAGE蛋白电泳,将蛋白沉积在琼脂凝胶上。通过转膜仪将胶上的蛋白转移到PVDF膜,整个转膜过程需在0 ℃低温环境下操作完成。转膜结束后将膜用2.5%的脱脂奶粉37 ℃封闭2 h。封闭结束后,洗膜,转移至稀释过的一抗溶液(兔抗α-SMA单克隆抗体1∶1 000、兔抗ColⅠ多克隆抗体1∶800、兔抗ColⅢ单克隆抗体1∶1 000)中,4 ℃冰箱中孵育过夜。取出膜充分清洗,再转移至稀释过的二抗溶液(辣根过氧化物酶标记的山羊抗兔1∶500)中,37 ℃孵育1.5 h。结束后使用ECL电化学发光试剂盒对膜显影、定影。Image J分析条带灰度值,确定目的蛋白的相对表达量。
1.2.4RT-qPCR实验 收集待检测的各组细胞,使用Trizol液提取细胞的总RNA,并用反转录试剂盒将其合成cDNA,作为模板。使用qPCR试剂盒检测上述cDNA中miR-497-5p、GPLD1的表达。以U6、GAPDH为内参,2-△△Ct法计算miR-497-5p、GPLD1的相对表达量。反应程序为95 ℃,8 min;95 ℃,30 min;59 ℃,30 s;72 ℃,30 s;72 ℃,5 min,41个循环。引物序列为(5′-3′):miR-497-5p:上游引物:CCTTCAGCAGCACACTGTGG下游引物:CAGTGCAGGGTCCGAGGTAT。GPLD1:上游引物:GGTGGGCTCCGAGCAT;下游引物:GCACCTTTGTAGGTGAGCAG。U6:上游引物:CTCGCTTCGGCAGCACA;下游引物:AACGCTTCACGAATTTGCGT。GAPDH:上游引物:TGACTTCAACAGCGACACCCA;下游引物:CACCCTGTTGCTGTAGCCAAA。
1.2.5双荧光素酶报告基因检测实验 使用生物信息在线预测网站Starbase(http://starbase.sysu.edu.cn)预测miR-497-5p的靶基因,发现GPLD1与miR-497-5p存在结合位点。构建含有GPLD1-WT(含GPLD1 3′UTR-WT)和GPLD1-MUT(含GPLD1 3′UTR-MUT)的psiCHECK2荧光报告载体,将其分别与miR-NC、miR-497-5p、anti-miR-NC、anti-miR-497-5p共转染。使用双荧光素酶报告基因检测试剂盒检测上述细胞的荧光活性。
1.3统计学方法 应用SPSS 22.1统计软件分析数据。计量资料比较使用单因素方差分析、SNK-q检验、t检验。P<0.05为差异有统计学意义。
2 结 果
2.1阿格列汀对高糖诱导MCFs纤维化的调控 与NG组相比,HG组MCFs中α-SMA、ColⅠ和ColⅢ的蛋白表达均显著升高(P<0.05);与HG组相比,阿格列汀中剂量组、阿格列汀高剂量组细胞中α-SMA、ColⅠ和ColⅢ的蛋白表达均显著降低(P<0.05)。见表1,图1。

图1 不同浓度阿格列汀处理的高糖诱导MCFs纤维化标志的蛋白图

表1 不同浓度阿格列汀处理的高糖诱导MCFs纤维化标志的表达
2.2阿格列汀对高糖诱导MCFs细胞miR-497-5p表达的调控 与NG组相比,HG组MCFsmiR-497-5p表达显著降低(P<0.05);与HG组相比,阿格列汀中剂量组、阿格列汀高剂量组miR-497-5p表达显著升高(P<0.05),见表2。

表2 阿格列汀调节高糖诱导的MCFs细胞中miR-497-5p表达
2.3过表达miR-497-5p调控高糖诱导MCFs细胞纤维化 与mimics-NC组相比,miR-497-5p组细胞中miR-497-5p表达显著升高,α-SMA、ColⅠ和ColⅢ的蛋白表达均显著降低,差异有统计学意义(P<0.05),见表3,图2。

表3 过表达miR-497-5p的高糖诱导MCFs细胞的纤维化标志的表达
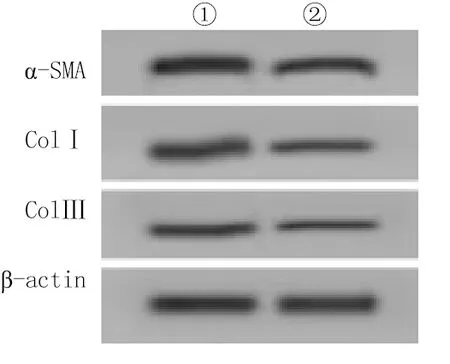
图2 过表达miR-497-5p的高糖诱导MCFs细胞纤维化标志蛋白图
2.4miR-497-5p靶向GPLD1 Starbase软件(http://starbase.sysu.edu.cn)预测到miR-497-5p与GPLD1之间存在连续的7个互补的核苷酸序列,见图3A。双荧光素酶报告实验显示,与mimics-NC组相比,miR-497-5p组GPLD1-WT细胞的荧光活性显著降低,差异有统计学意义(P<0.05),见表4;与mimics-NC组相比,miR-497-5p组细胞GPLD1蛋白表达显著降低(P<0.05),与anti-NC组相比,anti-miR-497-5p组细胞GPLD1蛋白表达显著升高,差异有统计学意义(P<0.05),见图3B,表5。

表4 双荧光素酶报告实验结果
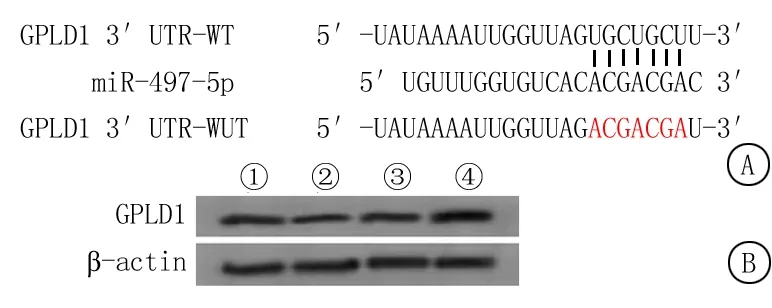
图3 miR-497-5p调控GPLD1

表5 miR-497-5p负向调控GPLD1表达
2.5敲减GPLD1调控高糖诱导MCFs细胞的纤维化 与si-NC组相比,si-GPLD1组细胞GPLD1表达显著降低,α-SMA、ColⅠ和ColⅢ的蛋白表达均显著降低,差异有统计学意义(P<0.05)。见表6,图4。

图4 敲减GPLD1的高糖诱导MCFs细胞的纤维化标志的蛋白图

表6 敲减GPLD1的高糖诱导MCFs细胞的纤维化指标
2.6过表达GPLD1对阿格列汀、miR-497-5p抑制高糖诱导MCFs细胞纤维化的影响 与阿格列汀+mimics-NC组相比,阿格列汀+miR-497-5p组细胞miR-497-5p表达显著升高,α-SMA、ColⅠ和ColⅢ的蛋白表达均显著降低,差异有统计学意义(P<0.05);与阿格列汀+miR-497-5p+pcDNA组相比,阿格列汀+miR-497-5p+pcDNA-GPLD1组细胞中miR-497-5p表达显著降低,α-SMA、ColⅠ和ColⅢ的蛋白表达均显著升高,差异有统计学意义(P<0.05)。见表7,图5。

表7 过表达GPLD1调节阿格列汀、miR-497-5p处理的高糖诱导MCFs细胞纤维化标志蛋白

图5 过表达GPLD1调节阿格列汀、miR-497-5p处理的高糖诱导MCFs细胞纤维化标志蛋白的表达
3 讨 论
DPP-4抑制剂也称格列汀类药物,已通过直接给药或与其他降糖药物联合用药的方式广泛用于临床治疗2型糖尿病(type 2 diabetes,T2DM)[8],但其在DCM中作用的分子机制仍不清楚。Soare等[9]报道,在系统性硬化症患者的纤维化皮肤中,DPP-4的表达和DPP-4阳性成纤维细胞的数量以转化生长因子β(transforming growth factor beta,TGF-β)依赖的方式增加,DPP-4的过度表达促进了成纤维细胞的激活,而DPP-4的药物抑制或基因失活可通过干扰TGF-β诱导的细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号活性而减少成纤维细胞的增殖、迁移及胶原的分泌,揭示DPP-4抑制剂可发挥有效的抗纤维化作用。Ma等[10]在DCM的研究中报道,H9C2细胞的缺氧处理可诱导DPP-4的异常升高,而DPP-4抑制剂阿格列汀能够明显的抑制缺氧诱导的细胞毒性和促炎因子白细胞介素(interleukin,IL)-6、单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)的分泌及氧化应激反应,揭示阿格列汀具有降低血糖、保护心肌细胞的双重功能。高糖环境下,心肌过度表达蛋白激酶C,钙调节异常,最先出现左心室肥厚,舒缩功能障碍,导致心肌坏死和多发性纤维变性[11]。于是,推测阿格列汀能够抑制DCM心肌纤维化。为了探究阿格列汀对DCM心肌纤维化的作用,本研究检测了不同浓度阿格列汀处理的高糖诱导MCFs细胞的纤维化标志基因α-SMA、ColⅠ和ColⅢ的蛋白表达发现,中高浓度的阿格列汀(0.10、0.20 μmol/L)能够明显的抑制高糖诱导MCFs细胞α-SMA、ColⅠ和ColⅢ蛋白表达的升高。此结果揭示了阿格列汀还具有抑制DCM心肌纤维化的功能,暗示阿格列汀的临床治疗价值。本实验还发现,阿格列汀能够明显的升高miR-497-5p在高糖诱导的MCFs细胞中的表达水平,猜测miR-497-5p表达的升高可能与阿格列汀的抑制DCM心肌纤维化有关。
miR-497-5p位于17号染色体,通过调节SMAD家族成员3、TGF-β1参与心肌纤维化过程[12-14]。Chen等[7]在DCM的研究中报道,miR-497-5p作为长非编码RNA X-非活性特异转录物(X inactive specific transcription factor,XIST)的特异性结合因子调控糖基化终末产物(advanced glycation end products,AGEs)/晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)信号通路的活性进而参与DCM的心脏损伤过程。近期,Wang等[15]在研究中报道,miR-497在糖尿病肾病组织、高糖诱导的人肾皮质近曲小管上皮细胞HK-2中的表达均显著降低,并且高表达的硫氧还蛋白互作蛋白(thioredoxin-interactingprotein,TXNIP)能够结合miR-497,过表达miR-497可明显的抑制高糖诱导的HK-2细胞乳酸脱氢酶(lactate dehydrogenase,LDH)漏出、TXNIP/核苷酸结合寡聚结构域,富含亮氨酸重复序列和含Pyrin结构域3(Nucleotide-binding oligomerization domain, leucine-rich repeat and pyrin domain-containing 3,NLRP3)/含半胱氨酸的天冬氨酸 蛋白水解酶1(cysteinyl aspartate specific proteinase1,caspase-1)激活以及IL-1β和IL-18分泌的升高,说明miR-497在糖尿病治疗中发挥积极的有利功效。本研究结果显示,miR-497-5p在高糖诱导的MCFs细胞中表达下调,并且过表达miR-497-5p能够显著的抑制高糖对MCFs细胞中α-SMA、ColⅠ和ColⅢ蛋白表达的促进作用。重要的是,研究还通过双荧光素酶报告基因检测实验发现miR-497-5p能够直接靶向负调控GPLD1的表达水平,这可能与miR-497-5p的抑制高糖诱导MCFs细胞的纤维化功能存在一定联系。
GPLD1基因位于6号染色体上,由25个外显子组成,曾被指定为胰腺型,是人类唯一的GPLD1基因,该基因失调与胰腺和胃部肿瘤恶化相关[16]。GPLD1与胰岛之间的密切关系可能是DCM纤维化的原因之一。Qin等[17]报道,GPLD1在成人潜伏性自身免疫性糖尿病(latent autoimmune diabetes in adults,LADA)、1型糖尿病(type 1 diabetes,T1DM)患者血浆中的表达显著高于正常人、T2DM患者,受试者工作特征曲线(receiver operating characteristic curve,ROC)分析揭示GPLD1可作为诊断LADA和T2DM的潜在候选血浆蛋白。Zhang等[18]发现,高胰岛素血症、糖耐量减低和T2DM患者血清中脂肪组织胰岛素抵抗相关的磷脂酰肌醇蛋白聚糖4(glypican,GPC4)含量明显升高,而GPLD1是GPC4的关键因子,与GPC4的含量呈正相关。于是猜测,GPLD1可能也与DCM存在联系,进而接受阿格列汀、miR-497-5p的调控。本研究检测了敲减GPLD1的高糖诱导MCFs细胞的纤维化指标发现,敲减GPLD1具有与过表达miR-497-5p相似的抑制α-SMA、ColⅠ和ColⅢ蛋白表达的作用。过表达GPLD1能够明显的削弱阿格列汀和过表达miR-497-5p对α-SMA、ColⅠ、ColⅢ蛋白表达的抑制作用,说明过表达GPLD1可逆转阿格列汀或过表达miR-497-5p高糖诱导MCFs细胞纤维化的抑制作用。
综上所述,阿格列汀抑制高糖诱导的心肌成纤维细胞的纤维化,产生这种作用的机制与促进miR-497-5p进而抑制GPLD1表达紧密相关,为阿格列汀治疗糖尿病心肌病提供支持。
