叶类蔬菜中单核细胞增生李斯特氏菌PCR快速检测方法的建立
2022-09-21李晓然张若鸿尹树仁王晓芳崔生辉郭云昌
李晓然 张若鸿 王 纯 尹树仁 王晓芳 杨 洋,* 崔生辉 郭云昌
(1 河北科技师范学院食品科技学院,河北 秦皇岛 066600;2 中国食品药品检定研究院,北京 100050;3 国家食品安全风险评估中心,北京 100022)
叶类蔬菜富含膳食纤维、维生素和矿物质,有益于人体健康。然而,随着叶类蔬菜消费量的增加,相关食源性致病菌引发的食源性疾病暴发也随之增加,对公共健康造成了严重危害[1-2]。单核细胞增生李斯特氏菌(Listeriamonocytogenes)是一种常见的侵袭性食源性致病细菌。人体被该菌感染后易引发败血症和脑膜炎等侵袭性疾病,病死率较高(20%~30%)[3-4]。目前国外叶类蔬菜中该菌引发的李斯特菌病暴发数量逐渐攀升,国内也存在散发事件,且该趋势仍在持续[5-6],因此急需建立一种快速可靠的单核细胞增生李斯特氏菌检测方法,以确保叶类蔬菜的质量安全,为公共卫生安全提供保障。
传统的基于细菌培养的检测方法被认为是“金标准”,可靠准确但耗时耗力(5~7 d)[7]。为克服传统方法的局限性,目前已开发多种食源性致病菌快速检测方法,其中酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)技术虽操作简便,但需目标菌与抗体进行有效的物理接触(灵敏度较低),且易受免疫原性的干扰[8]。光学/电化学生物传感器和基因芯片技术具有高通量优势,但检测成本昂贵,对设备和操作人员技能要求较高[9-10]。聚合酶链式反应(polymerase chain reaction,PCR)虽已成为食源性致病菌检测发展最成熟的技术[11],但PCR方法通常需要样品前增菌处理来抑制背景微生物生长,也以提高检测精确度。研究发现,叶类蔬菜基质中存在多个PCR反应抑制因子,如多糖、酚类化合物和叶绿素等[12-13]。β-环糊精(β-cyclodextrin,β-CD)是由7个葡萄糖单体连接成的中空截短圆锥形结构的葡萄糖低聚物,其分子内部疏水,外部亲水[14]。叶类蔬菜表面的PCR抑制因子如蜡质物(疏水性化合物)可被捕获到其内部,使存在于疏水性基质中的细菌被分离到水相中[2]。活性炭是一种具有极强吸附能力、较大表面积的多孔物质[12]。有研究表明,表面未包被的活性炭可吸附细菌细胞和PCR抑制因子,而牛乳蛋白包被的活性炭不会与细菌细胞结合,并保留大部分吸附能力(吸附PCR抑制因子)[12]。此外,iap基因(编码单核细胞增生李斯特氏菌的侵袭性相关蛋白)在整个菌种中具有高度保守性,并且是PCR方法中常用目标基因之一[15-16]。而一些研究人员提出的目标基因在一些菌株中存在缺失/突变现象,如LIPI-1的prfA、mpl和LIPI-2的inlA[3,17]。因此,本研究利用β-CD和牛乳蛋白包被活性炭对样品进行前处理,以消除叶类蔬菜中的PCR抑制因子,并使用基于iap基因的引物,旨在开发一种快速、灵敏、无需前增菌的单核细胞增生李斯特氏菌PCR检测方法,为叶类蔬菜的质量安全提供有力保障,并为进一步预防食源性李斯特氏菌病暴发、提升我国食源性疾病预警效率做出贡献。
1 材料与方法
1.1 试验菌株
本研究所用菌株共计141株(表1),来自美国模式菌种保藏中心(American Type Culture Collection,ATCC)。以无菌操作,用无菌棉签从平板上取本研究所用菌株的新鲜纯培养菌落,转移到含脑心浸液(brain heart infusion,BHI)肉汤和20%甘油的冷冻储藏管中,混匀,储存在-80℃的冰箱中。
菌株培养:将李斯特氏菌菌株接种在BHI琼脂培养基中培养(18 h,37℃);微需氧条件(5%氧气)下,将结肠弯曲菌和空肠弯曲菌菌株接种在Bolton肉汤中培养(24 h,42℃);副溶血性弧菌菌株接种在含有3% NaCl的Luria-Bertani培养基中生长(18 h,37℃);其他菌株接种到Luria-Bertani培养基上生长(18 h,37℃)。
1.2 主要试剂与仪器
BHI肉汤、BHI琼脂、Bolton肉汤、李氏增菌肉汤(Listeriaenrichment broth,LB)、PALCAM培养基、科玛嘉李斯特菌显色培养基、TSA-YE培养基、革兰氏染色试剂盒、单核细胞增生李斯特氏菌生化鉴定试剂盒,北京陆桥技术股份有限公司;Luria-Bertani培养基,上海君瑞生物技术有限公司;β-CD,河北科隆多生物科技有限公司;婴幼儿脱脂乳粉,黑龙江飞鹤乳业有限公司;无水乙醇、氢氧化钠、乙酸、乙酸钠,上海阿拉丁生化科技股份有限公司;牛血清白蛋白、鲑鱼精DNA、10×PCR buffer、dNTPs mix(1 mmol·L-1)、基于iap基因和prfA基因的引物、TaqDNA聚合酶(5 U·μL-1)、TaqPCR Premix、100 bp DNA Ladder,宝生物工程(大连)有限公司;琼脂糖、0.5×三硼酸乙二胺四乙酸(Tris/Borate/EDTA,TBE)缓冲液,上海尚宝生物科技有限公司。
Bagmixer-400W均质器,法国Interscience公司;HYC-326A医用低温冰箱,青岛海尔特种电器有限公司;X3R高速离心机,美国Thermo公司;DF-101 S磁力搅拌器,青岛聚创环保集团有限公司;JUPT-III-10超纯水发生器,广州罡然机电设备有限公司;Personal Cycler PCR扩增仪,德国Biometra公司;DYY-11电泳仪,北京市六一仪器厂;Biospectrum 310凝胶成像系统,美国UVP公司。
1.3 试验方法
1.3.1 人工污染叶类蔬菜样品 叶类蔬菜(菠菜、生菜、油麦菜、油菜和大白菜)在被目标菌人工污染前于2℃保存24 h。然后修剪蔬菜以去除老化、受损的叶子。按1.1节,BHI培养单核细胞增生李斯特氏菌菌株ATCC 19111(18 h,37℃),使用无菌生理盐水将新鲜培养物10倍系列稀释(100~108)。按《GB 4789.30-2016食品安全国家标准食品微生物学检验: 单核细胞增生李斯特氏菌检验》[18]中的平板计数法,对稀释的菌悬液进行计数,以获取所需目标菌浓度(100~105CFU·mL-1)的菌悬液。在生物安全柜中分别将不同浓度的菌悬液均匀地接种在菠菜叶的正面与背面,每面滴20滴,每滴10 μL(其他叶类蔬菜的操作步骤相同)。接种完的菠菜鼓风干燥30 min,使液滴蒸发/吸附到菠菜叶表面。然后将其放入无菌未封口的塑料袋中(允许气体交换),保存在冰箱中(4℃过夜),确保目标菌有效附着在样品上。未接种目标菌的菠菜作为阴性对照。第二天,按标准GB 4789.30-2016[18]对样品进行计数,以确定目标菌浓度。将75 mL无菌生理盐水倒入有25 g菠菜叶(100~104CFU·25g-1)的均质袋中,230 r·min-1均质2 min。均质后样品用于灵敏度测试的样品前处理。
1.3.2 牛乳蛋白包被活性炭的制备 取婴幼儿脱脂乳粉(24.00、12.00、6.00、3.00、1.50、0.75、0.38 g)分别倒入盛有25 mL超纯水的400 mL烧杯中,磁力搅拌器中速搅拌至乳粉完全溶解(约2 min)。向每个烧杯中倒入50 mL 95%乙醇,中速磁力搅拌(2 min)以沉淀牛乳蛋白。将沉淀的每个牛乳蛋白转移至250 mL离心瓶中,室温(20~25℃)下离心(5 000 r·min-1)5 min。离心所得沉淀重悬于150 mL超纯水中,用0.1 mol·L-1氢氧化钠(sodium hydroxide,NaOH)调节pH值至9.0。
用筛子过筛活性炭(0.85~2.0 mm颗粒)。超纯水洗涤200 g活性炭3次,以除去杂质,并于55℃条件下干燥。分别将之前制备好的不同浓度牛乳蛋白液倒入烧杯,然后将44 g干燥的活性炭倒入其中。将烧杯置于恒温振荡培养箱中,37℃、150 r·min-1振荡2 h。倾倒上清液,用超纯水轻轻漂洗底层活性炭3次,以除去未结合的牛乳蛋白。将烧杯置于55℃培养箱中,直至牛乳蛋白包被活性炭完全干燥,以备用。
1.3.3 β-CD溶液处理样品 将8 g β-CD倒入有100 mL去离子水的500 mL无菌烧瓶中,搅拌加热直至β-CD完全溶解。使用前,将制备好的8% β-CD溶液冷却至55℃。为去除样品中的疏水性化合物(叶类蔬菜表面蜡质物),将8% β-CD溶液(100 mL)倒入各种样品(菠菜、生菜、油麦菜、油菜和大白菜)匀浆中,并使β-CD的最终浓度为5 g·100 mL-1。均质匀浆(230 r·min-1,2 min,37℃),随后将其转至250 mL离心瓶中,1 000 r·min-1离心5 min,以沉积大颗粒蔬菜组织和大多数β-CD复合物。所得上清液于10 000 r·min-1条件下离心10 min,所得沉淀重悬于30 mL 0.01 mol·L-1乙酸生理盐水缓冲液(0.85%氯化钠、乙酸、乙酸钠,pH值 5.0)中,用于牛乳蛋白包被活性炭处理。
1.3.4 牛乳蛋白包被活性炭处理样品 取1.3.2节制备好的4.6 g牛乳蛋白包被活性炭倒入烧杯中,用20 mL无菌生理盐水清洗两次,将其与之前β-CD溶液处理过的30 mL样品匀浆混合。混合物在室温下,160 r·min-1振荡15 min。将0.2 g无菌玻璃棉填入到50 mL无菌塑料注射器底部,上述混合物转至注射器内,用乙酸生理盐水缓冲液清洗,直至无菌离心管中收集到30 mL洗脱液。洗脱液于10 000 r·min-1条件下离心10 min,以沉淀细菌细胞,弃上清液保留沉淀,用于模板DNA制备。
1.3.5 模板DNA制备 将含细菌细胞的沉淀物重悬于总混合体系0.5 mL的离心管中,该混合体系包含50 μL(5 mg·mL-1)牛血清白蛋白(bovine serum albumin,BSA)、50 μL(0.05 mg·mL-1)鲑鱼精脱氧核糖核酸(deoxyribonucleic acid,DNA)和300 μL超纯水。将离心管沸水浴10 min,以裂解细菌细胞。裂解液在冰上冷却至室温,离心(12 000 r·min-1,5 min)。上清液小心转移至新的无菌离心管中,加入等体积冷却的无水乙醇以沉淀DNA,离心(12 000 r·min-1,15 min)。弃上清液,然后加100 μL无菌去离子水溶解沉淀的DNA。DNA样品分装,每份10 μL,用于PCR检测。
1.3.6 PCR反应体系的建立 本方法使用的基于目标菌iap基因的特异性引物(序列01:5′-A C A A G C T G C A C C T G T T G C AG-3′,02:5′-T G A C A G C G T G T G T A G T A G CA-3′),由宝生物工程(大连)有限公司合成,目标扩增产物为131 bp。已发表的基于目标菌prfA基因的引物(01:5′-C C C A A G T A G C A G G A C A T G C T AA-3′,02:5′-G G T A T C A C A A A G C T C A C G AG-3′)作为对照[19]。
基于iap基因引物的50 μL PCR反应体系包含:10×PCR buffer 5 μL、1 mmol·L-1脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)mix 4 μL、40 μmol·L-1正反向引物各0.5 μL、5 U·μL-1TaqDNA聚合酶0.25 μL、模板DNA 1 μL、无菌超纯水38.75 μL。基于prfA基因引物的50 μL PCR反应体系包含:TaqPCR Premix 25 μL、20 μmol·L-1正反向引物各1 μL、模板DNA 1 μL、超纯水22 μL。PCR反应条件:94℃预变性4 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,循环30次(基于prfA基因的引物循环25次);72℃终延伸7 min(基于prfA基因的引物终延伸6 min)。凝胶电泳前,将样品于4℃保存。所有PCR试验都有无菌超纯水代替模板DNA的阴性对照。目标菌菌株ATCC 19111的纯培养物菌悬液(1 μL,104CFU·mL-1)作为阳性对照。所得PCR产物在0.5×TBE缓冲液体系中的2%琼脂糖凝胶上,恒压100 V电泳1 h,然后用凝胶成像系统观察结果。
1.3.7 引物特异性测试 141株细菌菌株包括78株单核细胞增生李斯特氏菌、29株其他李斯特氏菌、34株非李斯特氏菌(其他常见致病菌)。菌株按1.1节进行培养,所得新鲜培养物按1.3.5节方法制备模板DNA。然后分别用包含iap和prfA引物的PCR反应体系(1.3.6)对模板DNA进行检测。通过检验引物在这些菌株中辨别目标菌与非目标菌的能力,从而验证特异性。
1.3.8 方法灵敏度测试 为确定本方法在人工染菌叶类蔬菜中的灵敏度,将目标菌株ATCC 19111的10倍系列稀释液人工污染每25 g菠菜叶,以获取所需目标菌浓度的菠菜叶样品(100~104CFU·25g-1),其他叶类蔬菜按1.3.1进行相同的操作。所得样品均质液按本方法进行样品前处理,按1.3.5制备模板DNA,每1 μL模板DNA悬液用于PCR。随后PCR产物进行凝胶电泳,凝胶成像系统观察结果,以确定检测限。每个包含独立制备样品(染菌浓度100~104CFU·25 g-1的每种叶类蔬菜)的试验重复10次。
1.3.9 方法实用性测试 为评估本方法的实用性,对蔬菜种植基地采集的2 500份叶类蔬菜样品(新鲜菠菜、生菜、油麦菜、油菜和大白菜各500份)中的目标菌进行检测。同时使用标准GB 4789.30-2016[18]做检测对比。
1.3.10 方法所用主要试剂的测试 为确定本方法所用主要试剂的稳定性(保质期),对本方法的灵敏度和实用性进行评估。试剂[0.1 mol·L-1NaOH、0.01 mol·L-1乙酸生理盐水缓冲液、8% β-CD溶液、牛乳蛋白包被活性炭、BSA(5 mg·mL-1)、鲑鱼精DNA(0.05 mg·mL-1)、40 μmol·L-1正向引物和反向引物(基于iap基因)、TaqDNA聚合酶(5 U·μL-1)]在测试前均置于-20℃冰箱。分别用保存了3、6、12个月的试剂,按本方法对人工染菌叶类蔬菜样品(菠菜、生菜、油麦菜、油菜和大白菜)进行检测,以确定本方法的灵敏度。不同人工染菌浓度(100~104CFU·25g-1)的每种蔬菜样品试验重复5次。为评估本方法的实用性,分别按本方法(分别使用保存了3、6、12个月的试剂)和标准GB 4789.30-2016[18]对蔬菜种植基地采集的样品(5种叶类蔬菜,各300份)进行目标菌检测。
2 结果与分析
2.1 本方法的特异性
由表1可知,基于prfA基因的引物对6株目标菌株(NCT 0890、ATCC 7645、ATCC BAA-348、ATCC 51781、ATCC BAA-2657和ATCC 19115 D-5)的检测出现了假阴性结果、对2株非目标菌菌株(伊氏李斯特氏菌ATCC 700402、伊氏李斯特氏菌BAA-753)的检测出现了假阳性结果。相比之下,本方法使用的基于iap基因的引物能够正确识别所有菌株,未出现假阳性或假阴性结果,并且在这些菌种中未检测到非特异性扩增子。因此本方法的iap引物序列对单核细胞增生李斯特氏菌的检测具有良好的特异性,PCR检测的特异性为100%。

表1(续)
2.2 本方法的灵敏度
根据试验条件优化结果,1.5 g乳粉所得牛乳蛋白包被44 g活性炭(表面包被的牛乳蛋白最多为0.45±0.08 g)处理样品的效果最好。由图1可知,当样品人工染菌浓度为101CFU·25g-1时,可见清晰条带(阳性结果),PCR扩增产物为131 bp,与预期结果相同。由表2可知,用本方法可检测到101CFU·25g-1样品中的目标菌,且在染菌浓度高于101CFU·25g-1的样品中也获得了相同的阳性结果。因此,本检测方法的检测限为101CFU·25g-1。

注:泳道1:100 bp DNA Ladder;泳道2:使用单核细胞增生李斯特氏菌ATCC 19111的 PCR阳性对照;泳道3:不含目标DNA的PCR阴性对照;泳道4~15:从人工染菌样品(101 CFU·25g-1)中扩增出的PCR产物;泳道4~6:菠菜样品;泳道7~8:生菜样品;泳道9~10:油菜样品; 泳道11~12:大白菜样品;泳道13~15:油麦菜样品。Note: Lane 1: 100 bp DNA Ladder. Lane 2: A PCR positive control that used L. monocytogenes ATCC 19111. Lane 3: A PCR negative control without target DNA. Lanes 4~15: PCR products amplified from 101 CFU·25g-1 of artificially contaminated samples. Lanes 4~6: Spinach samples. Lanes 7~8: Lettuce samples. Lanes 9~10: Cole samples. Lanes 11~12: Cabbage samples. Lanes 13~15: Lactuca sativa L. samples.图1 人工染菌样品(101 CFU·25g-1)的PCR扩增产物Fig.1 PCR amplification products of artificially contaminated samples (101 CFU·25g-1)
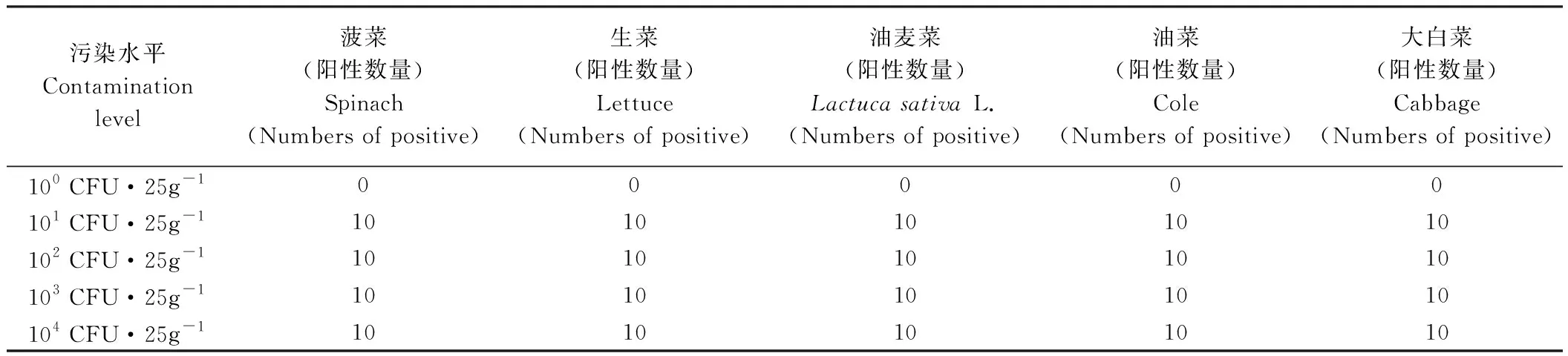
表2 用于检测人工染菌叶类蔬菜中单核细胞增生李斯特氏菌的所建立方法的灵敏度Table 2 The sensitivity of developed method used for the detection of L. monocytogenes in artificially contaminated leafy greens
2.3 本方法的实用性
由表3可知,本方法和国标法(GB 4789.30-2016)[18]中菠菜、生菜、油菜的检出率均分别为5%、3%、1%,其他叶类蔬菜中未检测到目标菌;菠菜、生菜、油菜中活菌检测率为100%,而其他种叶类蔬菜均为0%;两种方法检测结果的符合率为100%;与GB 4789.30-2016检测时间(6 d)相比,本快速检测方法仅用时4 h。综上,本方法能够准确地从叶类蔬菜中检测出目标菌(未出现假阳性/假阴性结果),可作为检测叶类蔬菜中单核细胞增生李斯特氏菌污染的快速可靠方法。
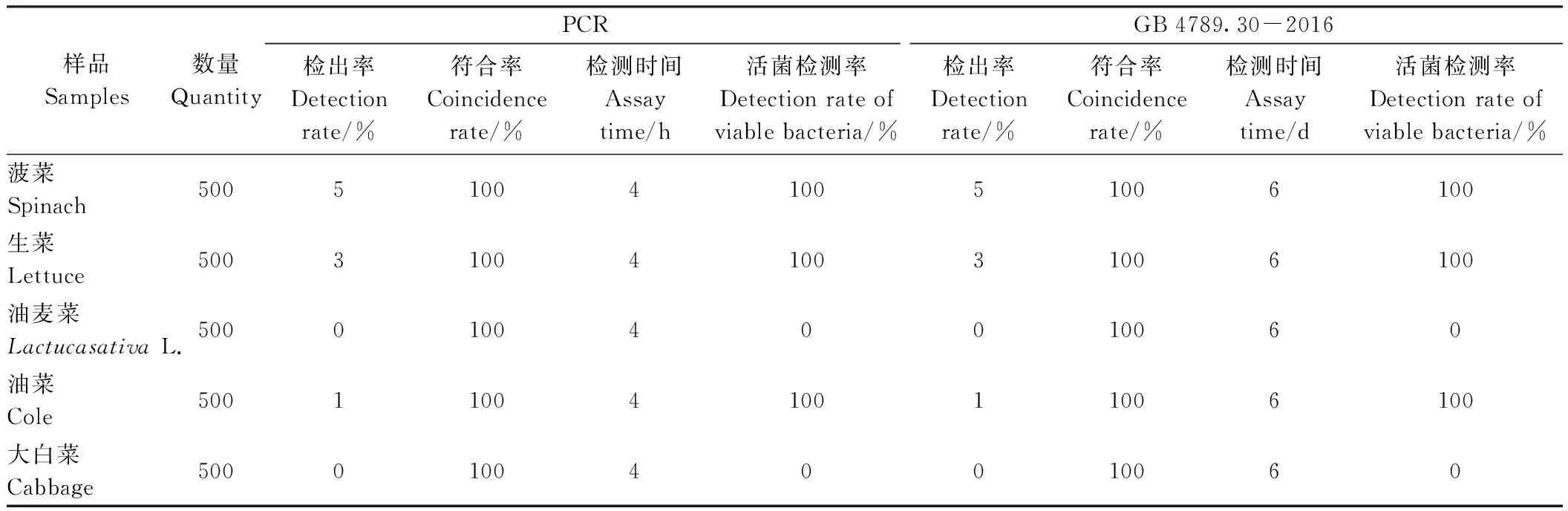
表3 本方法和常规培养方法对实际叶类蔬菜中单核细胞增生李斯特氏菌的检测Table 3 The detection of L. monocytogenes in natural leafy greens using the developed method and conventional culture method
2.4 本方法所用主要试剂的稳定性
分别用-20℃保存了3、6、12个月的试剂,按本方法检测染菌浓度101CFU·25g-1以下的叶类蔬菜样品后,均未检出目标菌;而分别用-20℃保存了3、6、12个月的试剂,按本方法检测染菌浓度101CFU·25g-1及以上的样品后,均检出目标菌,表明本方法的检测限仍为10 CFU·25g-1。
在试剂不同保存条件下,本试验建立的快速检测方法和国标法对实际叶类蔬菜样品的检测结果见表4。结果表明,使用保存了3、6、12个月的试剂,两种方法的目标菌检出率、活体菌检测率均一致(符合率100%),表明本方法所用主要试剂在规定保存条件、保存时间内使用,灵敏度和实用性稳定;试剂可在-20℃保存至少12个月后正常使用,在冷冻条件下具有良好的稳定性。
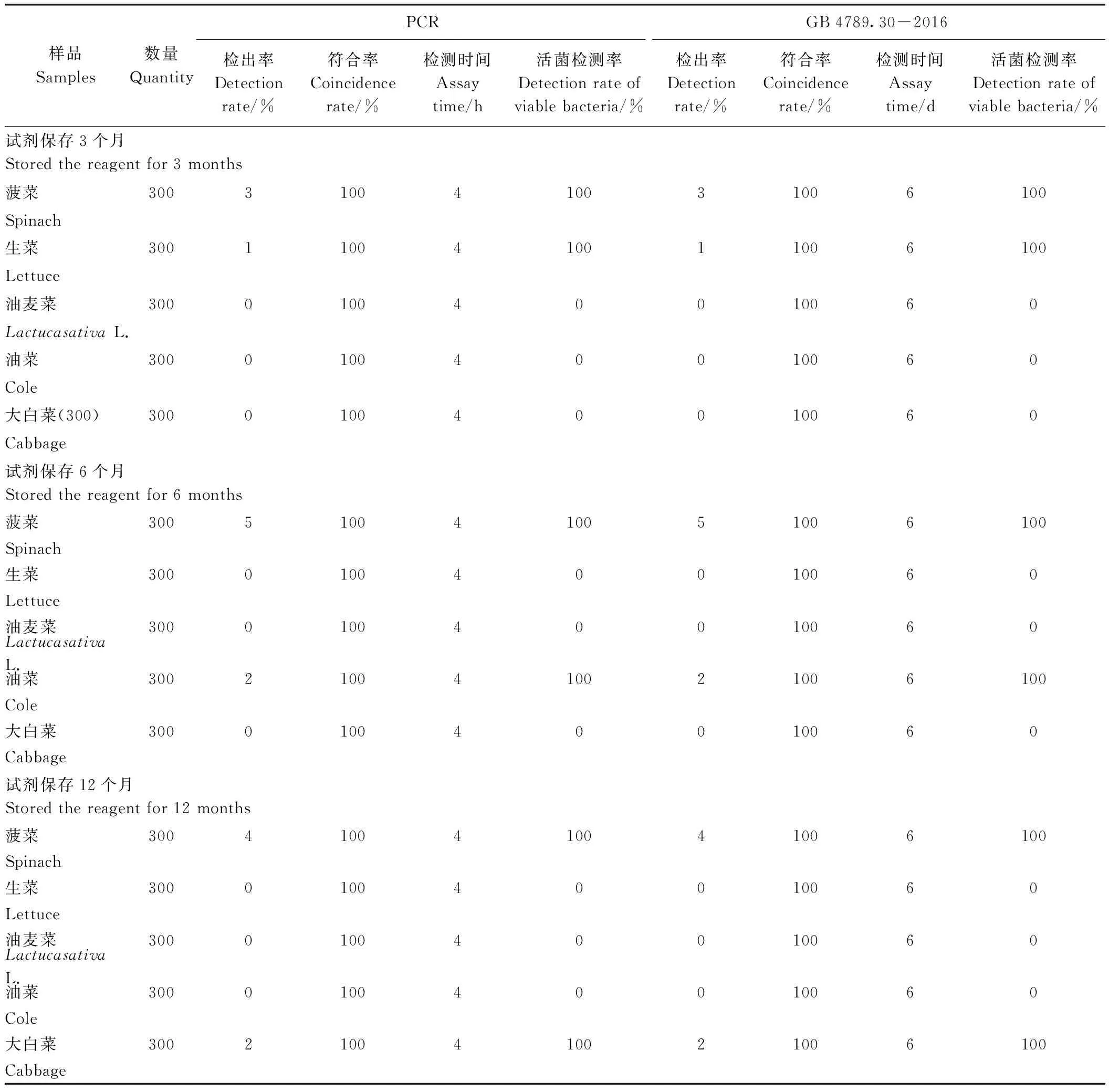
表4 本方法的试剂稳定性测试(实用性)Table 4 Reagent stability assay of the developed method (application)
3 讨论
食源性致病菌检测是评估叶类蔬菜微生物质量安全的重要举措之一,可为消费者健康提供切实保障。其中PCR已成功用于单核细胞增生李斯特氏菌的检测,是一种高效便利的分子方法[11]。然而,因样品中存在许多PCR抑制因子,会抑制目标DNA的特异性扩增并降低检测灵敏度[12,15]。因此,本研究基于β-CD和牛乳蛋白包被活性炭的样品前处理(可消除PCR抑制因子),建立无需前增菌的PCR快速检测方法具有重要意义。
综合比较前人的单核细胞增生李斯特氏菌检测方法研究[15-16],本方法中PCR的目标基因iap在目标菌种中具有高度保守性。而一些研究人员提出的目标基因(prfA、mpl、hlyA、inlA)在该菌一些菌株中存在缺失/突变现象,并且一些亲缘较近的非李斯特氏菌(金黄色葡萄球菌、蜡样芽孢杆菌等)中存在李斯特氏菌毒力基因同源物,可能会导致假阴性或假阳性结果[3,17]。此外,特异性测试需要充足数量的菌株来支撑,且应包含目标菌与其他相关菌种。尽管目前许多PCR方法中使用的引物特异性为100%,但其中一些研究仅用有限数量的标准菌株(4~33株)进行测试[13,20-21]。相比之下,本方法的iap引物序列测试的菌株多达141株(78株目标菌、63株非目标菌),特异性结果更准确、更有说服力。
因叶类蔬菜基质中存在多种会影响样品中目标菌回收并降低灵敏度的物质[12],提高检测方法的灵敏度是艰巨的挑战之一。本方法样品前处理中用到的牛乳蛋白包被活性炭可吸附叶类蔬菜中的叶绿素、酚类化合物、多糖等PCR抑制因子;而β-CD可捕获蔬菜表面蜡质物(疏水化合物),使叶表面的细菌细胞易被分离到水相中,以便目标菌回收。本方法可实现浓度低至10 CFU·25g-1的单核细胞增生李斯特氏菌超灵敏检测,且检测时间缩至4 h(无需前增菌)。与其他基于各种样品前处理的PCR方法相比,本方法检测限具有明显优势。如用于克服PCR抑制的前增菌步骤虽尽可能避免了假阴性结果,但耗时较长(12~18 h),且由于叶类蔬菜中单核细胞增生李斯特氏菌的含量通常较低,有时增菌后也未能检出该菌[13,22]。近年来,过滤和免疫磁性分离(immunomagnetic separation,IMS)常用于PCR方法中的前处理,可浓缩样品中的目标菌到可检测浓度[23-24]。值得一提的是,死菌中的DNA在细胞活力丧失后的多天内仍可作为PCR模板,可能导致假阳性结果,而本方法还不能区分死菌和活菌[25]。前人研究表明,基于过滤的方法可实现活菌的特异性检测。如Murakami[26]利用过滤前处理,8 h内在生菜中检测到1 CFU·g-1的单核细胞增生李斯特氏菌,比本研究的检测限低2.5倍;Garrido-Maestu等[21]在24 h内从鸡肉样品中获得了与本研究相近的检测限(9.5 CFU·25g-1)。但仍存在样品基质颗粒堵塞过滤器,影响目标菌分离的缺陷,且仍需几个小时的前增菌[5]。此外,一些基于IMS的PCR方法研究报道了相似的检测限[20,24]。然而,IMS存在抗体交叉反应风险,所制备的用于捕获目标菌的单克隆/多克隆抗体可能会与亲缘关系较近的非目标菌结合[27]。
本研究使用开发的检测方法,对基地采集的 2 500 份叶类蔬菜样品进行了测试,其中菠菜的单核细胞增生李斯特氏菌污染率最高(5%),其次是生菜(3%)和油菜(1%)。菠菜、生菜的污染率较高可能是因为用于作物生产的土壤常用动物粪便(肥料)进行改良,其中潜在含有致病菌,且靠近被污染土壤表面的菠菜和生菜叶表面积较大[2,28]。还有研究表明,灌溉水和雨水的水滴也会将土壤颗粒带到叶面上,导致污染[29]。此外,该菌的病死率较高(20%~30%),而某些易被该菌污染的叶类蔬菜(生菜、大白菜)却常被生食,这显然是李斯特菌病的潜在传播途径之一,应引起消费者和相关监管部门的关注[30]。总体上,本研究建立的快速、灵敏、特异的检测方法有助于更好地了解掌握叶类蔬菜中单核细胞增生李斯特氏菌的流行情况且无需前增菌,省时省力,能提供更多可重复性结果,有助于预防和降低单核细胞增生李斯特氏菌对公众健康造成的危害。
4 结论
本研究将β-CD和牛乳蛋白包被活性炭用于PCR样品前处理,无需前增菌,可在4 h内快速、灵敏、特异地检测叶类蔬菜中单核细胞增生李斯特氏菌。该方法操作简便,能克服叶类蔬菜复杂基质的干扰,可作为分析实验室的一个实用可靠的诊断工具。也可为叶类蔬菜的质量安全,消费者的健康提供切实保障,同时为食源性单核细胞增生李斯特氏菌的监测提供技术支持。
