芦蒿茎尖组织培养体系建立的研究
2022-09-21吴伟文高红胜
吴伟文,黄 晶,潘 军,成 雨,高红胜
(1 扬州大学现代园艺科技创新中心,江苏扬州 225001;2 南京鹂岛现代农业发展有限公司,江苏南京 210043;3 扬州大学,江苏扬州 225001)
芦蒿大多为野生,主要分布在长江中下游、东北、华北和中南等地区[11-13]。由于种子难以成熟,人工栽培芦蒿多以地下茎进行无性繁殖,连年种植,病毒感染,产量降低,品质下降,严重影响野生芦蒿产地的生态环境[14]。试验利用茎尖分生组织培养技术,通过研究芦蒿高效增殖和生根的理想植物生长调节剂配比和基本培养基种类,建立芦蒿高效再生体系,以实现芦蒿脱毒、种苗快速繁殖,为芦蒿的人工种植提供优质种苗,提高产量与品质。
1 材料与方法
1.1 材料
试验所需芦蒿均采自南京八卦洲,主要品种有青蒿、白蒿、红蒿以及江滩野生品种,移栽至扬州大学现代园艺产业研究院试验基地内,移栽成活后,选取生长旺盛的芦蒿嫩茎作为试验材料。
1.2 方法
1.2.1 外植体消毒。剪取3~5cm 长的嫩茎头,去除叶片,放进加入洗洁精的自来水中清洗,取出后用自来水流水冲洗。再用4%的次氯酸钠溶液消毒15min。随后将消毒好的芦蒿移至超净工作台上,用70%的酒精浸泡10s,之后立即用无菌水冲洗2~3次。再浸泡于滴加1~2 滴吐温20 的0.1%升汞溶液中消毒8~10min,再用无菌水冲洗5~6 次。在显微镜下挑取0.2~0.4mm 的茎尖培养。培养温度25℃,光照14h/d,光照强度1000~2000 Lx。
污染率(%)=污染茎尖数/接种茎尖数×100
褐化率(%)=褐化茎尖数/接种茎尖数×100
成活率(%)=诱导成活茎尖数/接种茎尖数×100
1.2.2 初代培养。将已消毒的芦蒿茎尖接种到添加不同浓度6-BA(0、0.05、0.5、1mg/L)和NAA(0、0.01、0.05、0.1mg/L)的MS 初代培养基(琼脂7g/L+蔗糖30g/L,pH值5.8)中,共15 组处理,标记为T1~T15,每组接种10瓶,重复3 次。接种30 d 后统计芦蒿茎尖诱导分化率。
诱导分化率(%)=萌发芽的茎尖数/接种茎尖数×100
1.2.3 增殖培养。配制6-BA 浓度分别为0.1、0.3、0.5、0.7、0.9mg/L 的增殖培养基,剥取初代培养后的芦蒿茎尖分别接种至增殖培养基(琼脂7g/L+蔗糖30g/L,pH值5.8)中,共5 组处理,标记为F1~F5,每组接种10 瓶,重复3 次。接种30d 后统计芦蒿茎尖增殖系数。
增殖系数=增殖数/原个体数
1.2.4 生根培养。选取生长情况良好的芦蒿无菌苗单株,将其分成茎头和茎段2 部分,去除茎段基部组织及根系,剪成2~3cm 长,将茎头和茎段分别接种至MS 和1/2 MS 生根培养基(NAA)中。接种时,务必使芦蒿形态学下端与培养基紧密接触,每瓶接种5~6 棵芦蒿外植体。每个处理接种10 瓶,重复3 次。接种30d 后观察芦蒿苗生根情况,统计生根数、生根率、生根时间、根长、根粗等指标。
2 结果与分析
2.1 6-BA 和NAA 不同浓度组合对芦蒿茎尖分化的影响

图1 芦蒿茎尖组织初代培养
由表1 可知,芦蒿茎尖在只添加6-BA 的情况下,在浓度0.05~1.0mg/L 范围内均能分化,且茎尖分化率均高,但是新芽密集度高,并不伸长;在只添加NAA 的情况下,低浓度的NAA 其效果较好,浓度越高,芦蒿茎尖分化率越低,甚至不萌发或者死亡;在6-BA 和NAA不同浓度组合的处理中,处理T10(6-BA 0.5mg/L+NAA 0.01mg/L)效果最好,芦蒿茎尖分化形成密集芽丛,并有芽伸长,芽丛颜色转深绿。
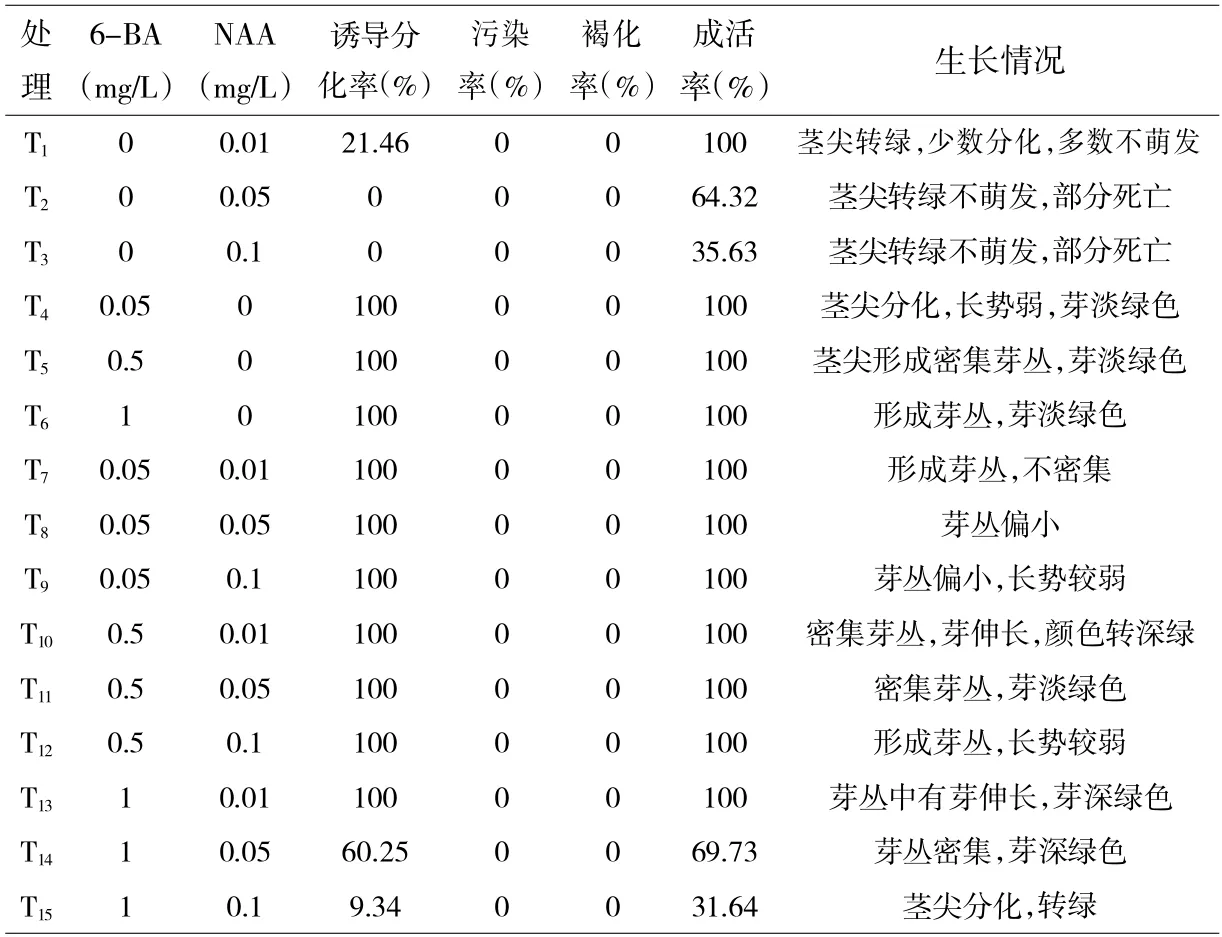
表1 6-BA 和NAA 不同浓度组合对芦蒿茎尖增殖分化的影响
2.2 6-BA 不同浓度处理对芦蒿茎尖增殖的影响
由表2 可知,各处理均能使芦蒿茎尖增殖,整体上看,增殖系数随着6-BA 浓度的升高呈现出先上升后下降的趋势,其中F3处理的增殖系数明显高于其他处理。在6-BA 浓度为0.5 mg/L 时,增殖系数最高,随后浓度越高,增殖系数反而越低。
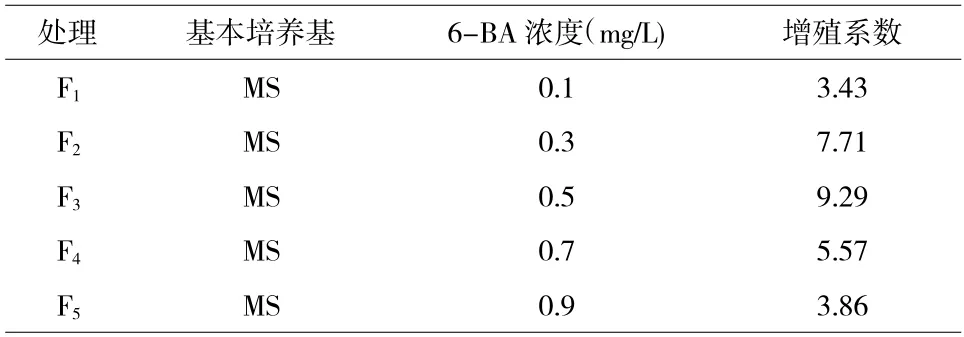
表2 6-BA 不同浓度处理对芦蒿茎尖增殖的影响
2.3 不同培养基及激素处理对芦蒿生根的影响
由表3 可知,不同培养基及激素处理均能使芦蒿生根,整体上看,与1/2MS 培养基相比较,在MS 培养基中生长的芦蒿其所需的平均生根时间较短,平均生根数量及平均根长均高于1/2MS 培养基,但根系粗度略小于1/2MS 培养基。

表3 不同培养基及浓度激素处理对芦蒿生根的影响
在NAA 0.05mg/L 的MS 培养基中,芦蒿生根所需的时间最短,且平均生根数量最多;在NAA 浓度为0.01mg/L 的MS 培养基中,平均根长最长;在NAA 浓度为0.05mg/L 的1/2MS 培养基中,平均根粗最粗。

图2 不同培养基及浓度激素处理对芦蒿生根数和根长的影响
2.4 不同接种部位对芦蒿生根的影响
在前期研究基础上,在MS+NAA(0.05mg/L)的条件下,分别接种芦蒿茎尖和茎段部位,研究其对芦蒿生根的影响,结果如表4 所示,用芦蒿茎尖接种生根,其根系平均长度和粗度均大于用茎段生根;而用芦蒿茎段接种生根,其生根所需的时间明显短于茎尖,并且根系数量显著多于茎尖。
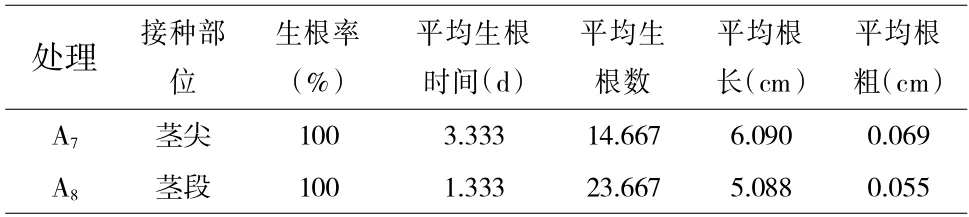
表4 不同接种部位对芦蒿生根的影响
3 讨论
生产上芦蒿多为无性繁殖,农户们直接利用茎段进行扦插,多年来导致芦蒿品种混杂,品性退化,病害加重[15]。目前,对芦蒿的研究主要集中在芦蒿中营养物质的成分和种类鉴定、纯化提取、病害防治以及栽培技术等方面[16-17]。郝梦洁等[6-7]对芦蒿组培技术开展了研究,主要建立了芦蒿的再生体系,诱导茎段上生长点快速再生,并非芦蒿茎尖组织培养。本研究利用芦蒿茎尖建立茎尖组织培养体系,为培育品种纯、种性好的脱毒芦蒿种苗奠定基础。
本研究发现,在芦蒿茎尖组织初代培养过程中,适宜浓度的6-BA 和NAA 都对芦蒿茎尖分化起了关键作用。各个浓度的6-BA 均能促进茎尖分化,随着浓度增加,茎尖分化率先上升后下降,高浓度的6-BA 效果有所下降;低浓度的NAA 有利于诱导茎尖分化,随着浓度增加,茎尖的分化率降低;在6-BA 和NAA 不同浓度组合处理中,T10(6-BA 0.5mg/L+NAA 0.01mg/L)效果最好,芦蒿茎尖分化形成密集芽丛,并且有芽伸长,芽丛颜色转深绿。
在植物组织培养研究中,细胞分裂素能够促进细胞的分裂和芽的分化,6-BA 是常用最普遍的细胞分裂素之一。陈银凤等[18]研究发现,6-BA 浓度在2mg/L以上时,蝴蝶兰原球茎的增殖系数开始下降;郝梦洁[7]研究发现,6-BA 浓度大于0.4mg/L 时,对芦蒿生长点的增殖分化具有抑制作用,增殖系数呈现逐渐降低的趋势,符合本研究的结论。
在芦蒿生根试验中,各个处理均能使芦蒿生根,且不同处理对芦蒿根系的生长都有不同的促进作用,其中MS 培养基相比较于1/2MS 培养基,对芦蒿的生根时间、生根数量和长度具有更好的促进效果,但对根系粗的促进作用小于1/2MS 培养基;在各个NAA 浓度中,0.05mg/L 对缩短芦蒿生根时间、增加芦蒿生根数量、粗度及长度的效果最为明显。利用芦蒿茎段生根会相对快速容易,且根系较发达;利用茎尖生根则根系更粗、更长。本研究表明,MS+NAA 0.05mg/L 是最适宜芦蒿生根的培养基。在郝梦洁等[6-7]研究中,MS 培养基和1/4MS 培养基比1/2MS 培养基和1/8MS 培养基能更高效诱导芦蒿生根,0.1mg/L NAA 是最适宜诱导芦蒿生根的激素浓度,本研究与其结论基本一致,其NAA 浓度梯度较大,未有0.05mg/L NAA 的数据。对此,在后续试验中会扩大NAA 浓度梯度和培养基种类,补充优化试验结果。
