TiO2-rGO紫外光催化臭氧耦合高效降解双酚A的研究
2022-09-20朱锡淼刘金华廖高祖冷晟萌许晓春方建章
朱锡淼, 刘金华, 廖高祖*, 冷晟萌, 许晓春, 方建章
(1. 华南师范大学环境学院, 广州 510006; 2. 江门市固体废物处理有限公司, 江门 529000; 3. 广东岭秀科技有限公司, 广州 510530)
双酚 A(BPA)在聚碳酸酯食品容器、器皿、包装材料和防护涂层的制造中作为增塑剂被大量使用[1],在使用过程中不可避免地会释放到环境中。BPA作为一种具有代表性的环境内分泌干扰物质,可以通过环境或食物摄取而进入生物体,对动物和人类的神经系统、内分泌系统、生殖系统和免疫系统造成伤害[2],在自然环境中能够持续释放且分布广泛。因此,如何从环境中去除BPA是一个必要且具有挑战性的难题[3]。
光催化臭氧耦合技术是一种降解与矿化有机污染物的高效方法[4],当光催化和臭氧氧化同时进行时,臭氧的强亲电性提高了光生载流子的分离效率,抑制了电子-空穴的复合,增强光催化降解性能;同时,光催化还可以促进臭氧分解为活性氧自由基,提高臭氧的利用效率和氧化能力,实现光催化与臭氧氧化的协同作用[5]。在所有光催化剂中,TiO2因其廉价易得、性质稳定、抗光腐蚀性强而被视为理想的光催化剂[6],然而,TiO2光催化剂产生的空穴-电子对容易复合,较低的量子效率限制了TiO2的实际应用。研究表明,石墨烯(rGO)基TiO2复合材料(TiO2-rGO)比TiO2具有更高的光催化活性[7],这主要归因于石墨烯作为优良的电子传导体及有机物吸附剂,不仅可以分离光激发的载流子以提升光催化活性,还可增强对有机污染物的吸附能力[8]。
本研究首先通过Hummers法制备氧化石墨烯(GO)溶液,再利用液相沉积法将纳米TiO2沉积到GO表面后煅烧得到TiO2-rGO复合光催化剂。采用SEM、TEM、XRD、BET和UV-Vis DRS等分析手段探究材料的微观形貌、晶型结构等理化性质,考察催化剂在紫外或臭氧条件对BPA的降解及TOC去除性能,讨论了前驱体溶液中GO投加量、反应溶液中臭氧的质量浓度、溶液初始pH、添加不同牺牲剂对BPA矿化程度的影响和TiO2-rGO催化剂的重复使用性能,最后探讨了光催化臭氧氧化的降解机理。
1 实验部分
1.1 主要试剂
石墨粉、高锰酸钾(KMnO4)、过氧化氢(H2O2)、硼酸(H3BO3)、硝酸钠(NaNO3)、硫酸(H2SO4)、硫代硫酸钠(Na2S2O3)、盐酸(HCl)和甲醇(CH3OH)、双酚A(C15H16O2)、氟钛酸铵(H8F6N2Ti)均为分析纯,市售。实验用水为MILLIPORE纯水仪制备的超纯水。
1.2 氧化石墨的制备
采用Hummers法制备氧化石墨[9]。在冰浴条件下,将1 g鳞片石墨、0.5 g硝酸钠加入到23 mL浓硫酸中,剧烈搅拌下缓慢加入3 g高锰酸钾,加入高锰酸钾的过程中控制温度不超过20 ℃。撤去冰浴,悬浮液转移至35 ℃的油浴锅中,搅拌30 min,缓慢加入46 mL去离子水后升温至98 ℃并维持15 min,移去油浴,冷却至60 ℃后加入70 mL温度为60 ℃的去离子水,边搅拌边加入体积分数为3%的过氧化氢溶液,直至悬浮液呈现亮黄色。离心收集得到的黄色固体加入到1 000 mL浓度为0.1 mol/L的盐酸溶液中,搅拌45 min。再用去离子水多次离心洗涤黄色固体,直至滤液pH为7,最后冷冻干燥得到氧化石墨。
1.3 TiO2-rGO复合材料的制备
称取质量为xg的氧化石墨超声溶解于250 mL去离子水中,得到氧化石墨烯(GO)溶液,再往GO溶液中依次加入4.95 g氟钛酸铵和4.65 g硼酸,搅拌使其充分溶解,用1 mol/L盐酸溶液调pH至3.0。将上述混合溶液密封后置于60 ℃水浴锅中反应2 h。反应结束后,固体产物离心洗涤3次后放入烘箱60 ℃下烘干,再置于马弗炉中200 ℃下锻烧2 h,研磨得到二氧化钛-还原氧化石墨烯粉末(TiO2-rGO(xg),x=0.01、0.02、0.03 g),未添加GO的样品记为TiO2,后文未特殊说明的TiO2-rGO样品则为TiO2-rGO(0.02 g)。
1.4 材料表征和分析方法
场发射扫描电子显微镜(ZEISS Ultra 55型,德国卡尔·蔡司公司)、200 kV透射电子显微镜(日本电子公司)、X射线衍射仪(D8 Advance型,德国布鲁克公司)、比表面积与孔隙度分析仪(ASAP 2020 PLUS型,美麦克默瑞提克公司)、紫外-可见分光光度计(U-3010型,日本日立公司)。
高效液相色谱(LC10A型,日本岛津)分析溶液中双酚A的浓度,液相色谱配置SPD-10AV紫外检测器和C18柱(250 mm×4.6 mm,5 μm),流动相为V甲醇∶V水=7∶3,流速1.0 mL/min,检测波长为245 nm。总有机碳采用TOC 5000型分析仪(日本岛津)测定。
1.5 光催化臭氧氧化实验
采用圆筒型状玻璃管光反应器(h=400 mm,内径Φ=80 mm)进行光催化臭氧氧化实验,将高压汞灯(主波长365 nm,功率175 W,上海季光特种照明电器厂)置于反应器中央,并用石英套管与反应液隔开。反应器外有循环冷却水套,以避免反应溶液温度上升。O3由高纯 O2通入臭氧发生器(德国安塞罗斯公司,COM-AD-01-OEM) 产生,并通过位于反应器底部的多孔玻璃板连续鼓入反应溶液中。O2的流速为1 L/min,O3的产生速率为50 mg/h,Na2S2O3溶液作为尾气中剩余O3的吸收液。向双酚A溶液(1 000 mL,10 mg/L)中加入0.5 g催化剂,通入O2曝气30 min,待双酚A达到吸附平衡后接通高压汞灯电源。从取样口取出溶液,采用有机滤膜(孔径为0.45 μm)过滤,装瓶待检测。在重复实验中,每个使用周期催化剂的回收率≥95%。
2 结果与讨论
2.1 材料表征
图1A、B为TiO2及TiO2-rGO的SEM图。由图1A可看出,TiO2纳米颗粒直径约为20 nm,堆积成表面粗糙、粒径约为600 nm的大球体,大球体彼此之间相互团聚;由图1B可看出,TiO2粒径基本维持不变,均匀地分散在石墨烯基底上,这使得TiO2-rGO光催化剂比团聚的TiO2与污染物有更大的接触面积;同时,TiO2球体可作为石墨烯基底之间的插层,有效避免相邻石墨烯之间的堆叠,增强TiO2-rGO复合材料的比表面积及对污染物的吸附性能。图1C显示,大量TiO2颗粒附着在石墨烯上,在TiO2-rGO的边缘,可清晰看到石墨烯层,结果与SEM一致。GO、TiO2和TiO2-rGO的XRD谱图如图1D所示。GO在2θ为9.8°处出现尖锐的(001)面衍射峰,依据布拉格方程2dsinθ=nλ(d为层间距,θ为衍射角,n=1,Cu靶产生的X射线波长λ=0.154 nm),其层间距约为0.90 nm。TiO2和TiO2-rGO在2θ=25.3°、37.9°、48.0°、54.4°与62.7°处均出现锐钛矿的特征衍射峰,分别对应锐钛矿相(101)、(004)、(200)、(105)及(211)晶面[10]。相比TiO2,TiO2-rGO并未出现新的衍射峰,一方面是因为氧化石墨烯经煅烧后被还原为石墨烯,在2θ=9.8°处的特征峰消失;另一方面,TiO2-rGO中rGO含量过低,导致rGO的特征峰被TiO2的锐钛矿衍射峰所掩盖[11]。

图1 不同样品的形貌及晶型结构
图2为TiO2和TiO2-rGO的氮气吸附-脱附曲线,在相对压力较低的条件下为可逆反应,说明材料与N2之间有较强的作用力。在相对压力大于0.4后出现滞后环,属于IV型等温曲线,由此可判断TiO2和TiO2-rGO均为介孔结构[12]。在相对压力接近于1时,TiO2-rGO样品的回滞环曲线比TiO2的斜率大,说明TiO2-rGO比表面积更大[13]。TiO2-rGO与TiO2的比表面积分别为80.3、76.8 cm2/g,该结果表明:引入石墨烯可提高比表面积,促进催化剂与有机污染物充分接触;同时,大比表面积可提供更多的活性位点,提高臭氧转化为羟基自由基的效率,有利于提高催化臭氧氧化活性[5]。

图2 氮气吸附-脱附曲线
样品的紫外-可见漫反射(UV-Vis DRS)光谱如图3A所示。在紫外光区域,TiO2和TiO2-rGO均有强烈的吸收;在可见光及近红外区域,TiO2对光的吸收较弱,而TiO2-rGO的吸收则强烈许多,这主要归因于石墨烯在可见光及近红外区域具有很强的背景吸收[14]。此外,TiO2-rGO较TiO2吸收边缘移至更长的波长处,这说明rGO的引入导致催化剂的带隙降低[15]。利用Tauc’s图得到不同催化剂的带隙(Eg),如图3B所示,通过外推法可得TiO2-rGO和TiO2的Eg分别为3.23、3.32 eV,加入rGO使TiO2的Eg下降了0.09 eV,这是因为TiO2和rGO之间形成了Ti—O—C键[16]。

图3 不同样品的UV-Vis DRS光谱及相应Tauc’s图
2.2 光催化臭氧耦合降解BPA性能测试
图4A、B分别为BPA、TOC去除率随反应时间的变化曲线。在UV/O3、UV/O3/TiO2和UV/O3/TiO2-rGO体系中,反应15 min后,BPA的降解率分别为89%、92%和98%;反应45 min后,TOC去除率分别为51%、82%和100%。在UV/O3体系中,臭氧被波长低于310 nm的紫外光激发,与H2O反应生成H2O2:
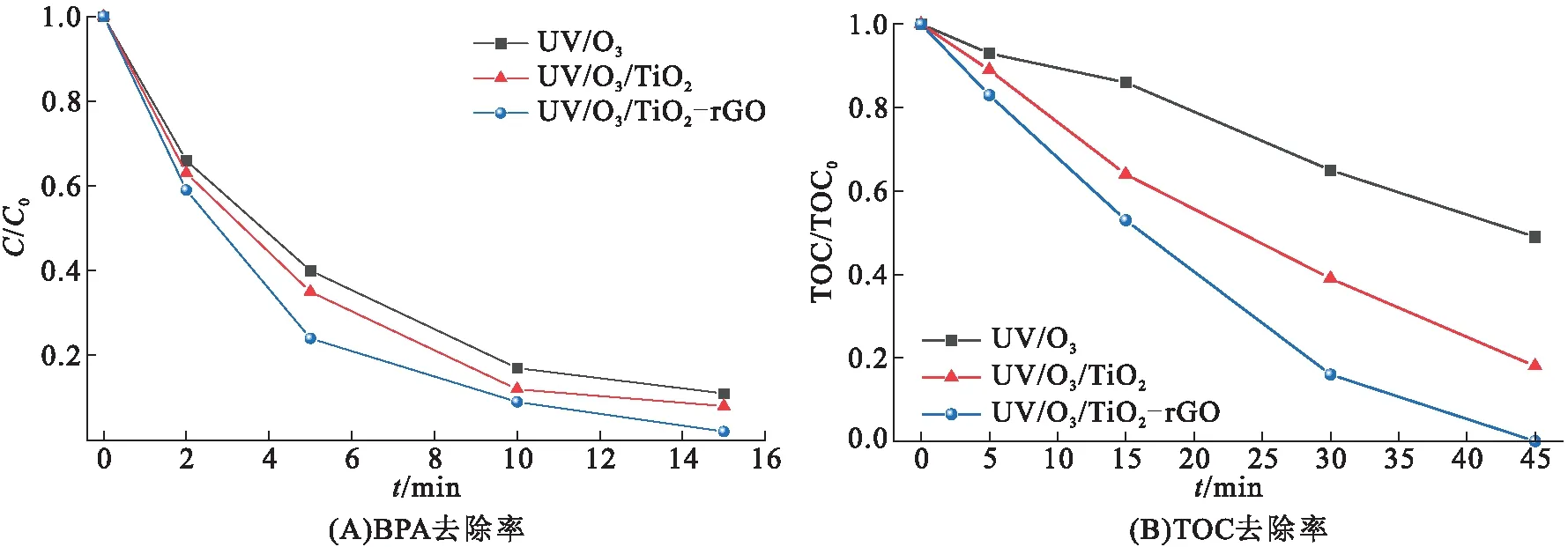
图4 不同臭氧体系中污染物的去除
O3+H2O+hv→H2O2+O2,
(1)
H2O2在紫外光的照射下分解为·OH:
H2O2+hv→2·OH。
(2)
因此对BPA具有氧化降解性能。UV/O3/TiO2和UV/O3/TiO2-rGO体系的TOC去除率较UV/O3体系均有显著提高,而UV/O3/TiO2-rGO体系的TOC去除率是UV/O3/TiO2体系的1.22倍。
2.2.1 GO质量对TiO2-rGO催化性能的影响 前驱液中投加不同GO质量所制备的光催化剂对TOC去除率的影响如图5所示。在光催化臭氧体系中反应45 min,TiO2、TiO2-rGO(0.01 g)、TiO2-rGO(0.02 g)与TiO2-rGO(0.03 g)对溶液中TOC的去除率分别为82%、87%、100%和92%,TiO2-rGO系列复合材料的TOC去除率均高于TiO2,这是由于石墨烯作为光生电子的快速转移通道,使电子快速扩散至催化剂表面,有效抑制了光生电子和空穴对的复合[17],提高了电子(e-)与空穴(h+)的分离效率[18],同时促进了O3分解为活性氧自由基,实现光催化和臭氧氧化协同降解BPA[5]。随着GO质量的增加,TOC去除率先增大后减小,当前驱体溶液中GO质量为0.02 g时,TiO2-rGO催化活性最高,继续增大前驱体溶液中GO质量则催化活性下降。主要原因:在黑色复合光催化材料中,存在“屏蔽效应”,过量的rGO会导致光被石墨烯吸收,影响了催化剂对光的有效利用[19]。因此,后续实验均选用TiO2-rGO(0.02 g)并简化记为TiO2-rGO。

图5 GO质量对TOC去除率的影响
2.2.2 臭氧质量浓度对TOC去除率的影响 通过调节臭氧发生器的功率,可改变鼓入气流中臭氧的质量浓度。在UV/O3/TiO2-rGO体系中,鼓入气流中臭氧质量浓度对TOC去除率的影响如图6所示。在45 min内,当臭氧质量浓度为0、20、35、50、65和80 mg/L时,TOC去除率分别为81.2%、86.4%、92.4%、94.6%、100.0%和96.8%。因此,确定最佳臭氧质量浓度为65 mg/L。总的来说,当臭氧质量浓度范围在0~65 mg/L时,TOC去除率随着臭氧质量浓度的增加而增加,这是因为溶解性臭氧量的增加会导致羟基自由基增多,从而使更多的有机分子接触羟基自由基并被氧化[20]。当臭氧质量浓度超过65 mg/L时,TOC去除率有所下降。这是因为鼓入过量臭氧会导致气泡阻碍光辐射到催化剂颗粒,导致光催化臭氧氧化活性降低。

图6 臭氧质量浓度对TOC去除率的影响
2.2.3 初始pH对TiO2-rGO催化性能的影响 溶液pH会影响自由基的产生、臭氧的分解以及催化剂表面电荷,从而影响催化臭氧氧化的性能。在UV/O3/TiO2-rGO体系中,溶液的初始pH对TOC去除率的影响如图7所示。

图7 溶液pH对TOC去除率的影响
当pH≤7时,随着pH的增大,TOC的去除率随之增加。这是因为:在酸性条件下,臭氧分解为羟基自由基被抑制,pH的增加有利于O3向羟基自由基的转化,与O3相比羟基自由基能更有效地降解有机物[21]。当pH在7.0~9.6范围时,持续增大pH对TOC的去除起负面作用。这是因为:一方面,pH越高,催化剂的价带和导带能级位置上移,使空穴的氧化能力降低,不利于光催化氧化反应的进行[22];另一方面,碱性条件下臭氧的自分解可消耗·OH,从而降低催化活性[5]。此外,根据本实验测得TiO2-rGO的等电点为5.10,结合BPA的pKa1为9.6[23]可知,当pH>9.6时,TiO2-rGO表面带负电荷,BPA呈阴离子型态,TiO2-rGO和BPA之间的静电斥力进一步导致TOC去除率降低。
2.2.4 重复使用性能 重复使用性是反映催化剂实际应用价值的重要特性。以催化活性最佳的TiO2-rGO(0.02 g)为样品,进行5次循环实验(45 min),每个循环实验结束后,将光催化剂高速离心洗涤后干燥,然后在相同的实验条件下进行下一个循环实验,结果如图8所示。TiO2-rGO(0.02 g)在使用5次后TOC去除率仍能达到92%,这说明了该催化剂具有良好的稳定性和可重复使用性,有望被应用于实际的光催化臭氧氧化处理BPA废水系统中。

图8 光催化臭氧去除TOC的重复性能
2.3 光催化臭氧耦合降解机理分析
为进一步了解光催化臭氧降解BPA的机制,进行了活性物种捕获实验[24]。在反应体系中,分别加入叔丁醇(TBA,0.25 mmol/L)和三乙醇胺(TEOA,0.25 mmol/L)作为羟基自由基 (·OH)和空穴(h+)的清除剂,反应45 min,结果如图9所示。

图9 不同牺牲剂对TOC去除率的影响
当加入叔丁醇时,TOC去除率从100%下降至29.5%,而当加入三乙醇胺时,TOC去除率从100%下降至44.5%。结果说明:当叔丁醇或三乙醇胺加入到反应溶液后,TOC去除率均显著下降,间接证明在降解反应过程中,·OH 和h+是主要活性物质,·OH起着最主要的作用。
光催化臭氧耦合降解机理示意图如图10所示。TiO2-rGO催化剂的光催化臭氧耦合降解过程主要包括:臭氧氧化(Ozonation)、光催化臭氧氧化(Photocatalysis Ozonation)、光催化(Photocatalysis)。当光催化与臭氧氧化同时进行时,以下反应促成了BPA的高度矿化:(1)臭氧在紫外光的辐射下间接生成·OH(式(1)~(2));(2)在紫外光的辐射下,TiO2光生电子从价带转移到导带:

图10 TiO2-rGO复合材料紫外光催化臭氧氧化BPA 的机理
TiO2+hv→TiO2+e-+h+。
(3)
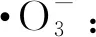
(4)
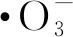
(5)
·HO3→O2+·OH。
(6)
大量电子(e-)被O3俘获,促使形成更多可被利用的空穴,而空穴与OH-反应生成·OH[1]:
OH-+h+→·OH。
(7)
这有效增强了光催化和臭氧氧化之间的协同效应。在UV/O3/TiO2-rGO体系中,rGO的引入使光生电子(e-)快速转移至rGO上,进一步提高了O3对e-的利用率,也使价带上留有更多的空穴,因此相比UV/O3/TiO2体系具有更强的矿化能力。
3 结论
采用液相沉积-煅烧法制备了TiO2-rGO光催化剂,SEM、TEM、XRD、BET与UV-Vis DRS等测试表明,锐钛矿型TiO2成功负载到rGO基底上,具有更好的分散性。催化剂活性随石墨烯投加质量的增加先增大后减小,TiO2-rGO(0.02 g)具有最高的催化活性,在UV/O3体系中反应45 min可实现对10 mg/L BPA完全矿化,经5次循环使用后对BPA的矿化率仍高达92%,这说明其具有良好的循环再利用性能。与TiO2相比,TiO2-rGO催化活性增强,这主要是由于引入石墨烯促进了光生电荷的分离,有效抑制了光生电子和空穴对的复合,同时促进O3分解为活性氧自由基,实现了光催化和臭氧氧化对有机污染物的协同降解。
