臂间收缩压差对原发性高血压患者发生动脉硬化的影响研究
2022-09-20闫家富郑恪扬刘茹菲曾荣刘傲亚程文立
闫家富,郑恪扬,刘茹菲,曾荣,刘傲亚,程文立
高血压的患病率逐年增加,是心血管疾病和过早死亡的主要危险因素,是全世界重要的公共健康问题[1]。国内外高血压管理指南均推荐高血压患者在首诊时应测量双上臂的血压,以较高侧作为测量值,避免高血压的漏诊[2-3]。左右两臂的血压差值的绝对值即臂间血压差(inter-arm blood pressure difference,IABPD),包括臂间收缩压差(inter-arm systolic blood pressure difference,IASBPD)和臂间舒张压差(inter-arm diastolic blood pressure difference,IADBPD)。我国专家共识推荐IASBPD的正常上限值为10 mm Hg(1 mm Hg=0.133 kPa)[4],最新的研究表明,IASBPD≥5 mm Hg或IASBPD≥10 mm Hg与心血管疾病及全因死亡的风险增加相关[5-6],这种关联可能由动脉硬化介导[7-8]。
已有研究报道IASBPD与评估动脉弹性的指标相关[7,9-10],如颈-股脉搏波速度(carotid-femoral pulse wave velocity,cf-PWV)、臂踝脉搏波速度(brachial-ankle pulse wave velocity,baPWV)和脉压/每搏输出量指数(pulse pressure/stroke volume index,PP/SVi)。以上研究均将容易获得的IASBPD≥10 mm Hg作为因变量,评估动脉弹性的指标数值越大,IASBPD≥10 mm Hg发生的风险越高,尚无研究将IASBPD作为一个心血管危险因素来评估动脉硬化发生的风险。
本研究以5 mm Hg和10 mm Hg作为IASBPD的切点,探究高血压患者发生动脉硬化风险的差异。
1 对象与方法
1.1 研究对象 本研究为回顾性研究,连续纳入2019年12月至2021年9月就诊于首都医科大学附属北京安贞医院高血压中心的18~75岁原发性高血压患者6 834例。纳入标准:(1)符合《中国高血压防治指南(2018年修订版)》中高血压的诊断标准[3];(2)接受四肢血压及动脉硬化评估检测;(3)体格检查、生化检查等病历资料完整。排除标准:(1)无四肢血压及动脉硬化评估检测资料;(2)继发性高血压(包括原发性醛固酮增多症、嗜铬细胞瘤、肾动脉狭窄、库欣综合征、中重度的睡眠呼吸暂停低通气综合征等);(3)合并其他引起动脉硬化的疾病,如慢性肾脏病(CKD)3~5期、糖尿病;(4)病史资料不全。本研究通过首都医科大学附属北京安贞医院伦理委员会审查(2021040X)。
1.2 方法
1.2.1 一般资料及实验室检查 收集患者的一般资料包括性别、年龄、身高、体质量,并计算体质指数(body mass index,BMI)=体质量(kg)/身高(m)2。入院时收集患者清晨空腹12 h的外周静脉血2 ml,测定空腹血糖、三酰甘油、总胆固醇、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、血清肌酐浓度,根据CKD-EPI公式计算估算肾小球滤过率(estimated glomerular filtration rate,eGFR)[11]。
1.2.2 四肢血压及动脉硬化评估 采用同步四肢血压与臂踝脉搏波速度测量仪(日本欧姆龙,型号:VP-1000)于室温25 ℃左右进行检测,检测当日患者应避免吸烟、饮酒、饮咖啡、暴饮暴食,采取仰卧位双手放置两侧,休息15 min后,四只袖带分别绑在双上肢和双踝,心电图夹子夹在双腕上,与受试者的胸骨左缘第四肋间放置心音图传感器,同时测量四肢血压、baPWV,重复3次,以平均值为这些指标的最终结果,并计算脉压差(脉压差=收缩压-舒张压)和IASBPD。根据同步四肢血压和臂踝脉搏波速度测量临床应用中国专家共识[4]和日本循环器协会的推荐[12],以 baPWV>1 800 cm/s为动脉硬化。
1.3 患者分组 根据3次测量的双上肢的收缩压的平均值,计算两臂的IASBPD并取绝对值,IASBPD(mm Hg)=|收缩压右臂-收缩压左臂|,按照中国四肢血压测量专家共识以及最新的荟萃分析结果[4-5],将所有入选患者分为IASBPD<5 mm Hg组、5 mm Hg≤IASBPD<10 mm Hg组和IASBPD≥10 mm Hg组。再以性别(男,女)、年龄(<65岁,≥65岁)、BMI(<25 kg/m2,≥ 25 kg/m2)、收缩压分级(<140 mm Hg,140~160 mm Hg,>160 mm Hg)、LDL-C(<3.4 mmol/L,≥ 3.4 mmol/L)、空腹血糖(<7.0 mmol/L,≥7.0 mmol/L)进行IASBPD与动脉硬化关系的亚组分析。
1.4 统计学方法 所有资料采用统计R语言包(version 3.5.3)进行统计学处理,用Kolmogorow-Smironov检验定量资料的正态性,符合正态分布的计量资料以(±s)表示,组间比较采用单因素方差分析,组间两两比较采用Bonferroni检验;不符合正态分布的计量资料以M(P25,P75)表示,三组间比较采用Kruskal-WallisH检验,组间两两比较采用Mann-WhitneyU检验。定性资料采用相对数表示,组间差异采用χ2检验进行分析。使用线性回归模型和Logistic回归模型,根据现有的研究确定可能影响结局的因素为主要变量,分别构建3种模型〔单因素模型、多因素模型1(轻度校正模型:校正性别、年龄、BMI)、多因素模型2(充分校正模型:校正性别、年龄、BMI、收缩压、IASBPD、血清肌酐、总胆固醇、空腹血糖、三酰甘油、HDL-C、LDL-C)〕分析IASBPD对原发性高血压患者发生动脉硬化的影响,并在预设的亚组中对IASBPD与动脉硬化关系进行分层分析,并采用多因素Logistic回归分析相加模型和似然比检验分析IASBPD和相应亚组对动脉硬化的交互作用。组间两两比较以P<0.016 7为差异有统计学意义,其余分析以P<0.05为差异有统计学意义。
2 结果
2.1 三组患者一般资料及实验室检查结果比较 本研究共纳入6 834例原发性高血压患者,其中女2 744例(40.15%),男4 090例(59.85%),IASBPD<5 mm Hg组 4 248例,5 mm Hg≤ IASBPD<10 mm Hg组 1 806例,IASBPD≥10 mm Hg组780例。整体研究人群的中位baPWV为1 527(1 392,1 702)cm/s,按照baPWV>1 800 cm/s的标准[4,12],其中动脉硬化患者 1 043例(15.26%)。
三组患者的年龄、BMI、空腹血糖、总胆固醇、LDL-C、eGFR、收缩压、舒张压比较,差异无统计学意义(P>0.05);三组患者的性别、三酰甘油、HDL-C、血清肌酐、脉压差、baPWV和动脉硬化比较,差异有统计学意义(P<0.05)。组间两两比较结果显示5 mm Hg≤IASBPD<10 mm Hg组血清肌酐高于IASBPD<5 mm Hg组;IASBPD≥10 mm Hg组的女性患者占比低于IASBPD<5 mm Hg组;IASBPD≥10 mm Hg组三酰甘油、血清肌酐、脉压差、baPWV、动脉硬化发生率高于IASBPD<5 mm Hg组和5 mm Hg≤IASBPD<10 mm Hg组,差异有统计学意义(P<0.016 7),见表1。
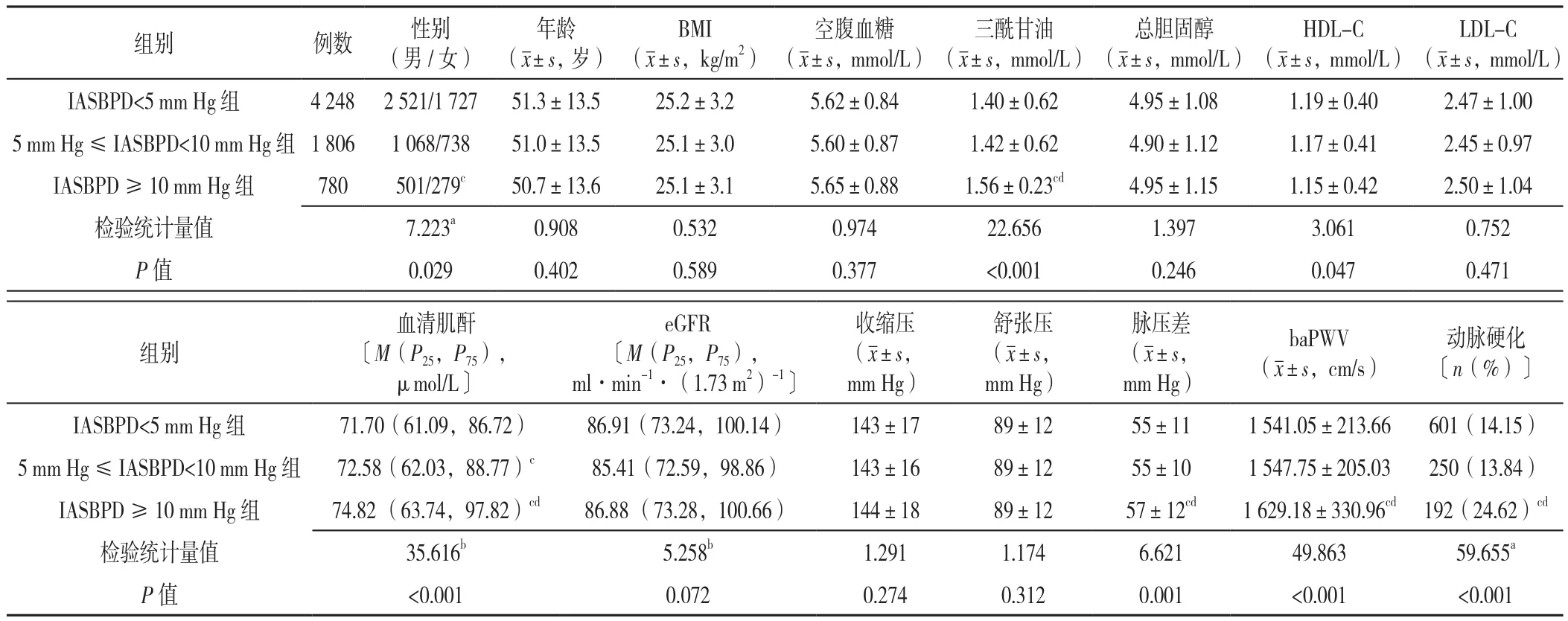
表 1 三组一般资料及实验室检查结果比较Table 1 Comparison of demographic and laboratory data among three groups of in essential hypertension patients divided by the inter-arm systolic blood pressure difference
2.2 IASBPD与baPWV的线性回归分析 单因素模型:以baPWV为因变量(赋值:实测值),以IASBPD为自变量(赋值:实测值),进行线性回归分析,回归方程有统计学意义F(1,6832)=2 984.092(P<0.001),调整R2=0.304,单因素模型结果显示IASBPD是baPWV的影响因素(P<0.001),IASBPD越大,baPWV越高;调整性别(赋值:0=男性,1=女性,R语言自动创建哑变量编码)、年龄(赋值:实测值)、BMI(赋值:实测值)进行线性回归,回归方程有统计学意义F(4,6829)=814.537(P<0.001),调整R2=0.323,多因素模型1结果显示IASBPD是baPWV的影响因素(P<0.001);进一步调整收缩压、IASBPD、血清肌酐、总胆固醇、空腹血糖、三酰甘油、HDL-C、LDL-C(赋值均为实测值),回归方程有统计学意义F(13,6820)=448.697(P<0.001),调整R2=0.461,回归分析结果显示IASBPD依然是baPWV的影响因素(P<0.001),见表2。
以baPWV为因变量(赋值:实测值),以IASBPD分组为自变量(0=IASBPD<5 mm Hg,1=5 mm Hg≤ IASBPD<10 mm Hg,2=IASBPD ≥ 10 mm Hg),以IASBPD<5 mm Hg为参照进行线性回归分析,回归方程有统计学意义F(1,6832)=5 433.709(P<0.001),调整R2=0.443,单因素模型结果显示,IASBPD≥10 mm Hg患者baPWV高于IASBPD<5 mm Hg患者;调整性别、年龄、BMI(赋值同上)进行多元线性回归分析,回归方程有统计学意义F(4,6829)=1 791.213(P<0.001),调整R2=0.512,多元模型1结果显示IASBPD≥10 mm Hg患者baPWV高于IASBPD<5 mm Hg患者(P<0.001);进一步调整收缩压、血清肌酐、总胆固醇、空腹血糖、三酰甘油、HDL-C、LDL-C(赋值均为实测值),多因素模型2回归方程有统计学意义F(13,6820)=675.877(P<0.001),调整R2=0.563,结果显示IASBPD≥10 mm Hg患者baPWV依然高于IASBPD<5 mm Hg患者(P<0.001),见表2。
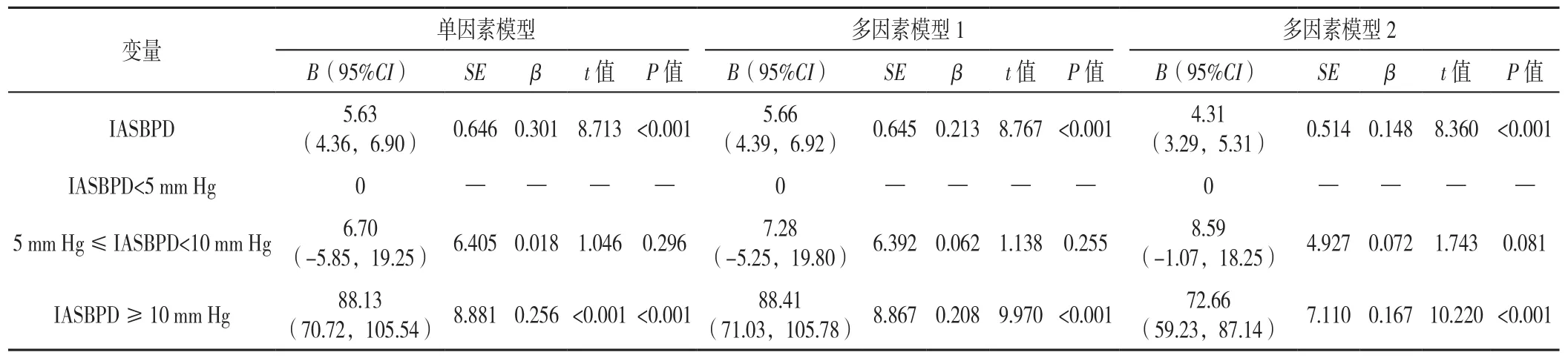
表2 IASBPD与baPWV的线性回归分析Table 2 Linear regression analysis of inter-arm systolic blood pressure difference and brachial-ankle pulse wave velocity in essential hypertension
2.3 IASBPD与动脉硬化的Logistic回归分析 以动脉硬化情况为因变量(赋值:1=是,0=否),以IASBPD<5 mm Hg为参照组进行单因素Logistic回归分析,单因素模型结果显示IASBPD≥10 mm Hg是原发性高血压患者发生动脉硬化的危险因素(P<0.001);调整性别(赋值:0=男性,1=女性)、年龄(赋值:实测值)、BMI(赋值:实测值)进行多因素Logistic回归分析,多因素模型1结果显示IASBPD≥10 mm Hg是原发性高血压患者发生动脉硬化的危险因素(P<0.001);进一步调整收缩压、血清肌酐、总胆固醇、空腹血糖、三酰甘油、HDL-C、LDL-C(赋值均为实测值),多因素模型2结果显示:IASBPD≥10 mm Hg依然是原发性高血压患者发生动脉硬化的危险因素(P<0.001),见表3。

表3 IASBPD与动脉硬化的Logistic回归分析Table 3 Logistic regression analysis of inter-arm systolic blood pressure difference and arterial stiffness in essential hypertension
2.4 IASBPD与动脉硬化的亚组分析及交互作用检验因IASBPD<5 mm Hg组和5 mm Hg≤IASBPD<10 mm Hg组的患者动脉硬化的风险无统计学差异,将这两组合并为IASBPD<10 mm Hg组,在预设的亚组中进行IASBPD与动脉硬化关系的亚组分析,所有在多因素模型2中的协变量被调整。IASBPD≥10 mm Hg与动脉硬化风险增加的关系在性别、年龄、BMI、收缩压分级和血糖水平亚组中是一致的(交互检验P值均>0.05),但IASBPD与LDL-C水平对动脉硬化风险具有交互作用(交互检验P=0.021),在LDL-C≥3.4 mmol/L的患者中,IASBPD≥10 mm Hg与动脉硬化风险增加的关系更显著〔OR=3.47,95%CI(1.57,5.28)〕,见图1。

图1 IASBPD与动脉硬化的亚组分析及交互作用检验Figure 1 Subgroup analysis and interaction test of inter-arm systolic blood pressure difference and arterial stiffness in essential hypertension
3 讨论
IASBPD作为临床诊疗中极易获得也是易被忽略的指标,已有充分的研究报道了IASBPD≥10 mm Hg与心血管事件和死亡风险增加有关[5-6]。IASBPD的异常增大伴随着心血管风险的增加可能是由动脉硬化介导的,先前的研究也报道了IASBPD≥10 mm Hg与评估动脉弹性的相关指标(cf-PWV、baPWV和PP/SVi)相关[7,9-10],但这些研究均将IASBPD≥10 mm Hg作为因变量,分析与动脉弹性指标的连续性关系,且并没有对动脉硬化给出明确的定义。本研究将IASBPD这一参数作为自变量,并以baPWV>1 800 cm/s为动脉硬化,分析其与baPWV及动脉硬化的相关性,并在相应的亚组中检验IASBPD≥10 mm Hg与动脉硬化关系的稳健性,旨在探究IASBPD是否可以作为一个反映动脉硬化的简易指标。
本研究纳入的原发性高血压患者中IASBPD≥ 10 mm Hg的发生率为11.4%(780/6 834),IASBPD≥10 mm Hg组的男性患者和动脉硬化占比更高,IASBPD≥10 mm Hg组的三酰甘油、血清肌酐和baPWV水平更高,差异有统计学意义。IASBPD与baPWV呈正相关,构建的多因素Logistic回归分析发现,IASBPD≥10 mm Hg是发生动脉硬化的危险因素,且在LDL-C≥3.4 mmol/L的患者中,这一关系更显著。
臂间血压差异在临床诊疗中很常见,既往研究发现高血压患者中IASBPD≥10 mm Hg的发生率为11.2%〔95%CI(9.1,13.6)〕[13],本研究的原发性高血压患者的IASBPD≥10 mm Hg的发生率为11.4%,与之一致。此外,本研究对于双上臂的血压测量采用示波法同步四肢血压测量仪器进行三次测量,以此获得的IASBPD数值重复性良好,而单肢序贯测量方式因“白大衣效应”和短时血压变异,往往会造成IABPD数值被高估以及IASBPD≥10 mm Hg的可重复性低[4,14]。
CLARK等[5]最新的Meta分析纳入了24项研究,共包含53 827例受试者,推荐IASBPD的正常上限值为10 mm Hg,我国最新的《同步四肢血压和臂踝脉搏波速度测量临床应用中国专家共识》[4]推荐正常IASBPD<10 mm Hg,因此双臂血压差异在健康人群中也是普遍存在的,SONG等[15]对806例健康受试者同时测量双臂血压,所有受试者的IASBPD/IADBPD的均值为3.3/2.0 mm Hg,其中3.7%的受试者的IASBPD≥10 mm Hg,双臂间收缩压生理性差异可能主要归因于左右肱动脉解剖结构差异以及优势手[16]。而臂间血压的异常增大可能与不对称性分布的外周血管疾病有关[17],CLARK等[18]的荟萃分析显示,IASBPD≥10 mm Hg诊断外周血管疾病的灵敏度为32%,特异度为91%,灵敏度较低的原因可能与外周血管狭窄程度较低或患者存在双侧对称动脉狭窄有关,IASBPD≥10 mm Hg和锁骨下动脉狭窄〔RR=8.8,95%CI(3.6,21.2)〕及外周血管疾病〔RR=2.4,95%CI(1.5,3.9)〕显著相关。
既往关于IASBPD与动脉硬化指标之间关系的研究均将简易获得的IASBPD作为因变量,分析IASBPD≥10 mm Hg发生的影响因素。CANEPA等[9]纳入1 045例社区老年人,构建多因素Logistic回归模型发现,cf-PWV越大,IASBPD≥10 mm Hg的发生风险越高〔OR=1.24,95%CI(1.05,1.48),P=0.01〕;SU等[10]纳入1 120例患者的横断面研究发现,baPWV每增加1 cm/s,IASBPD≥10 mm Hg发生风险增加0.1%〔OR=1.001,95%CI(1.000,1.001),P=0.022)〕;IIDA等[7]在234例高血压患者中发现,logPP/Svi越大,IASBPD≥5 mm Hg发生的风险越大(OR=1.264,P=0.016)。本研究采用线性回归和Logistic回归分析IASBPD与baPWV和动脉硬化的关系,在充分调节性别、年龄、BMI、收缩压、IASBPD、血清肌酐、总胆固醇、空腹血糖、三酰甘油、HDL-C、LDL-C这些影响动脉弹性的相关指标后,IASBPD依然是baPWV的影响因素,IASBPD每增加1 mm Hg,baPWV增加4.3 cm/s〔B=4.31,95%CI(3.29,5.31),P<0.05〕,IASBPD ≥ 10 mm Hg是高血压患者发生动脉硬化的危险因素〔OR=2.28,95%CI(1.76,2.94),P<0.001〕。与既往研究相比[7,9-10],本研究将IASBPD作为自变量,动脉硬化及baPWV作为因变量,调整的变量更充分,排除继发性高血压患者,且本研究样本量更大。
IASBPD异常增大的原因可解释IASBPD≥10 mm Hg与baPWV及动脉硬化风险增加的相关性,左右两臂血压相似是机体微调节的血流动力学稳定的结果,而动脉内皮细胞功能障碍以及其后续的不对称性的动脉硬化分布导致这一血流动力学稳态被破坏,动脉反射波增加两臂的血流动力学的不平衡程度,进而造成双臂血压测量值的差异变大[19],虽然既往研究报道IASBPD≥10 mm Hg和外周动脉狭窄性病变显著相关,但这些动脉狭窄病变所致的IASBPD异常增大往往多为35 mm Hg以上,而在较低的IASBPD水平(如10或15 mm Hg),受试者多无动脉狭窄病变的影像学证据[20],此外单纯以IASBPD≥10 mm Hg诊断外周血管疾病的灵敏度仅为32%[18],因此可以推测IASBPD较低水平的差异多数可能不是外周动脉狭窄性疾病所致,亚临床的动脉损伤(如内皮功能障碍、动脉硬化)可能是导致IASBPD异常增大的主要原因。结合既往分析IASBPD增大原因的研究以及本研究结果,IASBPD可以有效反映动脉硬化这一类的亚临床动脉损伤。
本研究发现IASBPD与LDL-C水平对动脉硬化的风险增加具有交互作用,这可能是LDL-C代谢异常,造成动脉粥样硬化斑块形成的风险增大,斑块的形成会导致 IASBPD[14]和 baPWV 异常增大[19],造成IASBPD≥10 mm Hg增加动脉硬化的风险在LDL-C≥3.4 mmol/L的患者中更显著。目前的欧洲高血压管理指南指出IASBPD>15 mm Hg与额外的心血管风险有关[2];最新的荟萃分析的结果显示,IASBPD每增加5 mm Hg与心血管事件风险独立相关[5],本研究结果证实IASBPD≥10 mm Hg与动脉硬化风险增加相关,可解释IASBPD与心血管事件和死亡风险增加相关的可能机制,支持IASBPD作为评估心血管风险的补充因素。
本研究主要有以下局限性,第一,本研究评估动脉硬化的指标是baPWV,现有指南推荐评估动脉硬化的金标准是cf-PWV,采用baPWV可能会高估动脉硬化的程度;第二,本研究是横断面研究,因此不能说明动脉硬化和IASBPD是否存在因果关系,需进一步的研究分析IASBPD与动脉硬化的纵向关系;第三,本研究纳入的原发性高血压患者样本量较大,并未分析降压治疗情况,降压治疗可能会降低IASBPD的大小。
综上,在原发性高血压患者中,IASBPD与baPWV呈正相关,IASBPD≥10 mm Hg与动脉硬化风险增加相关,且在LDL-C≥3.4 mmol/L的患者中这一关系更明显。因此,在原发高血压患者的管理中,应同时测量双上臂的血压,结合IABPD,综合评估心血管风险。
作者贡献:闫家富、程文立进行文章的构思与设计;闫家富、郑恪扬、刘茹菲进行数据收集,撰写论文;曾荣、刘傲亚、程文立进行研究的实施与可行性分析;闫家富进行数据整理,结果的分析与解释;闫家富、郑恪扬进行统计学处理,论文的修订,英文的修订;郑恪扬、刘傲亚、程文立负责文章的质量控制及审校;程文立对文章整体负责,监督管理。
本文无利益冲突。
