3类由第三/五主族重元素形成化合物中的Ga-E(E=P,As,Sb)键性质
2022-09-20钟雨芙万世昌李晓艳
钟雨芙,万世昌,李晓艳
(河北师范大学 化学与材料科学学院,河北 石家庄 050024)


图1 3类含Ga-E键结构的化合物Fig.1 Three Types of Compounds Containing Ga-E Bond

1 计算方法
应用Gaussian09程序[13],在PBEPBE/def2-SVP水平上对研究体系进行了全参数优化,频率分析表明优化得到的结构没有虚频,是稳定结构.采用AIM2000程序[14]对化学键进行了电子密度拓扑分析,使用Gaussian程序自带的NBO3.7程序进行了自然键轨道分析[15-16].
2 结果与讨论
2.1 构型分析
优化得到的3类体系的构型参数列于表1.可以看出,计算得到的Ga-E键的键长与实验测得的键长非常接近,表明所采用的计算方法是可靠的.

表1 3类化合物中Ga-E键的实验和计算键长(R)及其Wiberg键级(BD)Tab.1 Experimental and Calculated Bond Lengths and Wiberg Bond Orders of Ga-E Bonds in Three Types of Compounds
比较3类化合物中的Ga原子和E原子之间的化学键可以看出,3类化合物中Ga-E键的键长相差不大.在类型Ⅰ中,有2种类型Ga-E键,一是Ga原子与端基的E原子相连,形成2个等价的Ga-E1键,二是2个Ga原子与2个E2原子形成1个Ga-E-Ga-E四元环结构.比较类型Ⅰ中的2类Ga-E键可以看出,Ga-E1键长稍短于Ga-E2键长,文献[8]中将Ga-E1键指认为双键,Ga-E2键指认为单键.类型Ⅱ中只有1类Ga-E双键,Ga原子位于六元杂环中.类型Ⅲ中有2类Ga-E键,Ga1原子与E原子和Cl原子相连,为Ga1-E单键,Ga2原子与E原子形成Ga2-E双键.比较3类化合物中Ga-E键的键长可以看出,对于同种类型的化合物,Ga-E键按E=P,As,Sb的顺序逐渐增长.当E相同时,3类化合物中Ga-E键长顺序为类型Ⅰ>类型Ⅱ≈类型Ⅲ.键长的增长意味着化学键的减弱,因此,对于同类化合物而言,Ga-E键按E=P,As,Sb的顺序逐渐减弱;比较3类化合物的结构,类型Ⅰ中Ga-E键的强度弱于类型Ⅱ和类型Ⅲ中的Ga-E键.
表1给出的键级显示,类型Ⅰ中的Ga-E1键和Ga-E2键的Wiberg键级(BD)均在0.8左右,说明这2类Ga-E键均具有单键性质,并且Ga-E1键的BD值大于Ga-E2键的BD值,说明Ga-E1键强于Ga-E2键.类型Ⅱ中的Ga-E键和类型Ⅲ中Ga2-E键的BD值均大于1.5,说明这2类键属于Ga-E双键.类型Ⅲ中与Cl原子相连的Ga1-E键键级在1.0左右,为单键.对比3类化合物中Ga-E键的BD值可以看出,类型Ⅱ和类型Ⅲ中Ga-E键的BD值按E=P,As,Sb的顺序逐渐减小,说明这2类化合物中Ga-E键的强度按E=P,As,Sb的顺序逐渐减弱.该结论与键长变化得出的结论一致.
2.2 Ga-E键的电子密度拓扑分析
分子中的原子(AIM) 理论是一种有效描述化学键性质的理论,可以很好地描述化学键的性质[17].为了进一步探讨Ga-E(E=P,As,Sb)键的性质,对3类化合物中的Ga-E键进行了电子密度拓扑分析,得到的分子图,如图2所示.Ga-E键键鞍点处的电荷密度(ρb)、拉普拉斯量(∇2ρb)、能量密度(Hb)及动能密度与势能密度的比值(-Gb/Vb)等拓扑参数列于表2.
图2中的分子图显示,在类型Ⅰ化合物中,在2对Ga原子和E1原子间均有1个键鞍点存在,说明存在2个Ga-E1键.同时,2个Ga原子和2个E2原子间有4个键鞍点存在,并且从每个键鞍点出发均有1对键径连接Ga原子和相邻的E原子,形成Ga-E-Ga-E四元环结构.在类型Ⅱ化合物中,Ga-E键也有键鞍点和相应的键径,说明了Ga-E键的存在.同时,类型Ⅰ中桥连的E2原子与配体中的Si原子,端基的E1原子与2个配体中的Si原子之间,类型Ⅱ中E原子与环戊二烯负离子配体中的C原子之间,类型Ⅲ中Ga1原子与周围的2个N原子,E原子和Cl原子之间均有键鞍点存在,且键径的椭圆度较小,说明E原子与配体之间的作用较强.另外,类型Ⅰ中配体与配体之间存在双氢键,类型Ⅱ中Ga原子所在杂环中N原子上的H与E原子相连的五元环配体中的C—C键存在二级弱相互作用,类型Ⅲ中Cl原子与Ga2原子所在杂环中N原子上的H之间形成氢键.E原子与配体间以及配体与配体间的相互作用均有利于Ga-E键的稳定.

a.类型Ⅰ; b.类型Ⅱ; c.类型Ⅲ; 类型Ⅱ以E=As作为代表;黄球代表的是键鞍点.图2 3类含Ga-E键化合物的分子图Fig.2 Molecular Graphs of Three Types of Compounds Containing Ga-E Bond

表2 3类含Ga-E键化合物中的Ga-E键键鞍点处的电子密度拓扑指标Tab.2 Topological Parameters of Electron Density at the Bond Critical Points of Ga-E Bonds in Three Types of Compounds Containing Ga-E Bond a.u.
由表2可以看出,大部分Ga-E1和Ga-E2键键鞍点处的∇2ρb<0,6个键鞍点处的∇2ρb>0,所有Hb<0,所有-Gb/Vb均在0.5左右,按AIM理论标准[17-18],说明这2类Ga-E键均属于共价键.虽然所有Ga-E键键鞍点处的Hb<0,但Hb的数值很小,电荷密度ρb也很小,这些拓扑指标说明Ga-E键具有配位键特征[18],即给体-受体作用特征.电荷密度ρb是化学键强度的量度,一般来说,ρb越小,化学键越弱.由表2可以看出,同类型化合物中Ga-E键键鞍点处的ρb按E=P,As,Sb的顺序逐渐减小.类型Ⅰ和类型Ⅲ中,Ga-E1键的ρb大于Ga-E2键的ρb,说明Ga-E1键强于Ga-E2键.对比3类化合物中的Ga-E键发现,对于相同的元素E,Ga-E键ρb的顺序为类型Ⅰ<类型Ⅱ≈类型Ⅲ,说明类型Ⅰ中Ga-E键的强度弱于类型Ⅱ和类型Ⅲ中的Ga-E键强度.电子密度拓扑分析指标给出的化学键强度顺序与键长和键级给出的顺序相同.
2.3 Ga-E键的自然键轨道分析
自然键轨道(NBO)分析方法采用正则分子轨道的定域化处理,能够给出通常意义的化学键的成键图像,给出所计算分子中原子集居数、分子轨道类型及键级,用于直观地描述化学键或分子内/间的超共轭作用[16].
为了直观地说明3类化合物中Ga-E键的成键特征,选取E=As的化合物为代表进行了NBO分析.NBO计算的自然布居电荷和分子轨道图列于表3.可以看出,在3类化合物中,Ga原子为正电荷区,E原子为负电荷区.说明Ga原子作为缺电子中心,在与其他极性分子作用时,容易与带负电荷的给电子区相互作用,其中类型Ⅱ和类型Ⅲ中的Ga原子接受电子的能力更强.体系中E原子作为负电荷区,在后续的反应中容易得到电子.比较3类化合物中Ga原子所带的正电荷,可以看出,Ga原子的NPA电荷按类型Ⅰ、类型Ⅱ、类型Ⅲ的顺序依次增大,类型Ⅰ中Ga原子的NPA电荷明显小于类型Ⅱ和类型Ⅲ中Ga原子的电荷.因为类型Ⅱ和类型Ⅲ中的Ga原子均与1个E原子和2个N原子相连,所以二者NPA电荷接近.类型Ⅰ中的Ga原子连接的是3个E原子,E的电负性小于N原子的电负性,所以类型Ⅰ中Ga原子所带的正电荷明显少于类型Ⅱ和类型Ⅲ中Ga原子的NPA电荷.
轨道分析显示,类型Ⅰ中的2个Ga原子与4个E原子之间形成6个σ键,即每个Ga-E键均为σ单键.类型Ⅱ中的Ga-E键属于双键,包含1个σ键和1个π键.类型Ⅲ中Ga1-E键是单键,Ga2-E键是双键.分析轨道成分可知,3类化合物中的σ轨道来源于Ga原子和E原子杂化轨道间的重叠,π轨道的主要成分来源于E原子的p轨道,证实了Ga-E双键的给体-受体键性质.
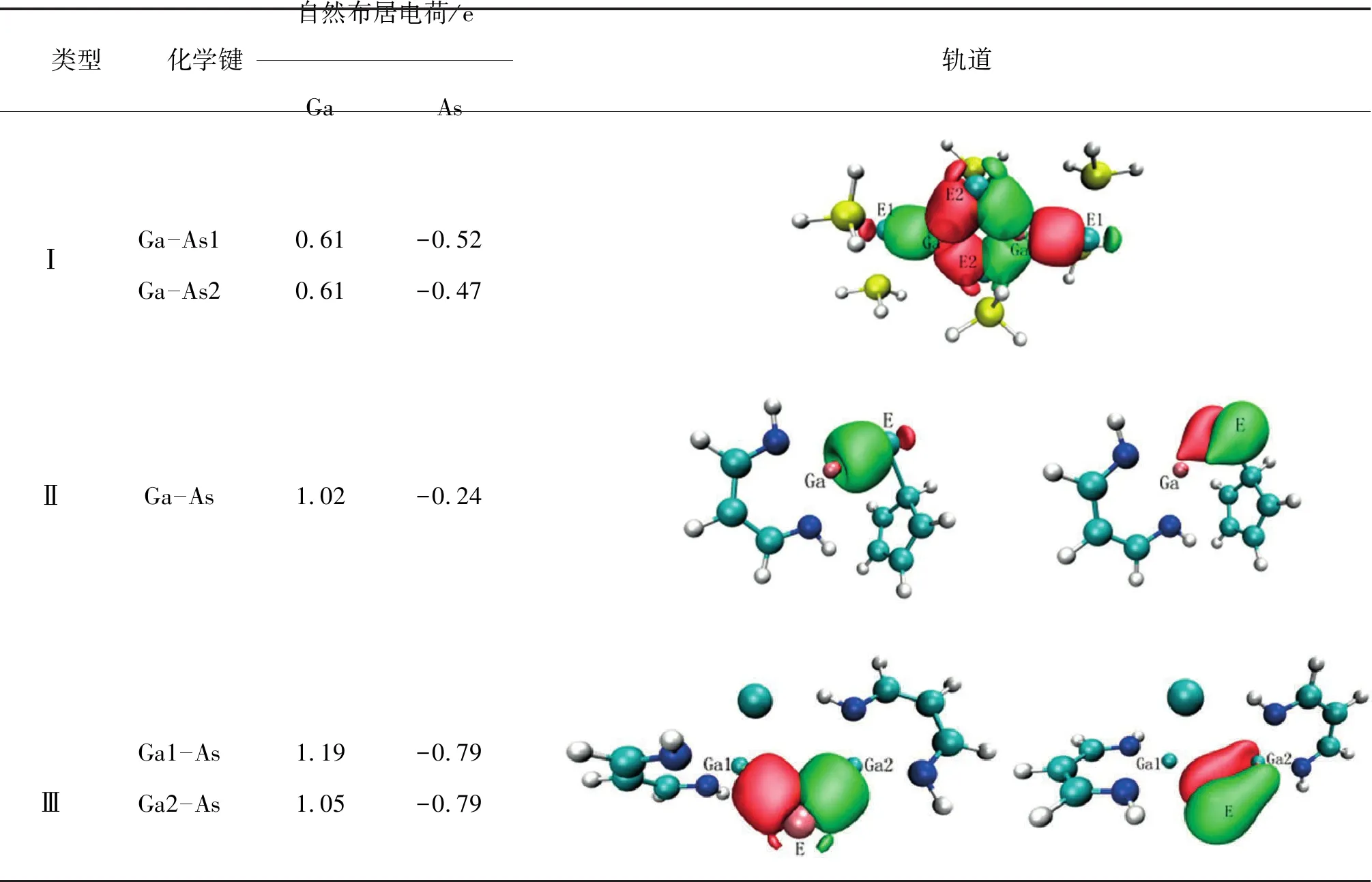
表3 3类化合物中Ga-E键的自然布居电荷和分子轨道Tab.3 Natural Population Charge and Ga-E Molecular Orbitals of Three Types of Compounds Containing Ga-E Bond
3 结 论
在PBEPBE/def2-SVP理论水平上研究了3类由第三/五主族重元素形成的含镓磷键化合物中给体-受体键的结构,通过电子密度拓扑分析方法和自然键轨道理论分析了这3类化合物中Ga-E(E=P,As,Sb)键性质,得到以下结论.
1) 类型Ⅰ中的2类Ga-E键均为σ单键,修正了文献中Ga-E1属于双键的说法;类型Ⅱ中的Ga-E键属于双键,包含1个σ键和1个π键;类型Ⅲ中的Ga1-E键是σ单键,Ga2-E键是双键.
2) 3类化合物中Ga1-E键的强度顺序为类型Ⅰ<类型Ⅱ≈类型Ⅲ;同种类型的化合物中,Ga-E键按E=P,As,Sb的顺序逐渐减弱.
3) 3类化合物中的Ga-E单键为共价键,Ga-E双键为给体-受体键,其中Ga为电子受体,E为电子给体.类型Ⅱ和类型Ⅲ中的Ga原子接受电子的能力更强.
