化学原料药制备工艺研究
2022-09-19陈希康
陈希康
(河北仁合益康药业有限公司,河北沧州 050000)
近年来,制药医药行业正处于迅猛发展中,企业生产设备日益完善,制药技术在不断突破。制药企业为在激烈的市场竞争中占有一席之地,不断引进新技术,研制新药品。化学原料药不仅对促进药物作用的发挥有积极意义,而且其数据对制备新药品有重要参考价值。所以,若要制备新药品、新试剂,就需在研制初期投入大量化学原料药,以确保研制成功。当下,医学界医药系统的主流趋势已向研制新药品(中西药结合)靠拢。我国是化学原料药生产大国,但制药工艺与发达国家有差距,在制备过程中,仍暴露出很多问题,我国大部分制药企业制备化学原料药的生产工艺和制药设备还很落后,对化学原料药的研究缺乏深度。为尽快扭住此种局面,制药企业研究人员应不断更新自身知识储备,持续学习制备化学原料药的最新生产工艺,只有深入研究化学原料药的生产工艺,才是制药行业实现可持续发展的根本所在,才能为制药行业赶超国际前沿水平增添助力。
1 化学原料药制备研究的一般过程
化学原料药制备研究过程大致可分成以下六个阶段:第一,确定目标化合物。第二,设计合成路线。第三,制备目标化合物。第四,判断结构是否正确。第五,优化改进生产工艺。第六,中试放大研究、推进工业化生产。上述六个阶段是对化学原料药制备研究的一般过程,但这六个阶段并非依次进行,更不是一蹴而就的,而是研究人员经过反复推敲、调整、改进才可成功完成最终制备研究。因而,在制备研究初期,研究人员需综合分析多种现有因素,全面评估后续阶段的工作难度及可行性,规避半途而废的不良情况。除此之外,需清楚认识到:化学原料药的制备研究仅是药品研究的早期阶段,后期制备工艺会受到质量、安全性、有效性等多种因素的影响,其要求也会出现新的变化。就拿我国现有的化学药品分类体系来说,若化学原料药类别不同,其制备研究过程中呈现的特点便会存在较大差异。例如创新药,动态变化、优化调整为化学原料药制备工艺研究的典型特征,即便药品上市后,可能还会进行持续性改进和调整。而仿制药则大不相同,因市面上已有同品种药品,研究人员可在对已上市药品质量进行全面对比分析后,再决定采取何种制备 工艺。
2 化学原料药制备工艺基本内容
2.1 制备工艺的选择
化学原料药制备工艺不仅极其复杂,而且对操作技术有着超高的标准要求。若研究人员在制药过程中出现一点疏忽,都会给后期各相关工作带来严重后果,引起一系列医药事故,威胁制药人员生命安全等。所以,选取何种制备工艺在制备化学原料药的过程中发挥着举足轻重的作用。一般来说,药品化学反应分析法和分离纯化法是两种常用的制备工艺方法,制备工艺的选择需视药品制备需求而定[1]。在制备化学原料药时,应将药品化学反应排在第一位,然后再进行药品制备。在有机合成化学深入发展的背景下,其在制备研究化学原料药中的应用范围愈发广泛。借助有机合成化学,可对微小、结构不明的分子物质具备更充分的认知,对提炼新型药品试剂有积极意义。同时,在化学原料药的制备过程中,还需确保结构分子之间能产生良好化学反应,故应将该因素纳入选择制备工艺方法的考量范围内。此外,分离纯化法在制备化学原料药中的使用频率也很高,使用此法需注意的一点是,需从整体分析考虑制备原料、设备、外部影响因素等。只有严格把控各制备环节的安全稳定性,才能确保生产出来的化学原料药与标准要求相符。
2.2 制备工艺数据的积累
制备化学原料药的过程中,应对制备工艺数据做出系统化积累。只有持续积累制备工艺数据,制备工作才能具备可持续性研究的基础。化学原料药制备本就是一项长期复杂的艰巨任务,每个阶段的实验数据对后续实验都有着极其重要的参考价值。制备工艺数据若出现任何失误,都提示化学原料药制备工作的失败已成定局,如此,整体制备工作便会蒙受严重损失,研究人员的人身安全也无法得到可靠保障。所以,构设系统化的制备工艺数据积累库至关重要,制药研究人员以此为参考,便可对医药产品的稳定性与新药品试剂的可行性做出更精准的判断。此外,积累制备工艺数据对构建过程控制方法和终点检验标准有重要意义,通常,以质量标准的杂质限度为衡量基准,研究人员还需借助工艺分析数据来完成对制备工作的深入研究[2]。
2.3 制备工艺过程控制
制备化学原料药时,需严格把控各制备环节质量,对每个步骤进行仔细检查(图1)。最终制药生产检测并不单单是对制备终点进行检验,而是对初级注册、各项制备中间体、后期重点检验等制备工艺过程进行整体检验。制备中间体、各制备环节均需对原料药的质量和纯度做出可靠保障,将杂质水平控制在最低限度内。如:若要制备新药品试剂,申报注册阶段就应建立过程控制关键点、中间点及最终的质量标准。实际操控过程,更应严格把控原料、所用器皿及反应物的质量,同时,必须使用经验证合格的制备工艺等。灵活使用多种控制手段,最大限度地确保制备药品的质量和标准相符。
图1 制备工程过程
2.4 起始原料和试剂
化学原料药都是从纯度较低的商业化原料及试剂进行早期制备研究的。通常来说,制备工艺中的起始原料及试剂都会有明确的化学名称、结构、分子式,已有文献对其化学性质、杂质情况做出详细说明,申报注册阶段需附上具体参考文献[3]。若无文献支撑,就需将其看作全新化合物,制药者应深入研究该全新化合物的制备工艺、结构、杂质、稳定性等特征,成立合理的过程控制要求和重点检验标准,在申报注册时,提供研究资料。大多数人可能认为溶剂并不会对制备工艺及产品质量产生较大影响,但如果化学原料药精制溶剂出现某种变化,原料固体形态很可能会出现较大改变。溶剂溶解速度、制剂释放溶出速度、生物利用度等诸多因素都会使化学原料药的晶型、粒度、表面积等固体形态受到直接影响,所以,溶剂变化直接关乎着药品有效性和安全性[4]。就拿难溶解的化学原料药来说,若其溶剂是混悬液或固体制剂,该现象会更为明显 (图2)。
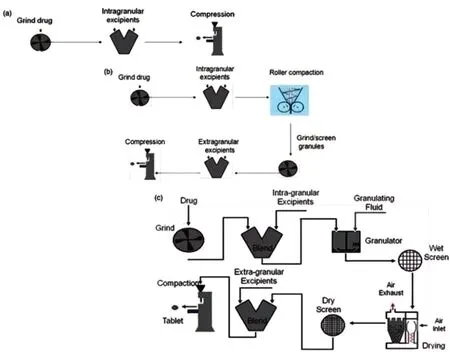
图2 化学原料药制备流程
3 优化化学原料药制备生产工艺的措施
3.1 综合考虑影响因素,保证制备过程的稳定性
制备新药品新试剂的过程中,制药者需基于多种因素的综合考量,对制备工艺做出最优化选择。只有使用科学合理的制备工艺,才能使化学原料药质量得到最可靠保障。新药品新试剂的制备研究包含多种制备工艺,更需经过多次检测。药品化学反应和分离纯化法是两种使用率最高的制备工艺。由于药品制备过程十分复杂,研究人员不仅要熟练使用各种制备工艺,还应全面了解制药影响因素(主观和客观因素)。如:在进行化学原料药制备时,制药者需综合考虑原料试剂的可获得性、生产设备、操作人员、制药成本、产品兼容性等多种因素,在对各影响因素进行细化分析后,选择最佳制备工艺[5]。只有充分考虑到各影响因素的每个细节,并作出应对处理,才能使药品制备的稳定性、重现性得到有效保障。
3.2 成立制备工艺质量控制标准,确保制药安全性
若要成功制备化学原料药,离不开严格制备工艺标准的约束。只有紧抓制备工艺各环节质量,才能最大限度地保障制药质量和安全性。研发新药时,需严格检验制备试剂和起始原料。参考制备工艺质控标准,详细注明试剂和原料的化学名称、结构、分子式。在申报注册阶段,详细标记试剂和原料的化学性质、特征和所含杂质[6]。依照已发表参考文献对试剂和原料进行辅助标记,在申报注册时随研究资料一起提供。新型化合物则需依照试剂和原料检测结果,成立新的检查标准,并做好该化合物稳定性、分子式、杂质等研究内容的详细标记。
3.3 加强对制备工艺细节的质量控制,不断降低杂质水平
化学原料药的制备过程包含众多环节,从整体来说,可谓是一项复杂且艰巨的任务。在制备化学原料药时,需严格检验各制备工艺环节的细节和质量。一般来说,化学原料药的制备由确定目标化合物、设计合成路线、制备目标化合物、结构确证等六个阶段组成。各个阶段都需研究人员投入百分之百的精力去深入研究并持续推敲改进,保证无任何操作失误等不良现象,最大限度地确保制药工作的可行性。若已完成化学原料药的后期制备工作,还要全面检查、综合评估新药品性能和特征。所以,在制备化学原料药的过程中,先进制备工艺技术作为先决条件,其重要性不言而喻,但各制备环节的质量同样不可忽视,只有严抓细节,才能有效提升制药质量,将杂质水平降低到最小范围内。
4 结论
制备工艺的设计、选择、实施过程直接决定了产品质量。产品质量的好坏是由设计到生产这一整体过程的质量而定。检验结果直接代表着产品质量,然而,检验项目或检验方法都仅仅是从某些方面反映了产品质量[7]。产品用途是衡量产品质量好坏的重要标准,如药品的安全性和有效性是否可靠是评估其质量的重要指标。所以,在选择制备工艺时,认为只要原料药纯度符合要求便代表制备实验的成功的观点是片面的,制药者应基于制备工艺设计、实施、改进等过程的综合考量来评估药品的安全有效性和质量。此外,合适的制备工艺技术完全能支撑连续、稳定的高质量生产,所以,检验工作也是制备工艺研究的重要一环。虽然指导原则尚未对验证技术要求做出详细说明,但制药者仍需遵循过程控制理念。制药企业需充分认识到工艺验证对保证药品质量稳定性的重要作用,依照相关标准要求,严格落实工艺验证的工作,将药品生产、质控的风险系数降至可控范围内。我国虽是化学原料药生产大国,但仍需积极引进国外先进工艺技术,吸取国外先进经验,并不断优化改进化学原料药制备工艺,深入分析研究药品研制和检验,研发高质量、高纯度的药品,以更好地助力医药行业稳定发展。
