大鼠阴茎海绵体内皮细胞的分离培养与鉴定*
2022-09-18瑾阿尔孜古丽吐尔逊刘凤霞阿地力江伊明斯依提阿木提侯鹏程
靳 瑾阿尔孜古丽吐尔逊刘凤霞阿地力江伊明斯依提阿木提侯鹏程
1.新疆医科大学基础医学院人体解剖学教研室(新疆乌鲁木齐830011);2.新疆医科大学第一附属医院临床研究院
阴茎海绵体组织主要由阴茎海绵体内皮细胞(corpus cavernosum endothelial cells,CCECs)、平滑肌细胞等组成[1]。 在勃起过程中,CCECs 和平滑肌细胞在调节海绵体窦血流充盈和维持血管张力中起关键作用[2]。 内皮功能受损是导致勃起功能障碍(erectile dysfunction,ED)的重要原因之一,不同类型ED 的研究结果提示,阴茎海绵体组织均存在不同程度的内皮细胞功能改变和平滑肌纤维化现象[3-5],而在血管性ED的发生发展中,CCECs 的损伤更是造成ED 的主要危险因素[6]。 以往在ED 的体外研究中,通常以人脐静脉内皮细胞作为研究对象,但由于生长于不同器官和血管的内皮细胞具有异质性,其表型、功能、代谢特征等方面均有所不同[7],因此无法准确反应CCECs 在ED 的发病过程中所发挥的作用。 而CCECs 覆盖于基质表面形成阴茎海绵体窦成为阴茎组织中独特的血管床[8],而血管损伤引起的ED 通常还作为全身内皮功能障碍的指标,甚至还有可能是心血管疾病的预警信号[9],因此,探索原代培养CCECs 的方法,将更有助于研究血管性ED 等疾病的发病机制,为后续体外ED 模型制备及药物实验提供新载体。
资料与方法
一、资料
(一)实验动物
SPF 级性成熟期雄性Sprague-Dawley 大鼠,体重(250±10)g,购于新疆医科大学实验动物中心。 该实验在处理动物过程中,严格遵循新疆医科大学实验动物伦理章程。
(二)主要实验仪器
CO2培养箱(美国Thermo 公司);高速台式低温离心机(德国Eppendorf 公司);酶标仪(美国Bio-Rad 公司);荧光倒置显微镜(日本OLYMPUS 公司);激光共聚焦(德国Leica 显微图像采集系统);精密电子天平(德国sartorius 公司);-20℃冰箱(中国海尔公司);培养瓶及培养皿(美国康宁公司)。
(三)主要试剂
EGM-2(微血管内皮细胞毛长介质-2)内皮细胞生长培养基(CC-3162,Lonza,瑞士)、胎牛血清(04-001-1ACS,BI 公司,以色列)、抗CD31 抗体(ab24590,Abcam,英国)、抗VWF 单克隆抗体(AF3000,Affinity Biosciences,美国)、Cy3 ©山羊抗兔IgG H&L(ab6939,Abcam,英国)、FITC 山羊抗小鼠IgG H&L(ab6785,Abcam,英国)、Ⅱ型胶原酶(17101015,Gibco 公司,美国)、无菌PBS、0.25%胰蛋白酶-0.02%EDTA 消化液、青/链霉素双抗均购自于美国Gibco 公司。
二、方法
(一)大鼠CCECs 的原代培养
SD 大鼠适应性饲养1 周,2%戊巴比妥钠麻醉,5min大鼠瘫软。 在无菌环境下,暴露大鼠阴茎及阴茎头,沿包皮剪开,分离阴茎组织,紧贴阴茎根部取下阴茎组织后将大鼠进行脱颈处死。 将组织放入含2%青/链霉素的PBS中浸泡5min。 剪除阴茎头和阴茎软骨,分离筋膜、结缔组织,剥离尿道海绵体、阴茎背深静脉,分离阴茎海绵体外部白膜。 用含双抗的PBS 反复冲洗海绵体组织后,剪成约1mm3的组织块,移至5mL EP 管中,加入1mL 0.5%Ⅱ型胶原酶消化液,组织块剪成肉糜状,移入15mL 离心管内,加入组织块3 倍体积的0.5%Ⅱ型胶原酶消化液,于37℃环境下进行消化,每隔15min 震荡2min。 至组织块完全消化后,加入EGM-2 完全培养液终止消化,无菌200目滤网过滤细胞悬液,1000rpm 离心6min,弃上清,加3mL PBS 吹打混匀,1000rpm 离心5min,弃上清,加入5mL EGM-2 完全培养基吹打混匀后接种于培养瓶,37℃、5%CO2的培养箱中培养。
(二)大鼠CCECs 的纯化
原代培养48h 时首次换液,继续培养至96h 时,镜下观察细胞并在培养皿底部标记CCECs 细胞团位置,刮除其他部位的杂细胞团,PBS 清洗2 遍,加入EGM-2培养基继续培养。
(三)大鼠CCECs 的传代培养
待单层细胞融合至70% ~80%,1mL 胰酶消化,镜下观察贴壁细胞收缩变圆脱落后,加2mL EGM-2 完全培养液终止消化,1000rpm 离心5min,弃上清,PBS 清洗一遍,1000rpm 离心5min 弃上清,加EGM-2 完全培养基吹打混匀后,1 ∶2 进行传代培养。
(四)HE 染色观察大鼠CCECs 细胞形态
取第2 代细胞爬片后,4%多聚甲醛室温固定细胞2h,预冷的1 ×PBS 洗5min×3 次,苏木素染色90s,自来水冲洗10min,盐酸分化1s,氨水反蓝20s,自来水冲洗5min,伊红染色90 ~120s,自来水冲洗5min,梯度酒精脱水透明,封片后进行镜下采图。
(五)绘制大鼠CCECs 生长曲线
取第2 代CCECs 制备细胞悬液,按照5×104个/mL的浓度均匀接种于96 孔板,每24h 取6 孔细胞加入10μL CCK8 溶液,37℃孵育4h 后在450nm 处读取OD值,连续测量10 天,绘制CCECs 生长曲线。
(六)大鼠CCECs 免疫荧光鉴定
取第2 代CCECs 细胞爬片后,4%多聚甲醛室温固定细胞2h,预冷的1 ×PBS 洗3 遍,滴加0. 5% Triton X-100 通透15min,PBS 洗5min ×3 次,滴加山羊血清,室温封闭30min,倾去封闭液后即加入抗体vWF 和CD31,4℃孵育过夜,PBS 洗涤后加入荧光二抗,37℃避光孵育1h,室温滴加DAPI (4',6-二脒基-2 苯甲吲哚)染核10min,PBS 洗5min×3 次,荧光倒置显微镜下观察并采图。
(七)流式细胞术检测第1 ~4 代大鼠CCECs 的细胞周期变化
取1 ~4 代大鼠CCECs 细胞,按照1×106个/mL 浓度制备细胞悬液并在预冷的70%乙醇中4℃固定过夜,1000rpm 离心5min,弃上清,PBS 清洗后收集细胞沉淀,加 入100μg/mL 的 RNAnase 酶37℃孵 育30min,50μg/mL的PI(碘化丙定)染液避光孵育30min,200 目滤网过滤后上机检测。
(八)激光共聚焦检测第1 ~4 代大鼠CCECs 中vWF 的表达变化
取1 ~4 代大鼠CCECs 细胞,方法步骤同(六)进行免疫荧光染色,激光共聚焦显微镜观察第1 ~4 代内皮细胞中vWF 的表达并采图。
结 果
(一)倒置显微镜下观察细胞培养结果
原代培养至第4 天时可在镜下观察到细胞团呈发散状向四周生长,贴壁细胞呈短梭型、多触角型(图1A);培养至第7 天时镜下可见贴壁细胞镶嵌排列于同一平面,呈典型的“铺路石样”成团生长(图1B);培养至第11 天时,可见细胞融合到70%左右,随细胞数目增加而形成单层铺路石样排列(图1C),可进行传代。

图1 原代培养大鼠CCECs 结果
(二)HE 染色观察细胞形态
HE 染色结果显示,正常2 代细胞形态较均一,细胞单层排列,保持“铺路石样”外观(图2A),细胞呈多角形,核大而清晰,呈卵圆形居中,有较为明显的2 ~4枚核仁(图2B)。

图2 传代培养大鼠CCECs HE 染色
(三)大鼠CCECs 生长曲线
第2 代内皮细胞增殖速度明显增快,生长曲线为“S”形,在细胞培养的第1 天细胞开始生长,但速度较慢;第2 ~4 天生长加快,进入对数生长期;第4 天后内皮细胞增殖缓慢;第6 天开始细胞进入平台期(图3)。

图3 大鼠CCECs 生长曲线
(四)vWF、CD31 免疫荧光染色鉴定结果
取第2 代细胞进行vWF 和CD31 免疫荧光共染,检测内皮细胞标志物表达情况,结果显示,vWF 在细胞质中稳定的表达为红色荧光(图4B),CD31 在细胞质中稳定的表达为绿色荧光(图4C),通过分析,vWF 和CD31 免疫荧光共染的双阳性表达率为(86. 19 ±1.14)%,符合内皮细胞特征,提示大鼠CCECs 原代分离、培养成功。
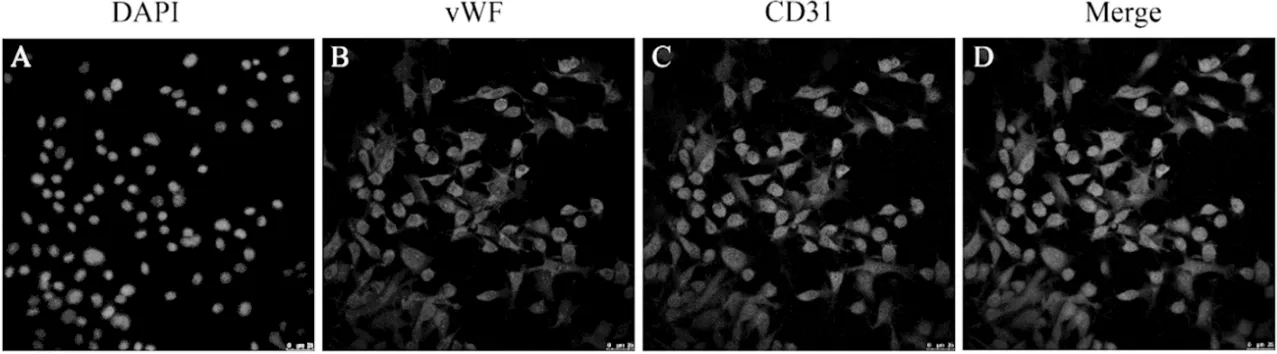
图4 vWF、CD31 免疫荧光染色结果
(五)第1 ~4 代CCECs 的细胞周期变化检测结果
结果显示,随着传代次数的增加,静止期(G0/G1期)细胞数量逐渐增加,S 期(DNA 合成期)细胞数量依次减少,当传至P4 代时,细胞增殖周期逐渐阻滞在G0/G1 期(图5),增殖速度减慢,提示,第2、3 代细胞生长周期稳定,可用于后续实验研究。

图5 流式细胞术检测细胞周期结果图
(六)第1 ~4 代CCECs 中vWF 表达变化激光共聚焦检测结果
结果显示,vWF 稳定表达于各内皮细胞的细胞质中,呈现红色,同时可见在第2 ~3 代,内皮细胞标志物vWF 的表达较高,而在第4 代细胞vWF 的表达明显降低,同时可见细胞形态不一,并出现细胞萎缩、胞质边界部位的形态学改变,提示第4 代细胞出现了衰老,并进而导致内皮细胞标志物vWF 表达降低(图6)。 该结果与第1 ~4 代CCECs 的细胞周期变化结果相对应,进一步揭示了大鼠CCECs 的生长规律,并提示采用第2、3代细胞进行后续实验可行。
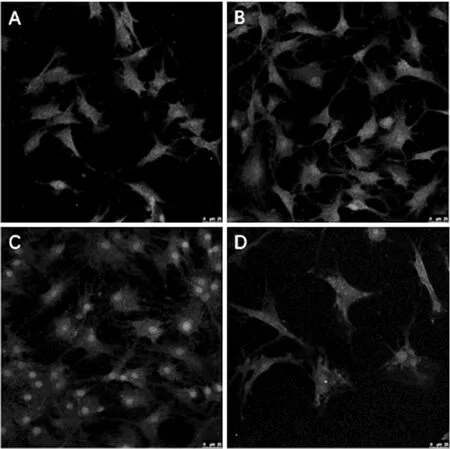
图6 传代培养大鼠CCECs 中vWF 荧光结果
讨 论
阴茎组织主要由一对阴茎海绵体和一个尿道海绵体构成,在接收到性刺激信号时,CCECs 释放一氧化氮(nitric oxide,NO)并作用于平滑肌细胞,激活可溶性鸟苷酸环化酶(solubleguanylatecyclase,sGC),增加细胞内环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)浓度,降低平滑肌细胞内Ca2+浓度,使平滑肌松弛,血液经海绵体动脉流入海绵体,在白膜的压迫下,海绵体充血膨胀,发生勃起[10,11]。 NO/sGC/cGMP 作为促进阴茎勃起的经典通路,NO 的持续稳定输出在信号通路传导过程中至关重要[12]。 NO 作为许多细胞过程和生物学功能的重要信号分子,主要由三种一氧化氮合成酶(nitric oxide synthase,NOS)的同工酶,即内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、神经型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)催化产生[13]。 iNOS 作为钙非依赖性的NOS,其诱导的NO 的生成量主要是在转录水平上控制的[14],nNOS 催化产生的NO 受神经传递信号的调控[15],而在内皮细胞中,eNOS 在将L-精氨酸转换为L-瓜氨酸的反应中产生NO,因此,内皮功能主要基于eNOS 的功能和活性[16]。 当CCECs 结构受损时,NO 的产生减少,进而可导致ED 的发生。 在我们以往开展的糖尿病性ED、复合应激性ED 等相关研究结果均显示,海绵体内皮细胞均存在不同程度的功能损伤和平滑肌纤维化现象[17,18],亦有报道认为[19,20],高血压、心血管疾病,甚至新冠肺炎患者发生ED 的原因均与阴茎海绵体内皮功能受损相关,上述结果均表明血管内皮系统的完整性是正常勃起功能所必需的,CCECs 在阴茎勃起的过程中占有不可或缺的地位[21],更由于我们在后续研究中发现,在复合应激ED 的发生发展过程中,氧化应激、慢性炎症和神经内分泌功能改变均与内皮细胞功能障碍有着密切的联系和可能的因果关系[22-24],因此,建立一种简便高效的大鼠CCECs 原代培养方法,对我们进一步开展氧化应激、慢性炎症等因素产生的相关特异性分子和内皮细胞功能障碍之间的关系研究成为必须,同时对研究内皮相关性功能改变与ED 关系及其药物筛选方面具有重要应用价值。
目前关于CCECs 原代培养研究主要来源于人、兔和小鼠[25-27],但人源组织来源稀缺,兔的繁殖速度较慢,而小鼠的阴茎组织较小,现有的方法无法较好满足实验需求。 SD 大鼠因其价格低廉、繁殖力强等优点常作为糖尿病ED、高血压ED 和高血脂ED 等ED 模型的首选实验动物[28-30],因此本实验最终选择了SD 大鼠,分离其阴茎海绵体组织,并探讨了建立大鼠CCECs 的方法。
CCECs 的培养方法主要包括组织块培养法[25]和酶消化法[31]两种。 组织块培养法虽然操作简单、成本较低,但培养细胞所需的组织较多、培养周期长,容易污染,而以往的酶消化法采用多种消化酶,花费高昂、操作繁琐,因此,在本研究中我们采用了Ⅱ型胶原酶消化法联合机械刮除法获取原代SD 大鼠CCECs,并开展了研究。 本实验将0.5% Ⅱ型胶原酶消化时间控制在2 ~2.5h,每隔15min 震荡2 ~3min,可减少整体酶消化时间,最大程度保证细胞活性。 在原代培养48h 后进行首次换液,以保证活细胞已全部贴壁,因细胞群在原代培养3 ~4 天时开始生长,故于原代培养96h 时,采用细胞刮除法清除独立成片和散在分布的平滑肌细胞与成纤维细胞群,可有效避免成纤维细胞等杂细胞污染,获得较高纯度的内皮细胞。 既往原代培养内皮细胞的文献报道中,多采用M199 培养基、DMEM 高糖培养基、DMEM/F12 培养基等为基础培养液[32-34],添加血清及生长因子进行原代培养,综合考虑高糖培养液可能对实验结果的干扰,以及保证细胞最佳活力等因素,我们采用添加多种生长刺激因子的EGM-2 内皮细胞专用完全培养液,以促进内皮的生长,保证原代内皮细胞培养的成功率。 原代培养至第4 ~5 天时,细胞汇合成单层,呈铺路石样镶嵌式排列,传代培养至第2 代时绘制生长曲线,细胞在第2 ~4 天进入对数生长期,培养至第6天时进入平台期,呈“S”形生长。 第2 ~3 代细胞形态均可保持内皮细胞典型的“铺路石样”特征,HE 染色可见细胞呈扁平的多角形,细胞核卵圆居中,核仁可见,且vWF 在CCECs 的胞质内的表达和细胞生长周期较为稳定,原代细胞传至4 代后,细胞出现胞质增大衰老、杂细胞增多等现象,且细胞逐渐阻滞于G0/G1 期,因此我们选择第2 ~3 代CCECs 进行后续研究。 CD31又称为血小板内皮细胞黏附分子在血管内皮细胞内以及胞间连接处广泛表达[35]。 vWF 即血管性血友病因子,作为一种多聚糖蛋白,在内皮细胞中合成[36],CD31和vWF 共同阳性表达是目前对原代提取内皮细胞鉴定其表型的通用做法,并得到学者们的广泛认同[5,37]。 本研究结果显示CD31 和vWF 免疫荧光共染鉴定内皮细胞均为阳性表达率达(86.19±1.14)%,表明酶消化法结合机械刮除法可成功获得CCECs,并且第2 ~3 代CCECs 可作为后续实验研究的最佳选择时期。
综上,本研究采用酶消化法结合机械刮除法,运用EGM-2 培养液可成功分离培养大鼠CCECs,镜下呈典型的“铺路石”状生长,vWF 和CD31 免疫荧光阳性反应,纯度达到(86.19±1.14)%,并可稳定维持3 ~4 代,为基于CCECs 基础上开展相关研究提供可靠简便的细胞模型建立方法,如能建立起稳定传代的CCECs 永生细胞系,可为男科领域开展基于CCECs 层面的基础研究与药物筛选带来极大的便利和更多的选择。
