水杨酰芳胺衍生物通过抑制STAT-3对肝癌HepG-2细胞的影响
2022-09-17胡敏华邾枝花
胡敏华 邾枝花
我国是乙型肝炎病毒感染的高发区,也是肝癌发病的高发区[1-2]。由于肝癌早期无明显临床症状,肝癌患者一旦发现病情发展都处于中晚期,化疗是中晚期肝癌治疗的主要方式,目前应用于治疗肝癌的靶向药主要有索拉非尼(Sorafenib )、仑伐替尼(Lenvatinib)及纳武单抗(nivolumab),以上靶向药主要的靶点是EGFR、VEGFR、PDGFR-α等。随着时间的推移,目前治疗肝癌的靶向药耐药性也逐渐显现,针对新靶点肝癌治疗药物的研发迫在眉睫。
信号转导及转录激活因子3(STAT-3)可能与肝癌的发生早期阶段有一定关系,同时STAT的过度表达与肝癌的病理分期呈正相关性,阻断STAT-3的磷酸化可发挥抑制肝癌晚期肿瘤细胞的侵袭和转移能力,从而影响肝癌患者的预后及生存期。STAT-3是STAT家族中的重要一员,STAT-3也是与肿瘤的发生和发展关系最密切的转录因子之一[3-4]。肝癌作为致死率较高的癌种,其与STAT-3过度活化之间的相关性也引起了越来越多研究者的关注[5]。笔者前期实验也证实了水杨酰芳胺衍生物N-(3-氯-4-氟苯基)-2-羟基-4-(3-(哌啶-1-基)丙氧基)苯甲酰胺(NPBM)和N-(3-氯-4-氟苯基)-2-羟基-4-(3-吗啉丙氧基)苯甲酰胺(NMBM)对表皮鳞癌A431细胞和肺腺癌A549细胞的增殖具有不同程度的抑制作用,且能通过抑制肿瘤细胞中表皮生长因子受体(EGFR)活性及STAT-3发挥抗肿瘤活性[6],因此本试验拟研究化合物NPBM和NMBM对肝癌HepG-2细胞中STAT-3的影响,期望合成化合物通过作用于STAT-3发挥抗肝癌的作用,研究出新靶点的抗肝癌靶向制剂。
1 材料与方法
1.1 材料
1.1.1 实验仪器 CP225D万分之一电子天平(Sartorious);ZF-7三用紫外灯(上海嘉鹏科技有限公司);SCV-4A1垂直流超净台(新加坡艺思高科技有限公司);Thermo 3111型CO2培养箱(美国Therm-Electron公司);Eclipse TS100-FDH1型倒置光学显微镜(日本 Nikon公司)Spectramax M2e 多功能酶标仪(美国Molecular Devices公司);Mini PROTEAN 3 电泳及转膜装置(美国 BIO-RAD公司)。
1.1.2 药品与试剂 化合物NPBM、化合物NMBM(实验室合成经四大光谱确证结构);氯硝柳胺(安徽东盛制药有限公司生产);STAT-3、phosphor-STAT-3、Jak、Bcl-2、兔抗人Stat-3 抗体(一抗)及FITC标记羊抗兔IgG(二抗)均购自武汉博士德生物技术有限公司;培养液DMEM及McCoy's 5a、0.25%胰蛋白酶、PBS及DMSO购自上海吉诺医药生物技术有限公司;胎牛血清购自杭州四季青生物工程材料有限公司;细胞固定用多聚甲醛由本实验室自行配制。
1.1.3 细胞 人肝癌HepG-2细胞购自中科院上海细胞库。
1.2 方法
1.2.1 MTT法检测化合物对肝癌细胞HepG-2增殖活性的影响 采用MTT法检测化合物NPBM和NMBM在不同浓度对肝癌细胞HepG-2的影响,并选用氯硝柳胺作为阳性对照药。取对数生长期的肝癌细胞HepG-2,分别以2×104个/mL细胞密度接种于96孔培养板中,100 μL/孔,每种细胞各种4块板。置于37 ℃,5% CO2孵箱内培养12 h。吸弃上清液,然后分别加入200 μL不同浓度的NPBM、NMBM。同时设阳性对照药组和不含药物的细胞对照组,每组设4个复孔。培养24 h后,再加入5 mg/mL的MTT 20 μL/孔,继续培养4 h后吸弃上清,加入DMSO 150 μL/孔,微振荡器上振荡10 min,将试剂对照调零,用自动酶标仪在570 nm波长处测出细胞对照组和各药物组的OD值,取各组均值,重复实验3次。以下面的公式计算各组药物对细胞的抑制率IR=(1-药物组OD值/细胞对照组OD值)×100%,同时计算IC50值。
1.2.2 荧光免疫试验 取对数生长期肝癌细胞HepG-2于24孔板中培养(约5×103/孔),培养24~48 h后(70%汇合度),加入预先配置好的不同浓度待测药物(1.0×10-4,3.3×10-5及1.0×10-5mol/L),经孵育24 h后,弃培养液,多聚甲醛溶液室温固定细胞15 min,PBS洗净后加入致孔剂Triton 100(浓度为0.3%),室温静置30 min,PBS洗净后封闭液(10%山羊血清)覆盖标本表面37 ℃孵育1 h,洗净后加一抗4 ℃孵育过夜,第2天37 ℃复温1 h,FITC标记二抗以合适浓度稀释于PBS,覆盖标本表面,37 ℃避光孵育1 h,加DAPI荧光试剂核染,5 min后PBS润洗三遍,于荧光显微镜下拍照记录。通过CCD成像系统读取绿色部分荧光强度。
1.3 统计学分析 采用SPSS 17统计软件处理数据,多组间数据进行比较采用单因素方差(ANOVA)进行分析,实验数据进行比较,以P<0.05为差异有显著性意义。利用Graph- Pad Prism 5.0软件进行实验数据相关图形的绘制。
2 结 果
2.1 化合物NPBM和NMBM对HepG-2肝癌细胞增殖活性影响情况 MTT法显示不同浓度化合物NPBM和NMBM及阳性对照药氯硝柳胺对肝癌细胞HepG-2的影响,结果如图1所示,不同浓度化合物NPBM和NMBM(1.56,3.12,6.25,12.5,25,50和100μmol/L)对肝癌HepG-2细胞的增殖均具有不用程度的抑制作用。氯硝柳胺、化合物NPBM和NMBM对HepG-2细胞logC分别为-4.627、-4.092、-4.314。

图1 化合物NPBM和NMBM对HepG-2的影响
2.2 化合物NPBM和NMBM对HepG-2肝癌细胞STAT-3表达的影响 荧光免疫实验显示化合物NPBM和NMBM对HepG-2肝癌细胞中STAT-3的表达具有一定的抑制作用(见图2),其中化 合 物NPBM浓 度 为10-4mol/L、3.3×10-5mol/L及10-5mol/L对HepG-2肝 癌 细 胞 中STAT-3表达总量均具有显著抑制作用,化合物NMBM浓度 为10-4mol/L及10-5mol/L对HepG-2肝 癌 细 胞中STAT-3表达总量具有轻度抑制作用,化合物NMBM浓度3.3×10-5mol/L对HepG-2肝癌细胞中STAT-3表达总量无抑制作用。
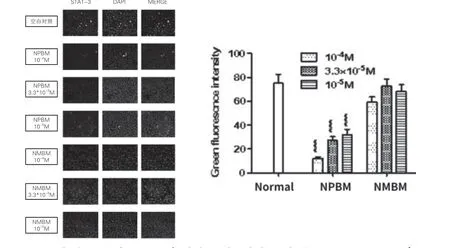
图2 化合物NPBM和NMBM对HepG-2肝癌细胞STAT-3表达的影响
3 讨 论
STAT-3蛋白与多种肿瘤的关系极为密切,STAT-3蛋白在超过70%的人类肿瘤中呈过度活化,主要通过调控促癌相关基因参与肿瘤细胞的异常增殖、侵袭转移、血管生成和免疫逃逸等过程[7-8]。近年来有研究表明,STAT-3可能与肝癌的发生早期阶段有一定关系,同时STAT的过度表达与肝癌的病理分期也呈正相关,阻断STAT-3的磷酸化可发挥抑制肝癌晚期肿瘤细胞的侵袭和转移能力,从而影响肝癌患者的预后及生存期[9]。
基于以上研究背景,本研究选取了前期合成的化合物NPBM和NMBM作用于HepG-2肝癌细胞,结果显示化合物NPBM和NMBM能够抑制HepG-2肝癌细胞的增殖,同时不同浓度的化合物NPBM对HepG-2肝癌细胞中STAT-3表达总量均具有显著抑制作用,化合物NMBM对HepG-2肝癌细胞中STAT-3表达总量抑制作用较轻。
综上所述,化合物NPBM和NMBM能够抑制肝癌细胞,作用机制可能与抑制STAT-3信号通路有关。
