动态调控谷氨酸棒状杆菌合成4-羟基异亮氨酸
2022-09-17来文梅谭书煜史锋
来文梅,谭书煜,史锋*
1(食品科学与技术国家重点实验室(江南大学),江苏 无锡,214122) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
糖尿病是一种慢性代谢紊乱疾病,以Ⅱ型糖尿病最为常见,并且会带来一系列的并发症。早在20年前人们就发现葫芦巴种子中的活性成分4-羟基异亮氨酸(4-hydroxyisoleucine,4-HIL)具有促进胰岛素分泌的生物活性[1]。随着时间的推移,不断地有研究证明了4-HIL不仅能促进胰岛素的分泌,还具有改善胰岛素抵抗,调节脂肪代谢的功能,从而能够降低血糖血脂[2-4]。因此,4-HIL在治疗糖尿病以及肥胖症方面具有较大的应用前景。
制备4-HIL的方法主要有种子提取法、化学或酶合成法、微生物发酵法[1, 5-6]。目前微生物发酵法是较为经济、高效、安全的方法。2009年,KODERA等[7]发现了来源于苏云金芽孢杆菌2e2的α-酮戊二酸(α-ketoglutarate,α-KG)依赖性异亮氨酸双加氧酶(isoleucine dioxygenase,IDO),该酶能够直接催化L-异亮氨酸(L-isoleucine,Ile)生成4-HIL。2015年,本实验室在Ile生产菌株谷氨酸棒杆菌SN01中表达ido基因,利用菌株自身产生的底物Ile,从头合成出4-HIL[8]。随后采用静态改造策略逐步改造4-HIL的合成途径,使得4-HIL的产量从56.2 mmol/L提高到(118.3±5.7) mmol/L[9-12]。利用常见的代谢改造策略已经难以再增加4-HIL的产量,并且发酵过程中积累了较多的副产物L-赖氨酸(L-lysine,Lys)。随后课题组利用Ile激活型生物传感器Lrp-PbrnFEN协调底物α-KG和O2的供应及IDO的活性,摇瓶发酵后4-HIL产量提高到135.3 mmol/L,但是仍然积累了较多的Lys[13]。如何有效地削减Lys的合成,而又不降低4-HIL的产量成了急需解决的问题。
Lys对细胞的生长至关重要,很难通过基因敲除等静态代谢工程策略改造Lys合成途径[14-15]。在实验室前期的研究中,尝试采用Lys生物传感器驱动的编程适应性实验室进化策略来弱化Lys的合成,但是并没有有效降低Lys的含量[16]。根据近年来的报道,Lys-OFF核糖体开关能够感应胞内外Lys的浓度并关闭下游基因的表达[17]。2015年ZHOU等[17]利用Lys-OFF核糖体开关下调gltA的表达,成功地将代谢流由TCA循环引入到Lys合成途径,最终使谷氨酸棒杆菌的Lys产量提高了63.0%。
本文的整体代谢改造思路如图1所示,为了减少4-HIL发酵中Lys的合成,首先将来源于大肠杆菌的Lys-OFF核糖体开关整合到谷氨酸棒杆菌Lys合成途径中关键基因dapA的编码序列前,以便根据胞内外Lys的浓度动态下调dapA的表达,弱化Lys的合成,使Lys的浓度保持在维持细胞生长所需的较低水平上。然后在Lys-OFF整合菌株的基础上利用Ile传感器Lrp-PbrnFEN动态调控密码子优化后的ido的表达,由此合成4-HIL。最后利用Lrp-PbrnFEN动态协调α-KG和O2的供应及IDO的活性,以便提高4-HIL的产量。

图1 谷氨酸棒杆菌中4-HIL的合成Fig.1 Synthesis of 4-HIL in Corynebacterium glutamicum
1 材料与方法
1.1 菌株和质粒
本研究中使用的菌株和质粒如表1所示。

表1 本文所用的菌株和质粒Table 1 Strains and plasmids used in this paper
1.2 培养基
用于谷氨酸棒杆菌发酵的种子培养基和发酵培养基参照文献[13]的方法配制。
1.3 实验方法
1.3.1 Lys-OFF核糖体开关整合菌株的构建
利用传统的pK18 mobsacB介导的谷氨酸棒杆菌染色体编辑方法[19],将来自大肠杆菌MG1655的Lys-OFF核糖体开关[17]整合到谷氨酸棒杆菌dapA基因前面,得到D-RS菌株。
1.3.2 Ile传感器控制的动态表达质粒的构建

1.3.3 Lys动态削减菌株的构建

1.3.4 谷氨酸棒杆菌摇瓶发酵
从甘油管中挑取菌株涂布在添加30 μg/mL卡那霉素的LBB平板上,30 ℃活化40 h;然后将平板上的菌苔刮入添加有30 μg/mL卡那霉素的种子培养基中,30 ℃,200 r/min培养16 h;最后将种子接入发酵培养基中,使发酵液初始OD562为1.8,30 ℃,200 r/min培养144 h,分别在不同时间点取样,测定发酵过程中氨基酸含量的变化。
1.3.5 发酵参数的测定
每24 h取1 mL的发酵液,分别测定OD562、残糖和氨基酸的含量。OD562:将发酵液稀释20倍后,利用紫外分光光度计法测定562 nm下的吸光度。残糖:将发酵液稀释100倍后,利用SBA生物传感仪测定葡萄糖的含量。氨基酸含量的测定:首先用5%的三氯乙酸沉淀发酵液中的蛋白杂质,然后于12 000 r/min离心30 min,去除沉淀。取上清液进行膜过滤,再用HPLC检测氨基酸含量[13]。
2 结果与分析
2.1 整合Lys-OFF核糖体开关弱化Lys的合成
本文探索采用大肠杆菌Lys-OFF核糖体开关动态负调dapA的表达,来弱化Lys的合成。当Lys的浓度增加时,Lys可以与核糖体开关结合,从而关闭dapA的表达,削弱Lys的合成;当Lys浓度低时,核糖体开关则处于开放状态,dapA能够表达,以便使Lys的浓度保持在维持细胞生长所需的较低水平上。通过在dapA基因前整合Lys-OFF核糖体开关来探讨它对Lys合成的影响。
2.1.1 整合Lys-OFF核糖体开关对菌株生长的影响
在谷氨酸棒杆菌SN01染色体的dapA编码序列前整合Lys-OFF核糖体开关,得到D-RS菌株。摇瓶发酵时菌株的生长和耗糖情况如图2所示,以出发菌SN01作为对照菌株。

a-生长变化;b-残糖变化图2 Lys-OFF核糖体开关整合菌株D-RS和 出发菌株SN01的生长和残糖Fig.2 Cell growth and residual glucose of Lys-OFF riboswitch integrated strain D-RS and initial strain SN01
在整个发酵过程中,Lys-OFF核糖体开关整合菌株D-RS比野生型菌株SN01生长稍慢,最终OD562达到约96。但是D-RS的耗糖趋势与SN01相似,在0~72 h迅速耗糖,到96 h时葡萄糖已被耗尽。上述结果说明通过在谷氨酸棒杆菌染色体dapA基因编码序列前整合Lys-OFF核糖体开关来动态负调Lys的合成对菌株的生长产生的影响比较微弱。
2.1.2 整合Lys-OFF核糖体开关对氨基酸合成的影响
在dapA前整合Lys-OFF核糖体开关的主要目的就是为了弱化Lys的合成,于是测定了D-RS和SN01菌株发酵液中所积累的Ile和Lys产量。如图3所示,在发酵终点,D-RS积累了16.3 mmol/L的Lys,比对照菌株SN01(30.6 mmol/L)低了46.7%。同时,D-RS积累了152.2 mmol/L Ile,比对照菌株SN01(170.4 mmol/L)低了10.7%,但是通过SPSS分析表明无显著性差异。该结果说明,在SN01的染色体dapA前整合Lys-OFF核糖体开关能够有效地降低Lys的合成,并且对于4-HIL合成的底物Ile的积累不会产生影响。接下来探究整合Lys-OFF核糖体开关对于菌株4-HIL的产量是否有影响。
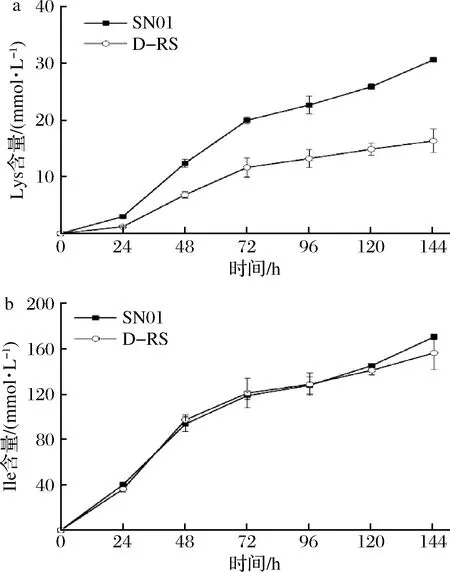
a-Lys;b-Ile图3 动态调控菌株D-RS摇瓶发酵中Ile和Lys的产量Fig.3 Production of Ile and Lys in dynamic strain D-RS after fermented in shake flasks
将静态表达质粒pJYW4-ido转入D-RS中表达,构建动态调控菌株D-RS/pJYW4-ido。并将携带有pJYW4-ido质粒的SN02作为静态对照菌株进行摇瓶发酵,并测定发酵过程中4-HIL和Lys产量的变化。如图4所示,最终D-RS/pJYW4-ido菌株积累了87.4 mmol/L的4-HIL,几乎与SN02(87.8 mmol/L)相同。而D-RS/pJYW4-ido菌株Lys的含量降低至15.4 mmol/L,比SN02(32.6 mmol/L)低了52.8%。上述结果说明整合Lys-OFF核糖体开关不会对菌株的4-HIL产量产生影响,同时能够显著降低Lys的含量。

图4 动态调控菌株D-RS/pJYW4-ido摇瓶 发酵中4-HIL和Lys的产量Fig.4 Production of 4-HIL and Lys in dynamic strain D-RS/pJYW4-ido after fermented in shake flasks
2.2 用Ile激活型传感器动态正调ido的表达
IDO是催化Ile合成4-HIL的关键酶。ido基因的表达强度对于谷氨酸棒杆菌中4-HIL的产量高低至关重要。在实验室之前的工作中通过静态代谢策略不断地提高IDO的表达水平和活性,但是ido的组成型表达会给细胞带来较大的代谢负担,胞内资源会持续性被利用去合成IDO。由于Ile是4-HIL合成的直接前体,因此本文采用Ile生物传感器Lrp-PbrnFEN动态正调密码子优化后的ido基因(记作idoU)的表达,并将其转入D-RS菌株中。目的是探究动态弱化Lys是否会对4-HIL的产量造成影响,以及使用Lrp-PbrnFEN传感器动态正调idoU的表达是否能进一步提高4-HIL的合成。
2.2.1 用Ile传感器动态正调ido的表达对菌株生长的影响
对ido进行密码子优化,从实验室前期构建的PbrnFEN启动子文库中挑选3种启动子:天然启动子PbrnFE0,强启动子PbrnFE7以及中等强度的启动子PbrnFED5去构建idoU的动态表达质粒pIL-0IU、pIL-D5IU和pIL-7IU。其中PbrnFED5包含2个启动子区域,分别是PbrnFE5和天然PbrnFE0启动子。将这3种动态表达质粒转入D-RS中,得到D-RS-0I、D-RS-D5I和D-RS-7I动态调控菌株。然后构建idoU的静态表达质粒pJYW4-idoU,并转入SN01中,得到静态对照菌株SI。图5为发酵过程中动态控制菌株D-RS-0I、D-RS-D5I、D-RS-7I和静态控制菌株SI的生长和耗糖的变化。
从整个发酵过程来看,菌株D-RS-D5I的生长与出发菌株D-RS相似,比对照菌株SI略快。而D-RS-0I菌株与SI相似,比出发菌株D-RS略慢。D-RS-7I的生长略慢于SI菌株。然而D-RS-7I的耗糖与SI相似,略慢于D-RS-0I和D-RS-D5I菌株。上述结果说明在D-RS菌株的基础上进一步动态调控idoU的表达,不会对菌株的生长造成非常显著的影响。

a-生长变化;b-残糖变化图5 动态调控菌株D-RS-NI和静态对照菌株SI的 生长和残糖Fig.5 Cell growth and residual glucose of dynamic strain D-RS-NI and static control strain SI
2.2.2 用Ile传感器动态正调ido的表达对氨基酸合成的影响
如图6所示,在发酵终点,D-RS-D5I和D-RS-0I分别积累了116.3、89.8 mmol/L的4-HIL。D-RS-D5I比静态对照菌株SI的4-HIL产量(89.9 mmol/L)高出29.4%,而D-RS-0I与SI的4-HIL产量相似。这2株菌的Lys含量分别是6.0、5.2 mmol/L,比SI(34.7 mmol/L)分别低出82.7%和85.0%。该结果说明在D-RS的基础上动态正调idoU的表达,能够在提高或者不影响4-HIL产量的同时降低Lys的含量。奇怪的是D-RS-7I几乎没有产生Ile和4-HIL,而且积累了大量的Lys,因此在后续工作中抛弃该菌株。另外D-RS-0I剩余约30 mmol/L的Ile没有耗光,猜测该菌株中底物α-KG和O2的供应可能不足,导致剩余的Ile没有继续转化为4-HIL。接下来探究动态协调α-KG和O2的供应对4-HIL产量的影响。

图6 动态调控菌株D-RS-NI摇瓶发酵中4-HIL、 Ile和Lys的产量Fig.6 Production of 4-HIL, Ile and Lys in dynamic strains D-RS-NI after fermented in shake flasks
2.3 用Ile传感器组合动态正调ido的表达及α-KG和O2的供应
IDO反应的底物有α-KG和O2,α-KG和O2的协同供应对于增加4-HIL的产量非常重要。实验室前期采用强启动子PbrnFE7调控odhI和vgb表达,使4-HIL的产量提高至135.4 mmol/L。因此为了提高4-HIL的产量,在2个D-RS-NI菌株(D-RS-0I和D-RS-D5I)的基础上,采用PbrnFE7启动子调控odhI和vgb表达。odhI编码的OdhI是α-KG脱氢酶复合体(ODHC)的抑制蛋白,该蛋白可以通过抑制ODHC而提高α-KG的供应;vgb编码的透明颤菌血红蛋白VHb可以增加细胞对O2的摄取。构建了2株D-RS-NI7O7V动态调控菌株。由此在动态弱化Lys的合成和动态调控ido表达的基础上,进一步动态调节α-KG和O2的供应。探究该改造策略对菌株生长和4-HIL合成的影响。
2.3.1 动态组合正调ido的表达及α-KG和O2的供应对菌株生长的影响
如图7所示,在整个发酵过程中,动态菌株D-RS-NI7O7V的生长均比静态对照菌株SI好。D-RS-0I7O7V和D-RS-D5I7O7V生长趋势相似,在发酵终点OD562均在110~120。D-RS-NI7O7V菌株的耗糖情况与对照菌株SI相似,在0~72 h迅速耗糖,在96 h耗光培养基中的葡萄糖。由此可见,在D-RS-NI菌株的基础上进一步动态表达odhI和vgb,不会影响菌株的生长。
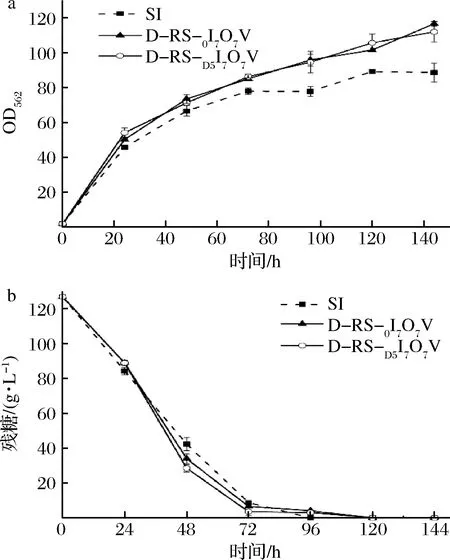
a-生长变化;b-残糖变化图7 动态调控菌株D-RS-NI-NO-NV的生长和残糖Fig.7 Cell growth and residual glucose of dynamic strain D-RS-NI-NO-NV
2.3.2 组合动态正调ido的表达及α-KG和O2的供应对氨基酸合成的影响
如图8所示,在发酵终点,D-RS-0I7O7V和D-RS-D5I7O7V的4-HIL产量分别达到166.0、150.4 mmol/L,相比于各自的出发菌株D-RS-NI,分别提升了84.9%和29.3%。并且这2株菌株都没有剩余Ile,因此Ile到4-HIL的转化率都达到了1.0 mol/mol。这2株菌株的Lys含量分别降至6.5、5.8 mmol/L,比静态对照菌SI(34.7 mmol/L)分别降低了81.2%和83.3%。并且其他杂酸含量也比较低,尤其是D-RS-0I7O7V菌株。综上所述,在D-RS的基础上组合动态正调ido的表达及α-KG和O2的供应,能够加速细胞的生长,进一步提高4-HIL的产量,同时降低副产物Lys的合成。
3 结论
为了在提高4-HIL产量的同时降低Lys的合成,首先在SN01染色体Lys合成途径的关键基因dapA前整合Lys-OFF核糖体开关,动态弱化Lys合成,使Lys的含量降低了46.7%。并且不会对4-HIL的产量产生影响。其次利用TAN在2020年构建的Ile激活型传感器Lrp-PbrnFEN去控制密码子优化后的ido的表达,使4-HIL能够在谷氨酸棒杆菌中高效合成,4-HIL的产量提高至116.3 mmol/L。最后为了进一步提高4-HIL的产量,利用强启动子PbrnFE7控制odhI和vgb的表达,增强α-KG和O2的供应,摇瓶发酵使4-HIL产量提高至166.0 mmol/L,同时使Lys含量降至6.5 mmol/L。本文的最佳菌株D-RS-0I7O7V摇瓶发酵的4-HIL产量(24.4 g/L)分别比SHI等[20]先前报道的静态对照菌株SF12(20.6 g/L)高18.4%。该产量也比谭书煜[13]之前报道的由单功能生物传感器Lrp-PbrnFEN调节的动态菌株ST17(19.9 g/L)高22.6%。然而,D-RS-0I7O7V在摇瓶中的4-HIL产量低于孟静等[21]对菌株HIL18发酵罐优化后的产量(43.3 g/L)。但是本文结果也是目前报道的谷氨酸棒杆菌摇瓶发酵生产4-HIL的最高产量,并且其他杂酸比较低。本文所采用研究策略为4-HIL的高效合成提供了一种新思路。

a-4-HIL;b-Ile;c-Lys;d-其他氨基酸图8 动态调控菌株D-RS-NI-NO-NV摇瓶发酵中4-HIL、Ile、Lys和其他氨基酸的产量Fig.8 Production of 4-HIL, Ile, Lys and other amino acids in dynamic strains D-RS-NI7O7V after fermented in shake flasks
