沃尔巴克氏菌调控小茶尺蠖和灰茶尺蠖杂交卵孵化
2022-09-17王志博刘永健白家赫张欣欣
王志博, 刘永健, 白家赫, 张欣欣, 肖 强,*
(1. 中国农业科学院茶叶研究所, 农业农村部茶叶质量安全控制重点实验室, 杭州310008;2. 中国科学院分子植物卓越创新中心, 上海 200031)
Wolbachia是一类广泛共生于节肢动物宿主细胞内的革兰氏阴性细菌,可通过多种方式调节宿主的生殖行为(Bi and Wang, 2019),其中胞质不亲和现象(cytoplasmic incompatibility, CI)是最为普遍的表型(LePage and Bordenstein, 2013; Pance, 2018; Conteetal., 2019)。Wolbachia介导CI的机理研究一直是学术热点,在细胞学水平对该过程有了较为清晰的描述(Tram and Sullivan, 2002)。而Werren(1997)和Bourtzis等(1998)提出的Wolbachia诱导CI的“修饰”和“拯救”机制,得到了广泛的认同和接受。该理论认为精巢中的Wolbachia能够修饰父本的精细胞,使其不能和卵细胞正常融合,但是当母本感染相同的Wolbachia时,就能够将“修饰”过的精子细胞“拯救”过来,使其恢复与卵细胞的正常融合(LePage and Bordenstein, 2013; 张艳凯等, 2015)。基于上述理论基础,针对CI分子机制的研究多采用组学技术手段对携带和不携带Wolbachia的精巢和精子进行比对研究以探索潜在的分子机制。Zheng等(2011)使用基因芯片技术比较了感染与不感染Wolbachia的雄性黑腹果蝇Drosophilamelanogaster精巢中基因表达差异,发现了296个差异表达基因,这些基因主要参与宿主的生殖、新陈代谢及免疫等过程;Zhang等(2015)通过对感染和不感染Wolbachia的二斑叶螨Tetranychusurticae转录组分析,发现Wolbachia主要影响了宿主氧化还原过程、消化及解毒过程、脂质运载蛋白通路的基因表达。根据现有的研究可知Wolbachia介导CI作用机制修饰与拯救理论十分复杂,受多种因子的影响,进一步表明关于该理论的分子机理仍不清楚,还需要进一步在更多宿主中去探索和验证。
小茶尺蠖Ectropisobliqua和灰茶尺蠖E.grisescens是我国茶园最为重要的食叶类茶树害虫,发生严重时可将整片茶园全部吃光,给茶叶的生产带来严重影响(Wangetal., 2019; Panetal., 2021)。前期研究表明,两种茶尺蠖是一对近缘种茶树害虫,均隶属鳞翅目(Lepidoptera)尺蛾科(Geometridae)埃尺蛾属Ectropis,二者食性相同,外形极为相近,COI基因遗传距离的差异在3.2%~4.0%,生产上常被混淆(姜楠等, 2014)。进一步研究发现,两近缘种在生物学特征(白家赫等, 2018a)、对茶尺蠖病毒敏感性(李红等, 2020)、性信息素成份和体内共生菌群落组成等方面存在明显差异(Maetal., 2016; Luoetal., 2017; Wangetal., 2020),且具有相对独立的地理分布。灰茶尺蠖分布区域更加广泛,几乎遍布我国各大茶叶生产区域;小茶尺蠖在我国主要分布于江苏、浙江、安徽三省部分茶叶生产区域,二者在江苏、浙江、安徽三省交叉地带混合发生(席羽等, 2014; 白家赫等, 2018b; Wangetal., 2019)。上述的分布特征也预示着区域性的同域混发可能导致了自然交配和种群竞争的存在,这样的假设在室内试验中也得到了验证。小茶尺蠖和灰茶尺蠖可以交配产卵但杂交后代无法续代,二者依然存在生殖隔离现象(Zhangetal., 2014, 2016; Wangetal., 2019)。前期的研究显示,野生种群灰茶尺蠖携带Wolbachia而小茶尺蠖不携带(Wangetal., 2020),这一现象满足了Wolbachia介导CI的前提条件。同时,茶尺蠖两近缘种表现出的生殖隔离现象与共生菌Wolbachia调控宿主生殖方式相吻合,那么Wolbachia是否能够通过CI作用介导茶尺蠖两近缘种间的生殖隔离?是值得探索的科学问题。针对上述科学问题需要以Wolbachia作为单因素控制条件验证Wolbachia在茶尺蠖两近缘种间的生殖隔离的功能,对于自然携带Wolbachia的灰茶尺蠖而言,建立不携带Wolbachia的灰茶尺蠖种群就显得尤为重要。因此,我们参照相关文献(谢蓉蓉等, 2013),采用四环素喂饲方法处理灰茶尺蠖,进而获得不携带Wolbachia的灰茶尺蠖种群(王志博等, 2021),这为开展Wolbachia与茶尺蠖两近缘种间的相关研究奠定了基础。
本研究利用携带和不携带Wolbachia的灰茶尺蠖分别与小茶尺蠖进行杂交试验,明确Wolbachia是否介导了两近缘种茶尺蠖种间的生殖隔离,进一步采用iTRAQ技术检测分析了携带和不携带Wolbachia灰茶尺蠖精子蛋白的差异,以期阐明Wolbachia介导茶尺蠖两近缘种间CI的分子机制。这对于揭示物种分化和进化具有重要的科学意义,同时也将为采用遗传防治和基因工程手段防治茶尺蠖提供理论基础。
1 材料与方法
1.1 试虫来源
小茶尺蠖采自浙江杭州市余杭(30.39°N, 119.90°E),灰茶尺蠖采自江苏省扬州市仪征青峰生态农业有限公司茶园基地(32.33°N, 119.06°E)。人工野外采集茶尺蠖幼虫后带回实验室饲养。饲养条件:温度控制在(25±1)℃,光周期设置为13L∶11D,相对湿度保持在75%~80%。每天采摘新鲜茶树嫩叶(迎霜品种)饲喂尺蠖幼虫直至化蛹。在解剖镜下将蛹按雌雄分开置于养虫瓶中,待成虫羽化后,随机挑选雌雄成虫各2对置于500 mL养虫瓶中配对,同时在养虫瓶中放入2个产卵条及一片新鲜茶叶便于保湿(白家赫等, 2018)。本研究所用不同种群实验材料均在上述相同条件下饲养以保持一致性。
1.2 不携带Wolbachia灰茶尺蠖种群建立
1.2.1灰茶尺蠖Wolbachia去除:配制质量浓度为2.5 mg/mL四环素(麦克林公司, 上海)溶液对新鲜茶树叶片进行浸液处理1 min。四环素处理过的叶片置于温度25℃、相对湿度为50%~60%条件下进行摊晾,待叶片表面溶液完全干后,取适量处理过的茶叶对灰茶尺蠖幼虫进行喂食。连续饲喂四环素处理茶叶3个世代后,对羽化2日龄的成虫随机取样进行Wolbachia检测(王志博等, 2021)。
1.2.2Wolbachia去除效果检测:使用血液/组织DNA提取试剂盒(天根生物技术有限公司, 北京)提取样品DNA。将样品成虫翅用剪刀除去,剩余部分装入2 mL的灭菌EP管中并加入1粒4 mm的灭菌钢珠,置于震荡研磨器上研磨2 min。待样品研磨完成后按照试剂盒操作手册逐步提取样品DNA,并保存于-20℃冰箱中备用。使用Wolbachia的特异性引物(wsp_F1:5′-GTCCAATARSTGATGARGAA AC-3′;wsp_R1:5′-CYGCACCAAYAGYRCTRTAAA-3′)扩增wsp基因进行Wolbachia去除效果检测。扩增条件:95℃预变性3 min; 95℃变性1 min, 59℃退火1 min, 72℃延伸90 s, 35个循环;最后72℃延伸10 min。PCR产物用2%的琼脂糖凝胶检测(王志博等, 2021)。
1.3 遗传杂交实验
挑选羽化1日龄的两种茶尺蠖成虫进行配对。每个养虫瓶放置1对成虫、1个产卵条和1片茶树老叶,每天更换新鲜的茶树老叶以保持瓶内湿度,并为每个养虫瓶标注交配组合基本信息(交配亲本种类、配对日期及编号),每个交配组合30对重复。配对3 d后将成虫取出,后续每天检查养虫瓶内是否有卵孵化,每个交配组合随机选取5个孵化个体对产卵量和孵化率进行统计分析。交配组合如下(表1):①自交GG组合:灰茶尺蠖♀×灰茶尺蠖♂;②自交OO组合:小茶尺蠖♀×小茶尺蠖♂;③正交GO组合:灰茶尺蠖♀×小茶尺蠖♂;④反交OG组合:小茶尺蠖♀×灰茶尺蠖♂;⑤试验反交OS组合:小茶尺蠖♀×灰茶尺蠖♂(不携带Wolbachia);⑥试验正交SO组合:灰茶尺蠖♀(不携带Wolbachia)×小茶尺蠖♂。
1.4 精子蛋白差异分析
1.4.1蛋白提取:解剖羽化1日龄雄虫取精囊(30头为一混样)置于1.5 mL EP管中液氮冷冻处理后-80℃保存备用,每组处理3个重复。样品中加入PASP蛋白裂解液(100 mmol/L碳酸氢铵、8 mol/L尿素, pH 8),置于冰上超声裂解处理5 min,离心取上清液。上清液中加入10 mmol/L DTT 56℃水浴处理1 h,再加入碘乙酰胺,室温避光条件反应1 h后加入4倍体的丙酮于-20℃条件下沉淀至少2 h,于4℃ 12 000 g离心15 min,收集沉淀,待充分干燥后加入适量蛋白溶解液(8 mol/L尿素, 100 mmol/L TEAB, pH 8.5)溶解蛋白沉淀(Gilletteetal., 2020)。
1.4.2蛋白检测:蛋白检测使用Bradford蛋白质定量试剂盒。首先按照说明书配制浓度梯度范围为0~0.5 μg/μL的BSA标准蛋白溶液,分别取不同浓度梯度的BSA标准蛋白溶液及不同稀释倍数的待测样品溶液加入96孔板中,补足体积至20 μL,每个梯度重复3次。使用G250染色液染色处理5 min,测定595 nm吸光度,并绘制标准曲线、计算待测样品的蛋白浓度。各取20 μg蛋白待测样品进行12% SDS-PAGE凝胶电泳,其中浓缩胶电泳和离胶电泳条件分别为80 V 20 min和120 V 90 min。电泳结束后进行考马斯亮蓝R-250染色,脱色至条带清晰(葛晨玲等, 2019)。
1.4.3蛋白酶切及标记:取蛋白样品加入DB蛋白溶解液补足体积至100 μL,加入100 mmol/L TEAB缓冲液和胰酶,混匀后于37℃酶切4 h,再加入胰酶和CaCl2酶切过夜。加入甲酸调节pH小于3,混匀后于室温、离心取上清缓慢通过C18除盐柱,使用清洗液(0.1%甲酸和3%乙腈)连续清洗3次,再加入适量洗脱液(0.1%甲酸和70%乙腈)收集滤液,冻干。加入20 μL 1 mol/L TEAB缓冲液复溶,并加入足量iTRAQ标记试剂(溶于异丙醇),室温下颠倒混匀反应2 h。之后加入100 μL 50 mmol/L Tris-HCl(pH 8)终止反应,取等体积标记后的样品混和,除盐后冻干(马晓聪等, 2019)。
1.4.4肽段组分分离:混和后的标记肽段通过Waters BEH C18柱经L-3000 HPLC系统分离,使用流动相液进行梯度洗脱分离,收集肽段流出组分进行组分质谱鉴定(马晓聪等, 2019)。
1.4.5肽段质谱鉴定:样品采用液质联用进行检测,每个馏分上样量以信号达到1×1010为准,液相使用EASY-nLCTM1200纳升级UHPLC系统。质谱系统使用Q ExactiveTMHF-X质谱仪,Nanospray FlexTM(ESI)离子源设定离子喷雾电压为2.1 kV,离子传输管温度为320℃,质谱采用数据依赖型采集模式。
1.4.6质谱分析与数据处理:采用Proteome Discoverer 2.2(PD2.2, Thermo)软件基于Uniprot蛋白数据库分别搜索每个run的结果谱图,筛选可信度在99%以上的谱肽(peptide spectrum matches, PSMs)为可信PSMs,进一步通过FDR验证获得高度可信的结果(葛晨玲等, 2019)。
1.4.7生物信息学分析:采用PD 2.2软件进行蛋白差异分析,将每个蛋白在比较样品对中的所有生物重复定量值的均值的比值作为差异倍数(fold change, FC),以差异倍数大于1.2倍(FC≥1.2筛选上调蛋白,FC≤0.83筛选下调蛋白)且P值≤0.05作为标准筛选差异蛋白。使用interproscan软件参照数据GO数据库(http:∥amigo.geneontology.org/amigo)进行GO功能蛋白家族分析,分别从分子功能、细胞组成和生物学过程对差异蛋白进行描述。并通过参考KEGG数据库(http:∥www.genome.jp/kegg/)进行KEGG通路分析,确定蛋白质参与的最主要的生化代谢通路和信号转导通路。
1.5 数据分析
实验数据使用EXCEL软件进行录入,使用SPSS 16.0软件对实验数据进行处理和分析。使用T检验对差异蛋白结果进行统计分析。使用单因素方差分析(one-way ANOVA),并用Tukey氏检验法对杂交实验结果进行显著性分析,P<0.05即认为有显著性差异。 统计结果均为平均值±标准误(SE),同列内具有相同字母的表示相互间差异不显著。
2 结果
2.1 不携带Wolbachia灰茶尺蠖种群建立
使用四环素连续处理灰茶尺蠖3个世代后,随机挑选四环素处理组、未经四环素处理的灰茶尺蠖对照组以及茶尺蠖组样品各8头,基于wsp分子标记检测其Wolbachia携带情况,同时以COI基因作为内参对照,结果显示,未经四环素处理灰茶尺蠖组均检测出条带而四环素处理组和茶尺蠖组均没有条带(图1),表明使用四环素处理灰茶尺蠖已成功建立了不携带Wolbachia的灰茶尺蠖种群。进一步,通过室内连续多代饲养显示该种群依然能稳定正常繁殖继代。

图1 四环素处理灰茶尺蠖去除Wolbachia效果检测
2.2 遗传杂交实验
选取携带与不携带Wolbachia灰茶尺蠖与小茶尺蠖进行种间杂交试验并以种内自交作为对照。结果显示自然种群茶尺蠖两近缘种正交和反交均能交配,并且两种杂交组合均有部分卵能够孵化成幼虫(表1)。自交组合GG和OO及杂交组合GO和OG卵孵化率分别为89.65%,91.88%,79.17%和3.92%。杂交组合卵孵化率低于自交对照组,但正交组合GO与对照组并未呈现显著差异(P>0.05);而反交OG组合卵孵化率与正交GO组合及自交对照组相比均呈现显著降低(P<0.05)。不携带Wolbachia的灰茶尺蠖种群与小茶尺蠖进行杂交试验结果显示,灰茶尺蠖♂去除掉Wolbachia后与小茶尺蠖♀杂交,卵孵化率达到56.20%,与自然种群杂交的卵孵化率3.92%存在极显著差异(P<0.01);而灰茶尺蠖♀去除掉Wolbachia后与小茶尺蠖♂杂交,卵孵化率为67.21%,与自然种群杂交的卵孵化率差异不显著(P>0.05)。结果表明,Wolbachia能够对茶尺蠖两近缘种杂交卵孵化率起到调控作用(图2)。进一步分析表明,Wolbachia对茶尺蠖两近缘种杂交卵的调控作用与胞质不亲和现象一致,主要体现在携带了Wolbachia的灰茶尺蠖♂与不携带Wolbachia小茶尺蠖♀杂交卵孵化异常,而携带Wolbachia的灰茶尺蠖♀与不携带Wolbachia小茶尺蠖♂杂交卵孵化正常,二者间的胞质不亲和现象属于单向不亲和类型(Dobzhansky, 1970)(图3)。

表1 茶尺蠖两近缘种杂交卵孵化率

图2 Wolbachia调控茶尺蠖两近缘种杂交卵孵化率
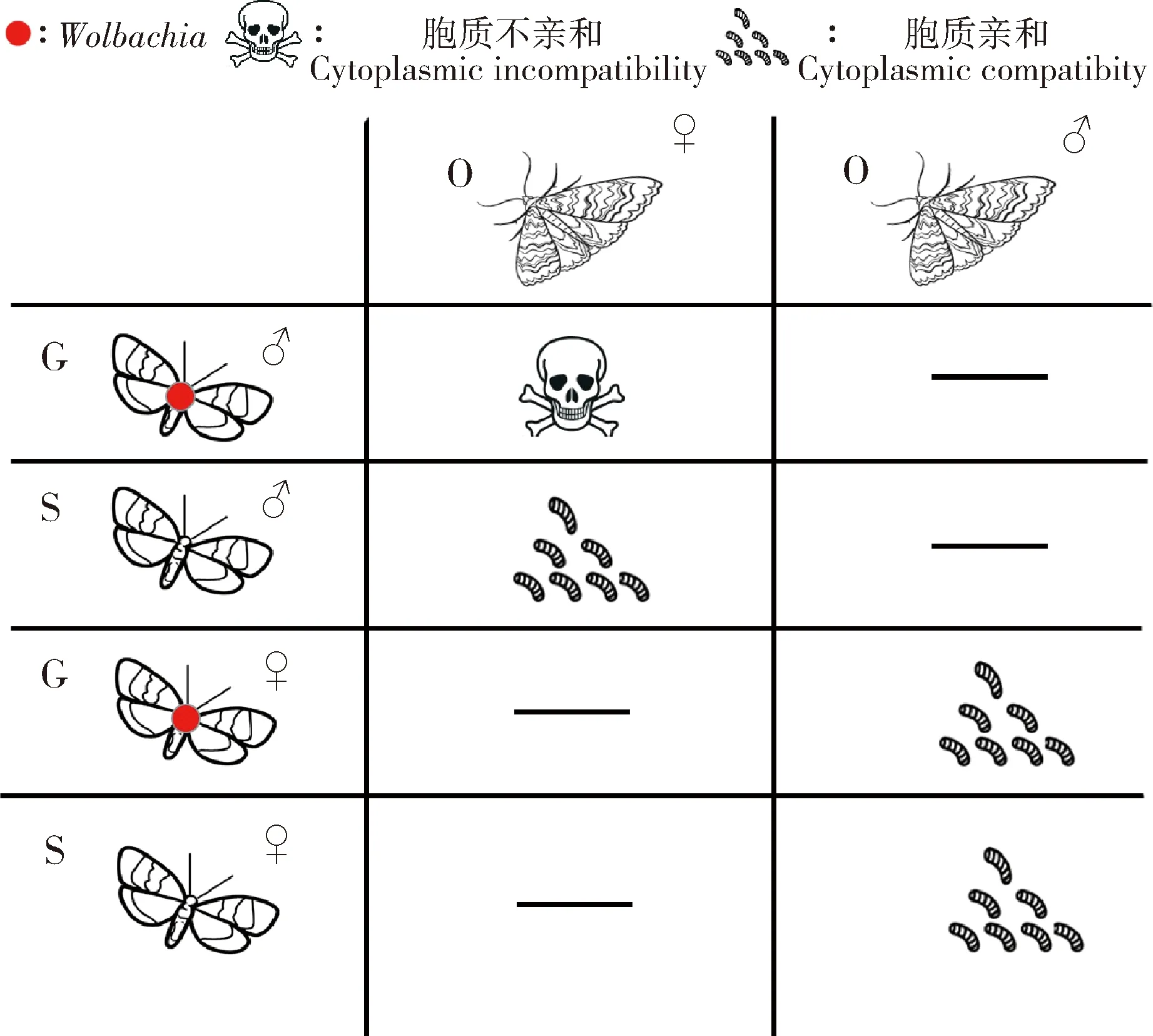
图3 Wolbachia介导茶尺蠖两近缘种胞质不亲和示意图
2.3 灰茶尺蠖精子蛋白定量分析
灰茶尺蠖四环素处理组和灰茶尺蠖对照组提取的精子蛋白进行了质量检测,蛋白浓度分别为4.88和3.92 μg/μL,电泳条带清晰,符合质谱分析要求。进一步采用Q Exactive TM HF-X质谱仪分析获得的原始数据经Proteome Discoverer 2.2软件进行数据库检索,谱肽、蛋白定量。本研究共鉴定到612 823个二级谱图数,其中有效谱图67 752个,鉴定到肽段数量28 849个,鉴定到蛋白数量5 177种,其中可定量蛋白5 172种。质谱数据质控结果显示,离子峰均一集中,杂质干扰较少(图4: A),肽段长度主要集中在8~16肽(图4: B),分离出的蛋白相对分子质量主要集中在10~30 kDa。综上所述,样品成分均一、 可信度高。测定的精子蛋白组数据已上传ProteomeXchange数据库中(http:∥proteomecentral.proteomexchange.org),对应的上传序号为PXD029622。
2.4 携带和不携带Wolbachia的灰茶尺蠖精子蛋白差异分析
灰茶尺蠖四环素处理组和灰茶尺蠖正常饲养对照组(每个组3个重复)共6个样品,经iTRAQ标记串联质谱分析后,基于每个样品分析得到的蛋白定量数据进行样品相似度分析,结果显示,两个组别分布相对独立,其中,四环素处理组3个样品相对对照组具有更高的相似度,均分布于第3象限;对照组3个样品分布于1, 2和4象限,说明二者蛋白组成具有较为明显的差异(图4: C)。两个组别共同鉴定到的蛋白共5 172个,对照组与四环素处理组相比具有显著差异表达蛋白共128个(图4: D),其中显著上调蛋白94个,涉及功能包括促生型细胞因子、保幼激素相关蛋白和抗菌活性蛋白等;显著下调蛋白34个,涉及功能包括抗菌及解毒相关蛋白等。
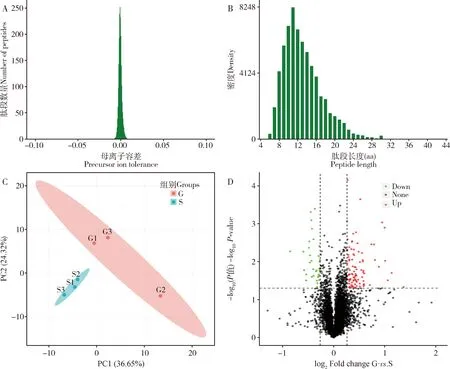
图4 灰茶尺蠖精子蛋白数据质量检测分析
2.5 携带和不携带Wolbachia的灰茶尺蠖精子差异蛋白的GO功能注释分析
通过GO数据比对分析,本研究差异蛋白共得到85个功能注释,其中分子功能(molecular function)占44.71%(38/85),细胞组分(cellular component)占14.12%(12/85),生物学过程(biological process)占41.1%(35/85)(图5)。分子功能方面,差异蛋白主要参与水解酶活性(hydrolase activity)、肽酶活性(peptidase activity)、锌离子结合(zinc ion binding)等生物过程。在细胞组分方面,这些蛋白主要位于胞外区(extracellular region)和细胞外液(extracellular space)区域。在生物学过程方面,差异蛋白主要参与碳水化合物代谢过程(carbohydrate metabolic process)、氨基聚糖代谢过程(aminoglycan metabolic process)和几丁质代谢过程(chitin metabolic process)。
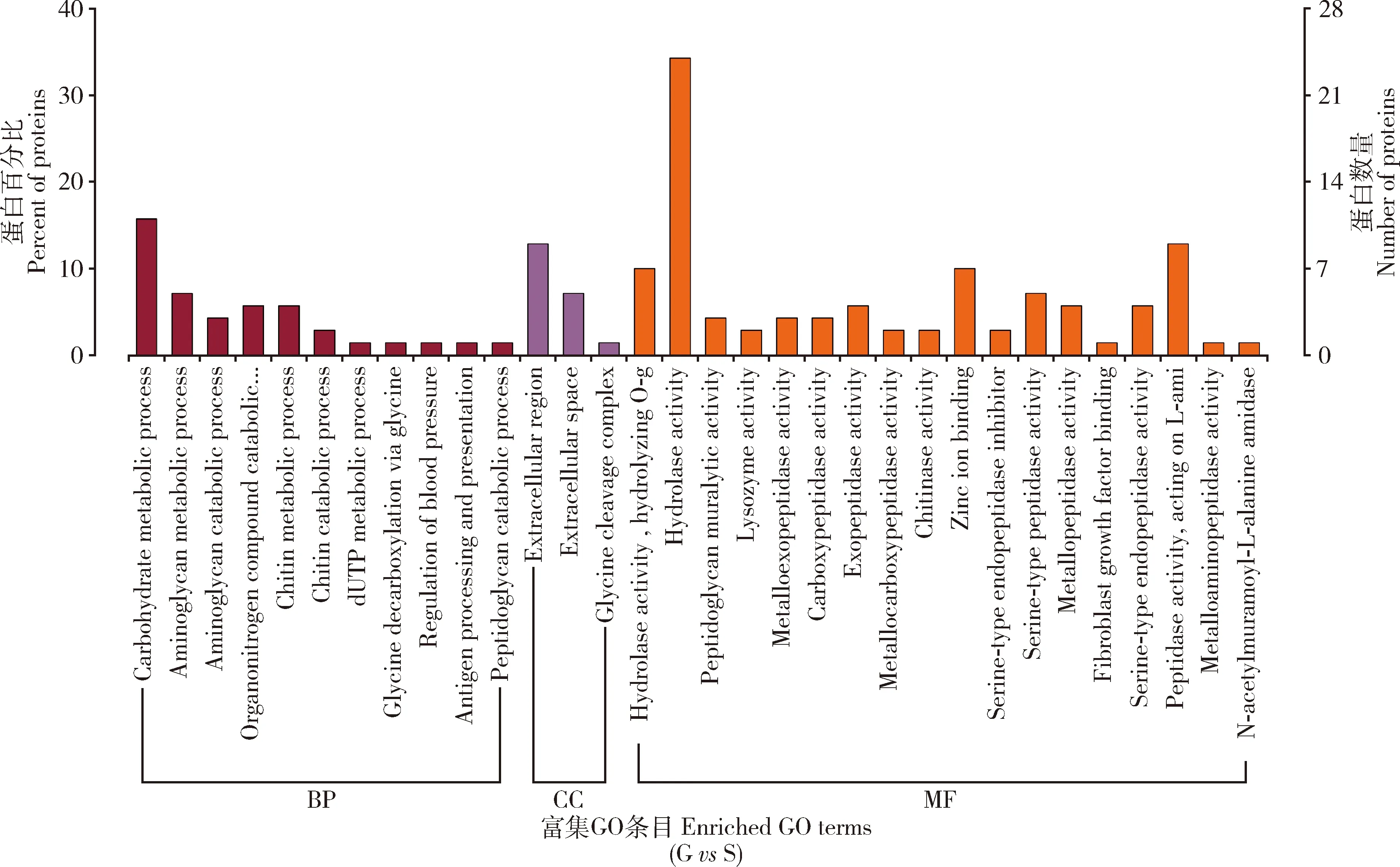
图5 携带和不携带Wolbachia的灰茶尺蠖精子中差异蛋白GO功能注释
2.6 携带和不携带Wolbachia的灰茶尺蠖精子差异蛋白的KEGG富集分析
根据KEGG数据库共注释到45个差异蛋白富集到106个通路中,其中主要富集的通路为:鞘脂类代谢(sphingolipid metabolism)(4个)、唾液分泌(salivary secretion)(5个)、溶酶体(lysosome)(7个)、鞘脂信号通路(sphingolipid signaling pathway)(4个)、鞘糖脂生物合成-红细胞和异红细胞系列(glycosphingolipid biosynthesis-globo and isoglobo series)(2个)(图6)。其中最显著富集的鞘脂类代谢通路中与神经酰胺合成直接相关的神经酰胺酶和鞘磷酯酶显著上调(图7)。

图6 携带和不携带Wolbachia的灰茶尺蠖精子中差异蛋白KEGG富集散点图

图7 携带和不携带Wolbachia的灰茶尺蠖精子中差异蛋白的鞘脂类代谢通路分析
3 讨论与结论
本研究通过对灰茶尺蠖体内Wolbachia共生菌控制条件下的遗传杂交实验,明确了Wolbachia具有调控茶尺蠖两近缘种杂交卵孵化的作用,这种生殖调控机制源于Wolbachia介导的CI作用(Sicardetal., 2014)。Wolbachia介导的CI作用一直以来都是关注的热点,其最为熟知的应用案例是CI导致的胚胎不育,通过释放感染Wolbachia雄蚊到未感染Wolbachia的种群造成雌性不育,实现了利用Wolbachia对蚊媒病的防治,从而阻止登革热和寨卡病毒的传播(Fordetal., 2019; Sicardetal., 2019)。利用Wolbachia介导CI作用这一机制可以实现对害虫种群的控制,但单从Wolbachia和宿主二者互作的角度,Wolbachia是利用CI机制实现了自我生存,同时也有利于宿主种群的生存和拓殖,这在一定程度上加速了宿主的种群分化,甚至能促进新物种的形成(Sioziosetal., 2018; Chenetal., 2019; Shropshireetal., 2020)。目前,针对Wolbachia介导物种生殖隔离的研究,多数集中在具有Wolbachia差异的不同地理种群的同一物种,这是物种分化过程中的初期阶段。本研究选择了具有Wolbachia差异的两个近缘种茶尺蠖开展研究,证明了在物种分化后Wolbachia介导CI作用在二者间依然存在,这一结果为Wolbachia可能参与茶尺蠖两近缘种物种形成提供了参考和依据。
在明确了Wolbachia能够通过CI作用实现对杂交卵孵化调控的同时,本研究基于目前公认的“修饰”和“拯救”理论进一步对Wolbachia介导CI的机制进行了研究。通过蛋白组学技术对携带和不携带Wolbachia灰茶尺蠖精子蛋白进行了比较分析,明确了Wolbachia对灰茶尺蠖精子蛋白具有修饰作用,二者蛋白组成呈现显著差异。进一步通过GO分析显示,在分子功能方面差异蛋白主要参与水解酶活性、锌离子结合等过程;生物学过程方面,差异蛋白主要参与碳水化合物代谢过程、氨基聚糖代谢过程和几丁质代谢过程等过程(图5),这表明Wolbachia对精子的修饰可能对其能量供应方面起到了重要的作用从而影响到了精子活性及精子细胞形态的构成(杨月红和奚耕思, 1999; 葛晨玲等, 2019)。前期关于Wolbachia介导CI机制的相关研究表明,组蛋白基因Hira、编码锚定蛋白ANK基因等可能参与CI调控过程并涉及到生殖、新陈代谢及免疫等通路(Zhengetal., 2011; Zhangetal., 2015)。但在本研究中KEGG分析结果显示,差异蛋白主要富集在与鞘脂类相关通路中,其中鞘脂类代谢通路中4个差异蛋白也同时富集在了鞘脂信号通路中(图6),说明鞘脂类通路可能参与了Wolbachia介导CI机制。进一步对显著富集的鞘脂类代谢通路分析发现,与神经酰胺合成直接相关的两个酶(神经酰胺酶和鞘磷酯酶)显著上调(图7),这表明Wolbachia可能对神经酰胺具有调控作用。神经酰胺是一类重要的鞘脂类物质,处于整个鞘脂类代谢通路的核心位置,是各种复杂鞘脂类的前体,也是细胞膜的重要组成成分(Chaurasia and Summers, 2021)。现有的研究显示神经酰胺作为第二信使具有调控昆虫卵孵化的功能。例如果蝇中神经酰胺酶在生殖系统中表达量最高,中性神经酰胺酶的缺失会导致胚胎的死亡(Yuanetal., 2011);灰飞虱中性鞘磷脂酶在雌虫卵巢和雄虫精巢中表达最高,说明中性鞘磷脂酶对灰飞虱生殖系统的发育有重要的作用(Zhouetal., 2013)。褐飞虱中沉默了神经酰胺酶基因会导致神经酰胺物质升高,进而诱导卵巢发生细胞凋亡,出现产卵量降低,卵孵化率降低等现象;而沉默了神经酰胺合成酶基因,会引起神经酰胺物质含量降低,也会抑制褐飞虱卵巢生长发育(Shietal., 2018)。由此可见,神经酰胺类物质在生物体生殖系统中大量富集并具有调节生物体的生殖功能。而Wolbachia介导CI现象的主要表型也是胚胎致死,直接体现的现象是卵孵化率降低(Biwotetal., 2020),与神经酰胺的调控作用表现出相似的现象。这表明Wolbachia可能通过对神经酰胺类物质的调控介导了茶尺蠖两近缘种间的生殖隔离,其作用机制值得后续作进一步的深入研究。
本研究以去除Wolbachia灰茶尺蠖种群、自然携带Wolbachia灰茶尺蠖种群与不携带Wolbachia的小茶尺蠖种群作为研究材料开展了种群间的杂交试验,结果表明去除Wolbachia灰茶尺蠖与小茶尺蠖杂交卵孵化率显著提升,明确了Wolbachia通过胞质不亲和作用调控了茶尺蠖两近缘种杂交卵的孵化。进一步对携带和不携带Wolbachia灰茶尺蠖精子蛋白分析显示,二者精子蛋白存在显著差异,差异蛋白主要富集在与鞘脂类相关通路中,其中与神经酰胺合成相关的神经酰胺酶和磷酸酯酶的显著上调。本研究为深入开展Wolbachia介导茶尺蠖两近缘种生殖隔离机制研究奠定了基础。
