褐飞虱过氧化物酶基因NlPOD1的克隆、鉴定及功能分析
2022-09-17李慕雨王彦丹王正亮俞晓平
李慕雨, 王彦丹, 王正亮, 俞晓平
(中国计量大学生命科学学院, 浙江省生物计量及检验检疫技术重点实验室, 杭州 310018)

研究表明,昆虫POD是一类以铁卟啉为辅基的多结构域蛋白,在昆虫生长发育、先天免疫以及环境适应过程中发挥重要作用(Kumaretal., 2010; Dengetal., 2016; 尹华春等, 2018)。如Park等(2014)基于转录组数据从甜菜夜蛾Spodopteraexigua中鉴定到10条POD基因(SePOXA-J),其中SePOX-F和SePOX-H在受大肠杆菌Escherichiacoli诱导后在血淋巴和脂肪体中高效表达,通过RNA干扰(RNA interference, RNAi)技术敲低后可显著抑制甜菜夜蛾的细胞免疫反应。申忠健等(2016)和杨航等(2019)分别从夜蛾科农业害虫棉铃虫Helicoverpaarmigera和粘虫Mythimnaseparata中克隆了过氧化物酶基因HaPOD和MsPOD,序列分析显示两者氨基酸序列高度同源(92%),高温能显著诱导两基因的表达,双氧水和核型多角体病毒感染亦显著上调HaPOD表达量,暗示两基因极可能在抵御逆境引起的氧化损伤中扮演重要角色。Ma等(2020)对二化螟ChilosuppressalisPOD编码基因CsPxd进行了克隆和表达分析,并评估了RNAi后对幼虫生长发育的影响,结果表明CsPxd在二化螟不同发育阶段和不同组织中的表达具有明显的时空特异性,基因敲低后预蛹到蛹的变态过程严重受阻。
褐飞虱Nilaparvatalugens属半翅目(Hemiptera)飞虱科(Delphacidae),是我国和东南亚国家水稻上的首要害虫,有远距离迁飞习性,单食性,严重危害水稻安全生产(吕进等, 2013)。施用杀虫剂是当前控制褐飞虱的重要手段。化学杀虫剂喷施和微生物侵染均可引起氧化胁迫,干扰昆虫正常生理活动,进而达到防治害虫目的(Kietal., 2012; Zhang and Feng, 2018)。然而,昆虫体内抗氧化酶系能够抵御氧化损伤,从而间接增强了害虫对化学和生物农药的耐受性。POD作为昆虫体内重要的一类抗氧化酶,在褐飞虱抵御氧化胁迫,免受氧化损伤过程中发挥的作用不可忽视。然而,目前有关褐飞虱POD的研究报道十分有限(见煜坤, 2016; 曾佳妹等, 2018)。为此,本研究联合转录组和全基因组信息,对褐飞虱POD编码基因NlPOD1进行了克隆和鉴定,分析了它在褐飞虱不同发育阶段、5龄若虫不同组织以及不同微生物诱导下表达水平的变化规律,并通过RNAi技术研究了其在褐飞虱生长发育和病原防御过程中发挥的作用,以期为利用POD开发褐飞虱绿色防控新技术提供科学依据。
1 材料与方法
1.1 供试昆虫和病原微生物
供试褐飞虱种群在人工气候室内以TN1水稻苗连续饲养繁殖50代以上。 饲养条件为:温度24±1℃、相对湿度70%±5%、光周期16L∶8D。供试细菌为大肠杆菌Escherichiacoli菌株ATCC35150和金黄色葡萄球菌Staphylococcusaureus菌株CMCC26003,于LB液体培养基中37℃培养传代;供试真菌为金龟子绿僵菌Metarhiziumanisopliae菌株Ma456,于PDA斜面培养基上25℃培养传代。
1.2 褐飞虱总RNA提取及cDNA合成
使用MiniBEST Universal RNA Extraction Kit(TaKaRa,日本)试剂盒,参照说明书提取褐飞虱总RNA。通过1%琼脂糖凝胶电泳检测RNA的完整性,利用微量分光光度计NanoDrop ND-2000(Thermo Scientific,美国)检测RNA的浓度和纯度。根据PrimeScriptTM1st Strand cDNA Synthesis Kit(TaKaRa,日本)试剂盒说明书合成cDNA第1链,并于-80℃保存备用。
1.3 NlPOD1基因克隆及序列分析
基于本实验室测得的褐飞虱转录组数据,获得一条编码褐飞虱POD的全长cDNA序列NlPOD1。设计NlPOD1全长扩增引物(表1),以1.2节所得褐飞虱cDNA为模板进行PCR扩增。PCR反应体系: 10×Ex Taq Buffer(Mg2+Plus) 5 μL, dNTPs Mixture (2.5 mmol/L) 4 μL, 上下游引物(10 μmol/L)各1 μL, cDNA模板 2 μL, Ex Taq酶0.5 μL, 用ddH2O补充体积至50 μL。扩增程序: 94℃预变性3 min; 94℃变性30 s, 55℃复性30 s, 72℃延伸2.5 min, 35个循环;72℃延伸10 min。PCR扩增产物经1.2%琼脂糖凝胶电泳、割胶回收、pMD18-T载体(TaKaRa,日本)连接后,转化入大肠杆菌感受态细胞DH5α中,挑选阳性克隆送上海桑尼生物科技有限公司测序。
利用Primer Premier 5.0软件将基因序翻译成蛋白质序列;通过ExPASy 网站在线程序 Compute pI/Mw Tool(https:∥web.expasy.org/compute_pi/)预测蛋白质分子量大小及等电点;分别利用SMART Server(http:∥smart.embl-heidelberg.de/)和SignalP-5.0 Server(http:∥www.cbs.dtu.dk/services/SignalP/)进行结构域分析和信号肽预测;利用BLASTP(http:∥blast.ncbi.nlm.nih.gov/blast.cgi)搜索比对并下载其他昆虫POD同源蛋白质序列;通过MEGA X软件采用邻接法(neighbor-joining,NJ)构建系统进化树,1 000次bootstrap检测(Kumaretal., 2018)。
1.4 NlPOD1基因时空表达模式分析
按王正亮等(2020)的方法分别收集褐飞虱不同发育历期(卵、1-5龄若虫、羽化后24 h的雌雄成虫)以及5龄若虫不同组织(头部、脂肪体、血淋巴和肠道)的样品,其中卵约300粒,1-2龄若虫分别50头,3-4龄若虫分别40头,5龄若虫30头,初羽化雌雄成虫分别为20头,不同组织样本取自于100头褐飞虱5龄若虫。按1.2节所述方法进行RNA提取和cDNA合成。qRT-PCR检测采用SYBR®Premix Ex TaqTMⅡ试剂盒(TaKaRa,日本),以18S rRNA作为内参基因,引物序列见表1。qRT-PCR反应体系: 2×SYBR®Premix Ex TaqTMⅡ 10 μL, 上下游引物(10 μmol/L)各1 μL, cDNA模板2 μL, ddH2O补齐至 20 μL。反应程序: 95℃预变性30 s; 95℃变性5 s, 60℃退火30 s, 共40个扩增循环。每个龄期和每种组织样品设置3次生物学重复和3次技术重复。基因相对表达量用2-ΔΔCt法计算(Livak and Schmittgen, 2001)。
1.5 NlPOD1基因微生物诱导表达模式分析
将大肠杆菌ATCC35150和金黄色葡萄球菌CMCC26003菌体,以及金龟子绿僵菌Ma456分生孢子以PBS水溶液配制成浓度为1×107个/mL的悬液,利用显微注射仪注射接种5龄褐飞虱若虫,接种体积为10 nL,以注射相同体积的PBS水溶液为对照。每个处理设3个生物学重复,每个重复40头试虫。分别于于0, 12, 24, 36和48 h收集褐飞虱活体,按1.2节所述方法进行RNA提取和cDNA合成,按1.4节所述方法进行qRT-PCR检测和结果分析。
1.6 NlPOD1基因dsRNA合成和RNAi分析
基于cDNA全序列,设计NlPOD1和绿色荧光蛋白GFP基因(对照)的dsRNA合成引物(表1),参照 T7 RiboMAXTMExpress RNAi System(Promega,美国)试剂盒说明书分别合成dsNlPOD1和dsGFP,其质量和浓度经检测合格后备用。

表1 引物信息
选择发育进度一致的褐飞虱5龄若虫,用微量注射仪从每头试虫第2和第3对足的基节之间注射25 nL浓度为2 000 ng/μL的dsNlPOD1,以注射等量的dsGFP作为对照组。每个处理组12个平行样:3个平行样用于检测RNAi的基因沉默效率,每个平行样20头褐飞虱,分别于dsRNA注射后2, 4, 6和8 d收集褐飞虱活体,按按1.2节所述方法进行RNA提取和cDNA合成,按1.4节所述qRT-PCR方法检测不同时间点NlPOD1的表达水平;3个平行样用于存活率测定,每个平行样40头褐飞虱,dsRNA注射后逐日定时统计褐飞虱存活数,连续统计10 d;6个平行样用于褐飞虱对病原真菌敏感性测定,每个平行样40头褐飞虱,其中3个平行样dsRNA注射后紧接着以喷雾法接种1 mL浓度为1×108个/mL的金龟子绿僵菌分生孢子悬液(0.02% Tween 80水溶液配制),另外3个平行样喷雾相同体积的0.02% Tween 80(作为空白对照),连续10 d逐日定时观察记录死亡数,并将虫尸移出保湿培养,以确认是否为真菌感染致死,并计算校正存活率。校正存活率(%)=(处理组试虫存活率/对照组试虫存活率)×100%。
1.7 数据分析
实验结果采用平均值±标准误表示,数据处理与分析采用DPS软件(Tang and Zhang, 2013)。两组样本均值差异显著性检验采用t检验法,3组及以上样本均值差异显著性检验采用单因素方差分析(one-way ANOVA)及Tukey氏HSD(Tukey’s honestly significant difference)法,差异显著性水平为P<0.05。作图采用Graphpad Prism 7.0软件。
2 结果
2.1 NlPOD1基因的克隆及序列特征
经克隆和测序验证,褐飞虱NlPOD1基因cDNA序列(GenBank登录号: MZ682107),其开放阅读框(ORF)全长2 049 bp,编码682个氨基酸,分子量大小为77.02 kD,等电点6.18。信号肽和结构域预测显示,NlPOD1的N端存在一个由29个氨基酸残基组成的信号肽,在第92-640位氨基酸残基之间具有一个完整的动物亚铁血红素过氧化物酶结构域(An_peroxidase domain),其中含钙离子结合位点和血红素结合位点。此外,NlPOD1蛋白质序列中存在一个整联蛋白识别的三肽序列“LRE”。BLAST比对结果表明,NlPOD1与茶翅蝽Halyomorphahalys、温带臭虫Cimexlectularius、蔗黄伪毛蚜SiphaflavaPOD氨基酸序列一致性分别为68.79%, 67.68%和67.67%。系统发育分析显示,NlPOD1与同属半翅目的茶翅蝽POD亲缘关系最近,且所有半翅目昆虫POD在NJ树上聚为一支,与缨翅目昆虫POD互为姐妹群。NlPOD1与双翅目和鳞翅目昆虫POD亲缘关系最远,与鞘翅目和膜翅目昆虫POD次之(图1)。
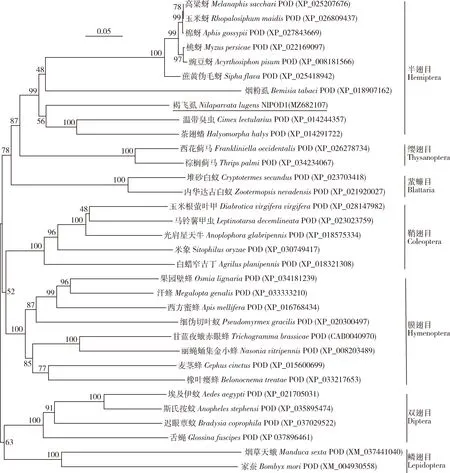
图1 采用邻接法构建的基于褐飞虱NlPOD1和其他昆虫POD氨基酸序列的系统发育树(1 000次重复)
2.2 NlPOD1基因的时空表达特征
NlPOD1表达量在褐飞虱若虫期和成虫期显著高于卵期,且高龄若虫期(4和5龄)表达量显著高于低龄若虫期(1-3龄)和成虫期的(P<0.05); 1-3龄若虫以及雌雄成虫中NlPOD1表达量无显著性差异(P>0.05);NlPOD1在5龄若虫中表达量最高,分别是卵期、低龄若虫期(1-3龄若虫期表达量的平均值)和成虫期表达量(雌雄成虫中表达量的平均值)的22.4, 1.6和1.8倍(图2: A)。
NlPOD1在5龄若虫头、脂肪体、血淋巴和肠道中均有表达;以在头中NlPOD1的表达量为基数,在血淋巴和肠道中表达量最高,分别是在脂肪体中表达量的7.8和7.0倍,但NlPOD1表达量在血淋巴和肠道之间差异不显著(P>0.05)(图2: B)。
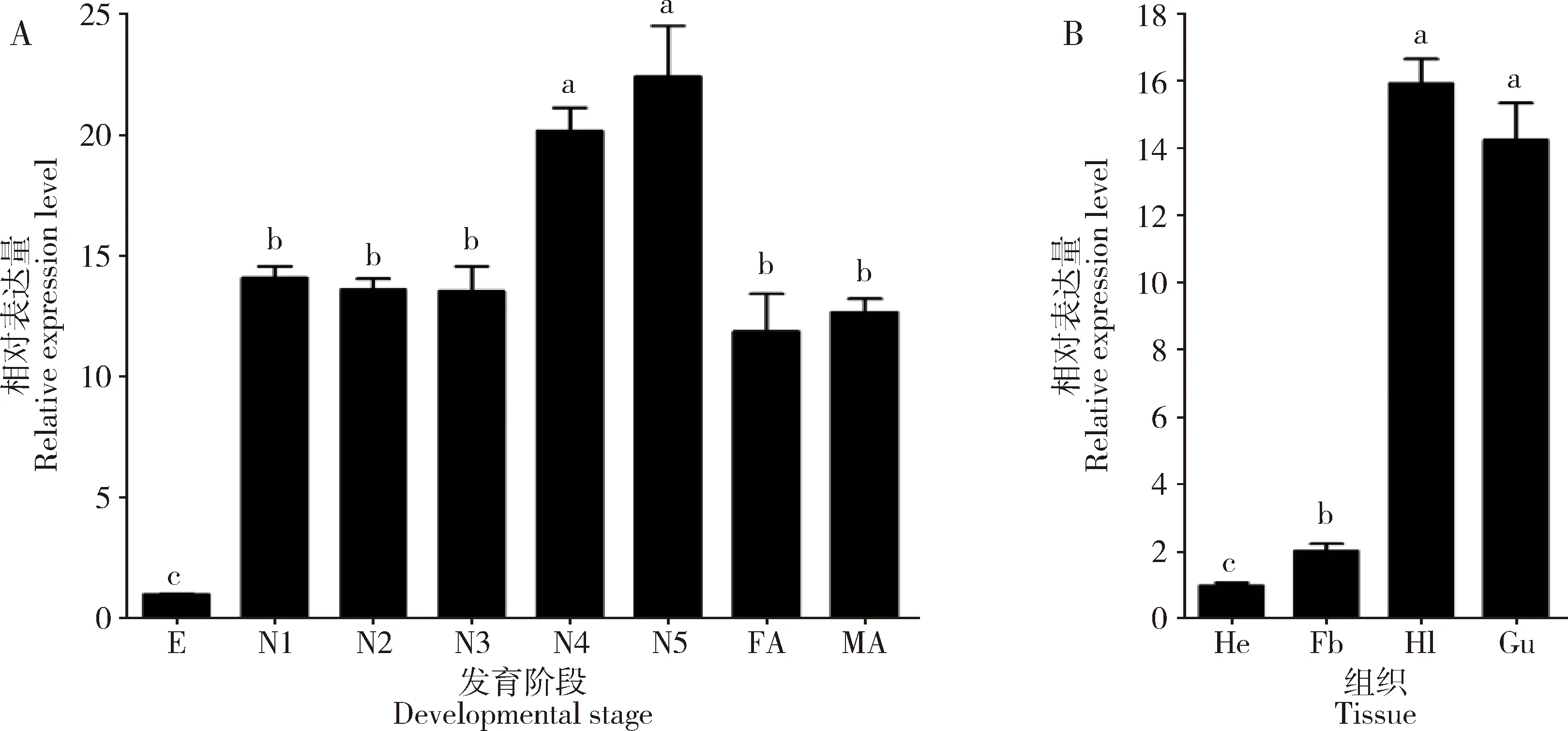
图2 NlPOD1在褐飞虱不同发育时期(A)和5龄若虫不同组织(B)中的表达模式
2.3 NlPOD1基因的微生物诱导表达模式
不同微生物诱导条件下褐飞虱5龄若虫体内NlPOD1基因的表达模式如图3所示。结果表明,与对照组(注射PBS水溶液)相比,大肠杆菌诱导48 h内各时间点NlPOD1表达量均显著上调(P<0.05),且在36 h时上调水平最高。金黄色葡萄菌刺激12和24 h后,NlPOD1的表达量较对照组分别提高了1.7和5.6倍(P<0.05),但在诱导36和48 h时与对照无显著差异(P>0.05)。金龟子绿僵菌对NlPOD1基因的诱导表达模式与金黄色葡萄球菌类似,金龟子绿僵菌接种24 h内可显著诱导NlPOD1的表达,但24 h后无显著的诱导效果。

图3 褐飞虱5龄若虫NlPOD1的微生物诱导表达模式
2.4 NlPOD1基因的干扰效率
qRT-PCR分析表明,显微注射dsNlPOD1可有效抑制褐飞虱5龄若虫体内NlPOD1的表达(图4)。与对照组(注射dsGFP)相比,dsNlPOD1注射2, 4, 6和8 d后,NlPOD1的表达量分别下降了70.7%, 81.2%, 71.4%和64.7%,均达到显著水平(P<0.05)。

图4 注射dsRNA后褐飞虱5龄若虫NlPOD1的相对表达水平
2.5 RNA干扰NlPOD1对褐飞虱存活率和抵御病原真菌侵染能力的影响
生物测定实验表明,与对照组(注射dsGFP)相比,显微注射dsNlPOD1后褐飞虱5龄若虫存活率无显著差异(P>0.05); dsNlPOD1处理组褐飞虱5龄若虫在金龟子绿僵菌侵染5和8 d后的校正存活率分别为36.8%和13.1%,低于对照组的53.7%和30.1%(图5: A)。金龟子绿僵菌对dsNlPOD1处理组褐飞虱的致死中时(LT50)为4.5 d,与对照组(5.4 d)相比下降了15.5%,且达到显著水平(P<0.05)(图5: B)。 结果说明,通过RNAi抑制NlPOD1表达可显著降低褐飞虱对金龟子绿僵菌侵染的抵御能力。

图5 注射dsRNA和接种金龟子绿僵菌后褐飞虱5龄若虫的校正存活率(A)和致死中时(B)
3 讨论
为了进一步研究褐飞虱POD的功能及其在开发褐飞虱防控技术中的应用潜力,本研究克隆鉴定了一条新的褐飞虱POD编码基因并命名为NlPOD1,分析了其时空表达规律和微生物诱导表达模式,并初步解析了其在褐飞虱生长发育和抵御昆虫病原真菌侵染过程中的作用。
本研究生物信息学分析显示,NlPOD1具有POD基因家族成员的典型特征,即编码蛋白序列中含有一个高度保守的动物亚铁血红素过氧化物酶结构域(An_peroxidase domain)。信号肽预测显示NlPOD1为分泌型蛋白,表明NlPOD1极可能经内质网和高尔基体的加工与运输并最终定位于细胞质中发挥作用。NlPOD1除含亚铁血红素和钙离子结合位点外,还存在一个整联蛋白的三肽识别序列(LRE),暗示其可与整联蛋白结合,并借助整联蛋白介导的细胞间以及细胞与胞外基质之间的粘附作用,从而在褐飞虱先天免疫中发挥作用。类似的结构特点同样出现于其他昆虫POD蛋白质序列中,如整联蛋白三肽识别序列“RGD”和“NGR” 可分别在果蝇和甜菜夜蛾POD序列中被鉴定到(Vázquezetal., 2002; Parketal., 2014)。多序列比对分析与系统发育分析结果吻合,NlPOD1与茶翅蝽POD蛋白序列同源性最高,两者亲缘关系最近,且不同类群昆虫中POD进化相对保守(图1)。
NlPOD1在褐飞虱体内的表达具有明显的时空特异性(图2)。NlPOD1表达量在褐飞虱若虫期和成虫期显著高于卵期(图2: A),表明该基因在褐飞虱从卵发育成若虫的过程中发挥重要作用。在所有发育阶段中,5龄若虫NlPOD1表达量最高,这可能与羽化前虫体新陈代谢过程加剧导致ROS水平上升有关。类似现象同样见于其他昆虫中,如粘虫MsPOD和棉铃虫HaPOD在化蛹与羽化阶段表达量最高,而低龄幼虫中表达量相对较低(申忠健等, 2016; 杨航等, 2019)。NlPOD1在褐飞虱不同组织中均有表达,但不同组织中的表达水平不尽相同(图2: B)。与褐飞虱POD编码基因Nl25323和NlPER1在头部高表达,在肠道中低表达的表达模式(见煜坤, 2016; 曾佳妹等, 2018)不同,NlPOD1在褐飞虱头中的表达量最低,而在血淋巴和肠道中表达量相对较高(图2: B)。上述结果表明NlPOD1与Nl25323和NlPER1的生理功能可能存在显著差异。血淋巴是昆虫免疫防御异源有害物质侵害的主要场所,昆虫肠道可通过调节ROS水平来防御外来微生物入侵并维持肠道微生物稳态(姚志超等, 2018; Clark., 2020)。由NlPOD1的空间表达特异性可见,NlPOD1极可能在褐飞虱血淋巴和肠道防御过程中发挥重要作用。
大量研究表明,昆虫在受到温度、化学杀虫剂、寄生性天敌、病原微生物等非生物胁迫和生物胁迫时会大量产生ROS,而虫体会及时启动包括POD在内的抗氧化防御系统以避免过量ROS引起的氧化损伤(Mantaetal., 2014; Nesmelovetal., 2018; Dampcetal., 2020)。 qRT-PCR分析结果显示,NlPOD1表达水平受到病原微生物的显著诱导,但其诱导模式与病原微生物种类密切相关(图3)。大肠杆菌(革兰氏阴性细菌)诱导48 h内各时间点NlPOD1表达量均显著上调,并于36 h时达到顶峰,表明NlPOD1积极参与褐飞虱对革兰氏阴性细菌的防御响应。NlPOD1的这种大肠杆菌诱导表达模式与褐飞虱POD编码基因Nl25323明显不同,后者在大肠杆菌刺激下表达水平无显著变化。该结果进一步表明褐飞虱体内不同POD的生物学功能存在显著差异,研究显示Nl25323主要影响褐飞虱抗性种群的生存和繁殖,与寄主适应性密切相关(见煜坤, 2016)。金黄色葡萄球菌(革兰氏阳性细菌)和金龟子绿僵菌(丝状病原真菌)对NlPOD1表达的诱导效应相似,NlPOD1表达量均呈现先上调后回稳的态势(图3),表明该基因主要在褐飞虱抵御金黄色葡萄球菌和金龟子绿僵菌侵染过程的早期阶段发挥作用。
绿僵菌作为丝孢类生防真菌的典型代表,具有广谱高毒力、对环境友好以及不易使害虫产生抗药性等优点,已被证实在褐飞虱生物防治过程具有较大的应用潜能(Jinetal., 2011; Tangetal., 2019)。然而,相对于化学农药,真菌杀虫剂的田间防效可能受到害虫自身防御保护系统的制约。因此,削弱靶标害虫的防御保护体系可有效提高昆虫病原真菌的杀虫毒力,从而提升和增强真菌杀虫剂的实用性。RNAi是一种通过dsRNA来高效特异性抑制目标基因表达的技术,广泛应用于昆虫基因功能解析和害虫生物防治研究领域(Liuetal., 2020)。有研究表明,将昆虫病原真菌与dsRNA混配使用或通过基因工程手段在昆虫病原真菌中过表达dsRNA可对靶标害虫的防治具有协同增效作用(Chenetal., 2015; 潘春艳等, 2016; 崔鹤, 2019)。 本研究结果显示,RNA干扰褐飞虱NlPOD1基因后,金龟子绿僵菌对褐飞虱5龄若虫的致死率显著增强(图5)。可见,NlPOD1可作为开发RNAi和病原真菌介导的褐飞虱防治技术中的一个潜在靶标。后续可进一步通过基因工程手段构建过表达dsNlPOD1的绿僵菌重组菌株,并评价其在褐飞虱防治过程中的有效性和安全性。
