重组酶聚合酶扩增反应结合侧流层析试纸条技术快速鉴别大西洋鳕鱼制品真伪
2022-09-16王慧芳喻勇新李晨虹陈文隽凌岚馨周颖
王慧芳,喻勇新,2,李晨虹,陈文隽,凌岚馨,周颖
1(上海海洋大学 食品学院,上海,201306)2(农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海,201306) 3(上海海洋大学 环境DNA技术与水生态健康评估工程中心,上海,201306) 4(上海海洋大学 海洋动物系统分类与进化上海高校重点实验室,上海,201306)
大西洋鳕(Gadusmorhua)是鳕形目鳕科鳕属鱼类,作为一种蛋白质含量高、脂肪含量低、肉质致密的水产品广受欢迎,销量呈逐年递增的趋势。鳕形目鱼类品种繁多,从感官特点上难以分辨其捕捞海域、来源和种类,而不同的鱼类品种市场价格差异大,造成以次充好或标识错误的现象时有发生[1]。曾多次出现过用“油鱼”即棘鳞蛇鲭(Ruvettuspretiosus)和异鳞蛇鲭(Lepidocybiumflavobrunneum)冒充“大西洋鳕鱼”的产品进行贩卖,导致消费者食用后出现过敏、腹泻的情况[2]。目前,我国鳕鱼成分鉴定标准或真伪检测方法主要有2种,均基于实时荧光定量PCR(quantitative real-time PCR, qPCR)技术[2-3]。但是,该方法需要在实验环境分区的条件下进行,对实验器皿、人员操作、防污染措施都有较高的要求[4],且依赖复杂精密的温控设备,成本高,在一定程度上限制了它的应用场景,无法达到现场快速检测的目的[5]。因此,建立一种灵敏、操作简便、特异性强,能够快速检测大西洋鳕鱼及其相关制品的方法迫在眉睫。
本文首次研究利用重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)快速鉴定大西洋鳕鱼及其制品的方法。RPA技术是模拟DNA复制机制,用重组酶、单链结合蛋白和DNA聚合酶代替传统PCR的热循环解链过程,实现了在恒定适宜温度(37~56 ℃)下核酸的快速(15~20 min)扩增[6]。作为一种新型的恒温核酸扩增技术,RPA技术与PCR技术具有相似的功能,都有较强的灵敏性和特异性,除此之外RPA技术有反应时间短,操作简便,不需精密仪器等优点[7-8]。自2006年RPA技术被发明后,已广泛应用于有害微生物检测、病毒检测以及临床诊断等重要领域,也有应用于畜禽肉类检测上的报道[9-10],但目前还没有应用RPA技术检测水产品真伪的研究。本研究将RPA技术与侧流层析试纸条技术(lateral flow dipstick,LFD)相结合实现检测结果可视化,其原理是因RPA-LFD体系中存在核酸外切酶Ⅳ(endonuclease Ⅳ,NFO)、5′端带有荧光FAM基团的探针以及带有生物素标记的反向引物[11],使得杂交扩增出的产物带有双标记。将稀释后的产物滴加在LFD试纸条上,双标产物会与试纸条抗FAM抗体结合,形成三元复合物,当其流经检测线时,会与检测线上的生物素抗体结合显色,可以根据检测线的显色情况判断检测样品的真伪[12]。而未杂交的产物与LFD试纸条上的抗FAM抗体结合,形成不含有生物素的两元复合物,与质控线上的抗FAM抗体的抗体结合显色[13]。
本研究基于RPA-LFD技术建立了针对大西洋鳕鱼现场快速检测的方法,具有特异性高、灵敏度强、操作简便、结果可视等优点,为大西洋鳕鱼的现场快速检测提供了技术支持。
1 材料与方法
1.1 材料与试剂
大西洋鳕、狭鳕(Theragrachalcogramma)、南极犬牙鱼(Dissostichuseleginoides)、异鳞蛇鲭、马舌鲽(Reinhardtiushippoglossoides)等冷冻产品,京东超市及上海市农贸市场。Ezup柱式动物基因组DNA抽提试剂盒(Sangon),上海生工生物工程有限公司;DNA恒速快速扩增试剂盒及HybriDetect试纸条、DNA恒温快速扩增WLN8230KIT试剂盒、超快速核酸WLR8203释放剂,潍坊安普未来生物科技有限公司。
1.2 仪器与设备
Vortex-2漩涡混匀仪,上海沪析实业有限公司;NanoDrop3300荧光分光光度计,赛默飞世尔科技公司;Centrifuge 5430小型台式高速冷冻离心机,Eppendorf艾本德;Light Cycler 480实时荧光PCR仪,瑞士Hoffmann-La Roche有限公司。
1.3 样品DNA提取
利用Ezup柱式动物基因组DNA抽提试剂盒(Sangon,B518 251-0050)提取DNA,取4条大西洋鳕的鱼肉组织各25 mg以及狭鳕、南极犬牙鱼、异鳞蛇鲭、马舌鲽的鱼肉组织各25 mg剪碎置于1.5 mL的离心管中,加入180 μL的Buffer ACL和20 μL的蛋白酶K溶液,振荡混匀置于56 ℃水浴下5 h使细胞裂解。随后加入200 μL Buffer CL和200 μL无水乙醇充分颠倒混匀,转入吸附柱收集管中,静置2 min,以10 000 r/min室温离心1 min,倒掉收集管中的废液。再将吸附柱放回收集管中,加入500 μL CW1 solution,以10 000 r/min室温离心30 s,倒掉收集管中的废液。再将吸附柱放回收集管中,加入500 μL CW2 solution,以10 000 r/min离心30 s,倒掉收集管中的废液。将吸附柱重新放回收集管中,以12 000 r/min室温离心2 min,去残留的CW2 solution。最后取出吸附柱,放入1.5 mL离心管中,加入150 μL CE Buffer静置3 min后以12 000 r/min室温离心2 min,收集DNA溶液并按照CL3036~CL3043对所提取的基因组DNA进行编号。用NanoDrop3300荧光分光光度计测定样品的DNA浓度,置于-20 ℃保存备用。
1.4 模板DNA的鉴定
利用MiFish引物[14-15],序列如表1所示,对样品DNA线粒体基因组上的12S区域进行PCR扩增,并将产物进行一代测序,测序结果与GenBank (http://www.ncbi.nlm.nih.gov/genbank/)上的物种序列进行BLAST比对,鉴定样品的物种种类。鉴定结果为:CL3036~CL3039均为大西洋鳕鱼,CL3040为狭鳕鱼,CL3041为南极犬牙鱼,CL3042为异鳞蛇鲭,CL3043为马舌鲽。
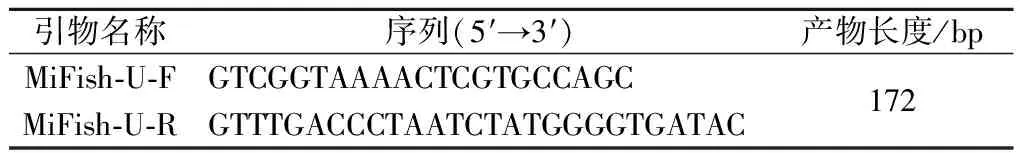
表1 MiFish引物序列信息Table 1 Sequences information of the MiFish primers
1.5 RPA-LFD引物和探针的设计
根据我国进出口市场以及大型水产品交易市场的调研结果,选择异鳞蛇鲭、小鳞犬牙南极鱼、莫氏犬牙南极鱼、裸盖鱼、马舌鲽等常用来冒充大西洋鳕鱼的5种水产品品种,从GenBank上下载5种鱼类的线粒体基因组序列(表2),利用PrimedRPA软件进行初步比对,筛选出基因序列中同源性相对较高的保守区域,再根据RPA引物的设计原则,利用MEGA-X工具和人工筛选,设计针对大西洋鳕鱼的高特异性引物及探针。其中下游引物5′端带有生物素标记,探针5′端用FAM基团修饰,nfo的识别位点用dSpacer(四氢呋喃,THF)修饰,3′末端用C3-Spacer标记。设计好的引物由苏州金唯智生物科技有限公司合成,探针由生工生物工程(上海)股份有限公司合成,序列见表3。

表2 大西洋鳕鱼和常见冒充鳕鱼的鱼类Table 2 Atlantic cod and other popular species used for adulterated cod products

表3 大西洋鳕鱼RPA-LFD扩增引物和探针Table 3 RPA-LFD amplifying primers and probes for Gadus morhua
1.6 RPA-LFD反应条件的确立
以拷贝数为103拷贝/μL的CL3036为大西洋鳕鱼DNA扩增模板,确定RPA-LFD的扩增体系。根据DNA恒温快速扩增试剂盒的操作说明书,配制含有A buffer 29.4 μL、10 μmol/L的上下游引物各2 μL、10 μmol/L的探针0.6 μL和DNA模板2μL的体系,将其振荡混匀加入B buffer 2.5 μL及灭菌去离子水11.5 μL构建50 μL的RPA反应体系,在38 ℃金属浴反应12 min。将反应产物用无菌去离子水稀释50倍,用带有抗FAM和Biotin标记的LFD试纸条对稀释后的产物进行检测。LFD试纸条上的质控线和检测线均有条带即为阳性扩增,仅质控线有条带为阴性扩增,若质控线无条带则实验结果无效。
1.7 大西洋鳕鱼RPA-LFD引物及探针筛选
以CL3036大西洋鳕鱼为阳性对照,CL3042异鳞蛇鲭为阴性对照,灭菌去离子水为空白对照,利用DNA恒温快速扩增试剂盒筛选大西洋鳕鱼RPA-LFD的最佳引物及探针。配制50 μL RPA体系,在38 ℃金属浴反应12 min,用LFD试纸条对稀释后的产物进行检测。根据已知扩增样品的物种信息判断LFD试纸条检测结果的准确性,筛选出可以特异性扩增大西洋鳕鱼的引物及探针。
1.8 RPA-LFD反应条件的优化
针对不同的目标物种所设计的引物和探针,RPA-LFD最佳反应温度和时间均有差异[16]。本实验以大西洋鳕鱼CL3036的基因组DNA作为阳性模板,以CL3042的基因组DNA为阴性模板,分别配制出5组50 μL的RPA体系,将其静置于36、38、40、44、48 ℃的金属浴中反应12 min,将扩增产物用无菌去离子水稀释50倍后滴加在LFD试纸条上,5 min后观察条带显色情况并拍照记录,确定最佳反应温度。在最优反应温度下,以大西洋鳕鱼CL3036的基因组DNA作为阳性模板,以CL3042的基因组DNA为阴性模板,设置梯度反应时间:8、10、12、14、16 min。按照RPA-LFD实验步骤,将RPA体系恒温孵育相应时间,根据LFD试纸条显色情况,确定最佳反应时间[17]。
1.9 RPA-LFD特异性的测定
在最佳反应条件下,以CL3036~CL3043的基因组DNA为模板,灭菌去离子水为空白对照,进行RPA-LFD扩增检测,验证大西洋鳕RPA-LFD检测方法的特异性。
1.10 现场快速检测市售“鳕鱼”制品
利用DNA恒温快速扩增试剂盒对20份市售带有“鳕”字的水产品进行RPA-LFD现场快速检测,鉴别其是否为大西洋鳕。在检测现场取鱼肉组织30 mg左右,将其剪碎研磨至匀浆状,取20 μL的组织样与40 μL的超快速核酸释放剂振荡混匀,用恒温可调温式保温垫作为现场实验简易热量来源装置,将其温度调节到一档:35~40 ℃,将组织样与快速核酸释放剂混合液静置于保温杯垫上5 min,使样品DNA快速释放。取混合液中的上清液2 μL作为DNA模板,配成50 μL的RPA体系。随后将保温垫温度调节到二档40~45 ℃,将50 μL的RPA体系静置于保温杯垫上反应12 min,反应产物用无菌去离子水稀释50倍后滴加在LFD试纸条进行检测。现场快速检测结果与PCR扩增后的一代测序结果进行比对,验证RPA-LFD现场快速检测结果的准确性。
2 结果与分析
2.1 RPA-LFD最佳引物和探针的确定
根据RPA引物和探针的设计原则,针对大西洋鳕鱼ND2保守区设计了2对引物及对应的探针,并以CL3036标准DNA为阳性模板,CL3042标准DNA为阴性模板,dd双蒸水为空白对照分别用2组引物及探针进行RPA-LFD扩增检测,结果如图1所示,第一对引物和探针测试结果为CL3036阳性、CL3042及空白对照为阴性,检测结果符合实验预期。利用第二对引物和探针进行扩增的CL3042阴性对照组出现假阳性,与实验预期不符。由此确定上游引物F1:5′-GCTGAATAATCCTTGTAATGCAATTTAA-3′、下游引物R1:5′-(Biotin)-CTAAAGAAAGAAGAATTATTGGGGTGATT-3′及探针T1:5′-(FAM)-AACTTTCTCAACTTTTATAATTTTTAAAACTAATT(dSpacer)CTTCTACCACGGTAAA-(C3 spacer)-3′。

图1 引物探针筛选结果Fig.1 Result of primer and probe screening注:1~3分别为用引物F1、R1、探针T1对CL3036、CL3042和 PCR水进行的RPA-LFD扩增实验结果图;4~6分别为用引物 F2、R2、探针T2对CL3036、CL3042和PCR水进行的 RPA-LFD扩增实验结果图
2.2 RPA-LFD检测反应条件的优化
反应温度优化实验的结果如图2所示,反应温度过高使阴性样品产生阳性条带影响实验结果,温度过低条带显色不明显,根据实验结果确定最佳温度为44 ℃。

图2 不同培养温度下的实验结果Fig.2 Results of different incubation temperature注:A1~A5分别为CL3036在不同的温度下的RPA-LFD实验结 果图,A1-36 ℃;A2-38 ℃;A3-40 ℃;A4-44 ℃;A5-48 ℃; B1~B5分别为CL3042在不同的温度下的RPA-LFD实验结 果图,B1-36 ℃;B2-38 ℃;B3-40 ℃;B4-44 ℃;B5-48 ℃; A6、B6为空白对照组
反应时间优化实验的结果如图3所示,反应时间低于12 min会反应不完全导致显色不明显,超过16 min会出现假阳性,故实验最佳时间确定为14 min。

图3 不同培养时间下的实验结果Fig.3 Results of different incubation time注:A1~A5分别为CL3036在不同的反应时间下RPA-LFD 实验结果图,A1-8 min,A2-10 min,A3-12 min, A4-14 min,A5-16 min,A6-空白对照组;B1~B5分别 为CL3042在不同的反应时间下进行的RPA-LFD实验结 果图,B1-8 min,B2-10 min,B3-12 min,B4-14 min, B5-16 min,B6-空白对照组
2.3 RPA-LFD特异性实验
对CL3036~CL3039大西洋鳕鱼、CL3040狭鳕鱼、CL3041南极犬牙鱼、CL3042异鳞蛇鲭、CL3043马舌鲽等8种水产品以及灭菌去离子水作为空白对照进行RPA-LFD扩增检测(图4)。结果表明,CL3036~CL3039出现阳性反应,其他样品均为阴性,检测结果与PCR扩增测序结果一致,证明本研究建立的大西洋鳕鱼RPA-LFD检测方法特异性良好。

图4 引物探针的特异性检测结果Fig.4 Results of specific test of primer and probe注:1~4-大西洋鳕鱼;5-狭鳕鱼;6-南极犬牙鱼; 7-异鳞蛇鲭;8-马舌鲽;9-灭菌去离子水
2.4 现场实时检测市售“鳕鱼”制品结果
对20份市售带有“鳕”字的水产品进行RPA-LFD现场快速检测,鉴定其是否为大西洋鳕鱼。检测样品中15份为大西洋鳕鱼,剩余5份非大西洋鳕鱼制品。随后将20份样品按序编号,利用PCR扩增进行一代测序鉴定其物种。RPA-LFD检测结果与测序结果一致,见表4。
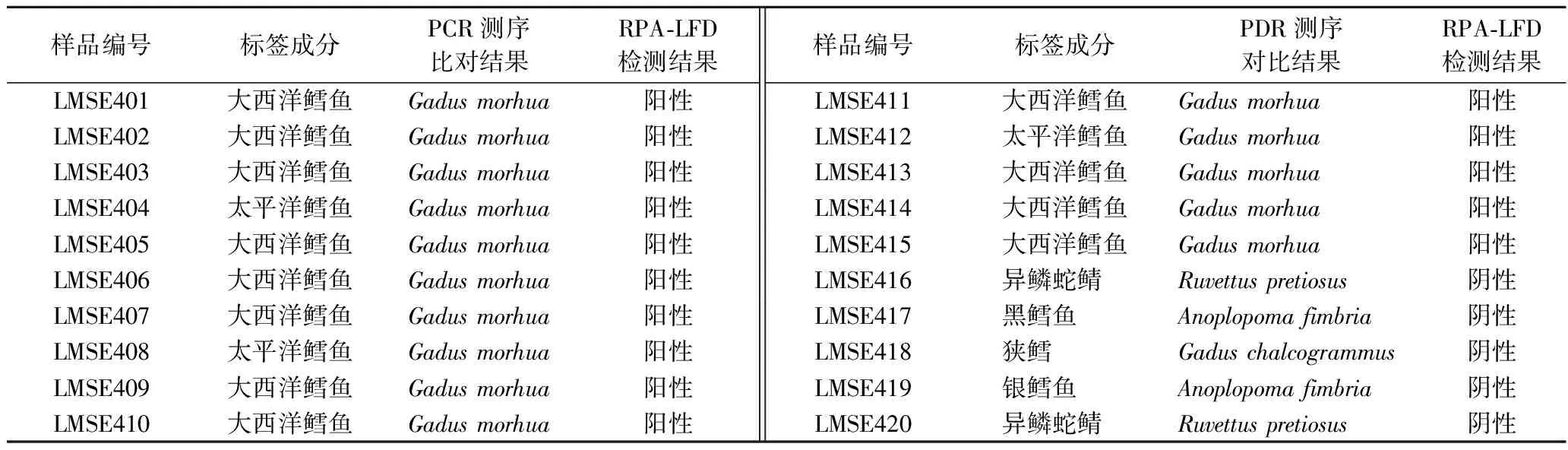
表4 野外实时检测市售“鳕鱼”类及其他鱼类制品Table 4 Real-time testing on “cod” and other fish products sold in the market in the field
3 讨论
近年来,曾多次出现过将“油鱼”棘鳞蛇鲭和异鳞蛇鲭冠以“大西洋鳕鱼”的名字贩卖,消费者购买假鳕鱼食用后,发生腹泻的事件时有发生[18-19]。林霖等[20]利用SN/T 3589.7—2013对常见的鳕鱼制品进行检测,发现该技术由于需建立标准曲线容易出现假阳性,并且无法应用于抽取的全部鳕鱼制品,反应过程也需要PCR仪等高精密仪器无法做到现场实时快速检测。此外,李新光等[21]、王敏等[22]应用DNA条形码技术,对市场上随机抽取的鳕鱼制品进行检测,结果显示该方法可以检测出众多鳕鱼品种,如大西洋鳕鱼、格陵兰鳕鱼(Gadusogac)、狭鳕、绿青鳕(Pollachiusvirens)等。该方法具有检测范围广、操作简单、鉴定效率高等优点,但存在混合制品获得单一的DNA条形码片段难度大,检验操作复杂,结果分析难等缺点。SAULL等[23]基于大西洋鳕鱼的cytb基因设计出4对LAMP引物,在63 ℃下恒温扩增60 min,检测出大西洋鳕鱼。该方法特异性强、灵敏度高但是检验所需的引物设计难度大,反应时间较长,应用于鳕鱼制品的现场快速检测存在一定难度[24]。所以目前已有的检测方法由于需要大型精密实验仪器,实验操作复杂或对实验环境要求高,反应时间长等原因均无法在现场完成对大西洋鳕鱼的实时检测。
而RPA技术作为新型核酸扩增技术,具有灵敏性强、效率高、成本低、易操作等特点。研究人员只需要根据目标物种的核酸序列设计并合成RPA上、下游引物及探针,就可以利用RPA试剂盒进行RPA反应。本文所提出的RPA-LFD实验方法,是将RPA技术与侧流层析试纸条技术相结合,做到了在短时间内结果可视,不需要PCR仪等精密仪器,在控温式保温杯内即可完成扩增反应,具有灵敏性强、特异性高、易操作、能够现场快速检测等优点[25-26]。RPA试验的关键节点为设计高特异性的引物和探针,大多数常用的PCR引物、探针不适合用于RPA反应体系。目前,获得一对“好”引物的具体规则还未完全明确,也没有专门的设计软件可供使用,因此通过试验来筛选最佳引物是不可缺少的环节。本试验结果表明温度和反应时间也是重要的试验条件,温度过高、过低,或者反应时间过长、过短均可能对整个实验造成根本性的影响,因此,也需要对反应条件和体系进行优化,以达到最好的检测效果。
4 结论
综上,本研究所建立的大西洋鳕鱼RPA-LFD方法可以准确、高效地检测出大西洋鳕鱼的真伪。该方法为大西洋鳕鱼的现场快速检测提供了科学依据,具有良好的应用前景,为其他水产品现场快速检测提供了新思路。RPA-LFD技术填补了传统检测技术依赖精密实验仪器、无法完成现场快速检测的技术空缺,在现场快速检测和低资源环境检测领域存在巨大优势。但RPA技术存在引物和探针设计难度大,没有专门的设计软件,实验条件需要人为优化等局限。这需要科研人员的共同努力,不断完善RPA研究体系,为快检领域提供技术支持。未来RPA技术在突发疾病病原检测、食品质量安全检测、低资源环境检测领域会有新的突破,将会得到广泛的应用和推广。
