K-115增强自噬调控TGF-β1诱导的人Tenon囊成纤维细胞活化
2022-09-16田净净赵智华马清敏李科军贾志旸
樊 芳,田净净,赵智华,马清敏,李科军,贾志旸
作者单位:1(050000)中国河北省石家庄市,河北省人民医院眼科;2(050000)中国河北省石家庄市,河北省胸科医院眼科
0引言
青光眼是全球重要的致盲性眼病[1],我国青光眼的患病人数也在逐年增加。目前阻止青光眼进展唯一有效的方法是控制眼压。在药物和激光不能有效降低眼压的情况下,抗青光眼手术是控制眼压的重要手段。尽管近年来有很多非滤过道依赖性手术的有效性被证实,但青光眼滤过性手术(glaucoma filtration surgery,GFS)目前仍然是临床上控制眼压的经典术式。该手术能有效控制眼压,但术后滤过区域纤维增殖是导致手术失败的主要原因。虽然术中应用抗代谢药物可以控制滤过区域瘢痕化,提高手术成功率,但同时也增加了患者眼表损伤及滤过泡渗漏等并发症出现的概率[2-4]。因此,GFS术中或术后寻找一种有效且安全的方法,能够控制术后瘢痕形成且不增加其他并发症发生率,是值得研究的问题。K-115是一种新型降眼压药物,可以通过调控细胞骨架作用减少小梁网阻力,增加小梁网房水流出速率,对开角型青光眼有明确的降眼压效果[5-6]。研究证实,除了降眼压作用外, K-115也参与调控GFS术后瘢痕化过程,但是其相关调控机制并不完全清楚[7]。自噬是细胞受到外界刺激后,增强自身的吞噬功能,降解细胞自身有害物质,维持细胞自身稳态的代谢途径。在肝肾等器官纤维化疾病中自噬已被证实具有重要的调控作用[8-10]。本研究旨在探讨K-115调控GFS术后瘢痕化是否受到细胞自噬功能的影响。
1材料和方法
1.1材料
1.1.1标本收集标本取自2018-09/2019-09于河北省人民医院眼科行青光眼手术患者的Tenon囊组织,采用组织块法进行人Tenon囊成纤维细胞(human Tenon’s finroblasts,HTFs)的原代及传代培养。本实验遵循《赫尔辛基宣言》,实验方案经河北省人民医院医学伦理委员会审核批准[批准号:2017科伦审第(05)号],详细告知患者实验方案,取得患者同意并签署知情同意书。
1.1.2主要试剂和仪器设备培养基、胎牛血清、胰蛋白酶、Hanks液(美国Gibco公司),CCK-8试剂盒(日本Dojindo公司), 转化生长因子-β1(transforming growth factor-β1,TGF-β1)(美国Peprotech公司),K-115(美国MCE公司),EMbed 812包埋试剂盒(美国Electron Microscopy Sciences,公司), Hoechst 33342/PI双染试剂盒(北京Solarbio公司)。倒置相差显微镜(HF100F,日本Nikon公司),自动多功能酶标仪(Mustikan,芬兰Labsystem公司),透射电子显微镜(HT7700,日本Hitachi公司),切片机(UC7,德国Leica公司)。
1.2方法
1.2.1细胞培养和处理在组织块接种后3~7d可见原代HTFs从组织块边缘游出,约2wk达到80%~90%融合,急性传代培养,经免疫组织化学法鉴定可见波形蛋白阳性表达,角蛋白表达阴性。取第3~6代细胞进行实验,细胞分为4组:(1)对照组:加入溶剂二甲基亚砜(DMSO)处理;(2)TGF-β1组:加入10μg/L TGF-β1处理24h;(3)TGF-β1+5 K-115组:5μmol/L K-115预处理2h后,加入10μg/L TGF-β1处理24h;(4)TGF-β1+10 K-115组:10μmol/L K-115预处理2h后,加入10μg/L TGF-β1处理24h。由于无血清饥饿是诱导细胞自噬的刺激因素,故本研究未采用无血清培养基培养细胞,以排除无血清饥饿对细胞自噬水平的影响。所有实验重复至少3次。
1.2.2CCK-8法检测细胞增殖能力参考试剂盒说明书操作步骤,对数期生长的HTFs以5×103/孔接种于96孔板,每组设6个复孔,细胞分组处理结束后,每孔中加入CCK-8溶液,孵育2h后应用酶标仪在450nm处测量吸光度。为研究单独应用K-115对细胞增殖的影响,这部分研究增加了仅添加5μmol/L K-115的5 K-115组和仅添加10μmol/L K-115的10 K-115组。
1.2.3划痕试验检测细胞迁移能力对数期生长的HTFs以4×105/孔接种于六孔板中,置于37℃、5%CO2培养箱中培养24h后应用10μL Tip头在六孔板中做垂直划痕,以PBS冲洗去除细胞残片后,按上述分组方法处理细胞,置于相差显微镜下观察并记录划痕距离后再置于37℃、5%CO2的培养箱培养24h后于相差显微镜再次观察并记录划痕距离,计算迁移距离百分数,迁移距离百分数=24h划痕宽度/0h划痕宽度×100%。
1.2.4透射电子显微镜观察细胞内自噬小体按上述分组方法处理细胞后用0.1mol/L碳酸氢钠(pH7.4)缓冲液配制的3%戊二醛固定HTFs 1h,然后0.1mol/L磷酸缓冲液配制的1%锷酸避光室温固定HTFs 2h。用分级醇脱水后,将细胞渗透包埋于EMbed 812包埋剂中,并在60℃下聚合48h。树脂块在切片机上制作切片后用醋酸铀酰和铅染色,并于透射电子显微镜下观察。本研究增加了自噬抑制剂3-MA作为自噬阴性对照组即TGF-β1+3-MA组,采用5mmol/L 3-MA预处理细胞2h后,加入10μg/L TGF-β1处理24h,并增加了自噬激动剂雷帕霉素作为自噬阳性对照组即TGF-β1+Rap组,采用100nmol/L雷帕霉素预处理细胞2h后,加入10μg/L TGF-β1处理24h。
1.2.5Hoechst33342染色法检测细胞凋亡取对数生长期的HTFs接种于6孔板,按上述分组方法处理细胞,并用PBS将处理过的细胞充分洗涤2~3次。将1mL细胞染色缓冲液、5μL Hoechst 33342染色液、5μL PI染色液依次加入各孔中,轻轻摇匀,然后在4℃冰箱中孵育30min。用PBS溶液洗涤1次,置于荧光显微镜下观察。

2结果
2.1细胞增殖能力CCK-8实验结果显示,对照组、TGF-β1组、TGF-β1+5 K-115组、TGF-β1+10 K-115组、5K-115组、10 K-115组吸光度值分别为0.98±0.04、1.31±0.06、1.20±0.03、1.00±0.08、0.89±0.06、0.91±0.05,差异有统计学意义(F=56.78,P<0.001)。与对照组相比,TGF-β1组细胞增殖能力显著增加(P<0.01);与TGF-β1组相比,TGF-β1+5 K-115组和TGF-β1+10 K-115组细胞增殖能力均降低(P<0.01),见图1。此外,与对照组相比,5、10μmol/L K-115均对细胞增殖存在一定的抑制作用(P=0.013、0.043)。
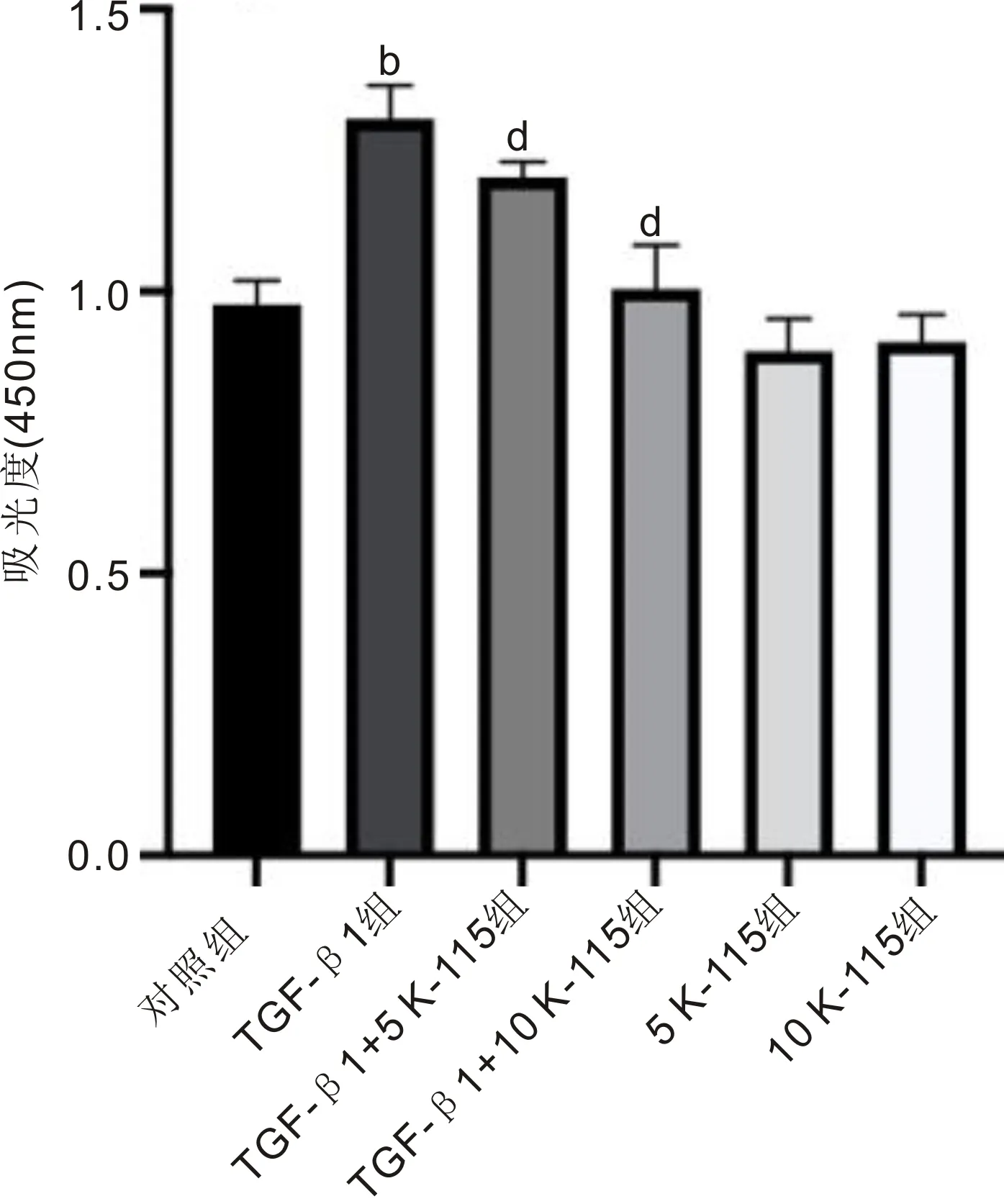
图1 K-115对TGF-β1诱导的HTFs增殖的影响 bP<0.01 vs 对照组;dP<0.01 vs TGF-β1组。
2.2细胞迁移能力划痕24h后,对照组、TGF-β1组、TGF-β1+5 K-115组、TGF-β1+10 K-115组细胞迁移距离百分数分别为22.86%±3.05%、4.39%±3.32%、44.56%±4.87%、58.24±4.15%,差异有统计学意义(F=110.32,P<0.001)。与对照组相比,TGF-β1组细胞迁移能力显著增加(P<0.01);与TGF-β1组相比,TGF-β1+5 K-115组和TGF-β1+10 K-115组细胞迁移能力均降低(P<0.01),见图2。

图2 K-115对TGF-β1诱导的HTFs迁移的影响。
2.3细胞自噬情况透射电子显微镜观察显示,与对照组相比TGF-β1组细胞内自噬小体的数量增加,TGF-β1+5 K-115组、TGF-β1+10 K-115组较TGF-β1组细胞内自噬小体数量进一步增加,自噬激动剂雷帕霉素(阳性对照组)显著促进了TGF-β1诱导的HTFs自噬,而自噬抑制剂3-MA(阴性对照组)则阻断了TGF-β1诱导的HTFs自噬,见图3。

图3 K-115对TGF-β1诱导的HTFs自噬的影响 A:对照组;B:TGF-β1组;C:TGF-β1+5 K-115组;D:TGF-β1+10 K-115组;E:TGF-β1+3-MA组;F:TGF-β1+Rap组。红色箭头示自噬小体。
2.4细胞凋亡情况Hoechst 33342/PI染色结果显示,各处理组几乎均看不到PI阳性细胞,同时未见明显的强蓝色荧光,提示各组细胞凋亡水平无显著差异,见图4。
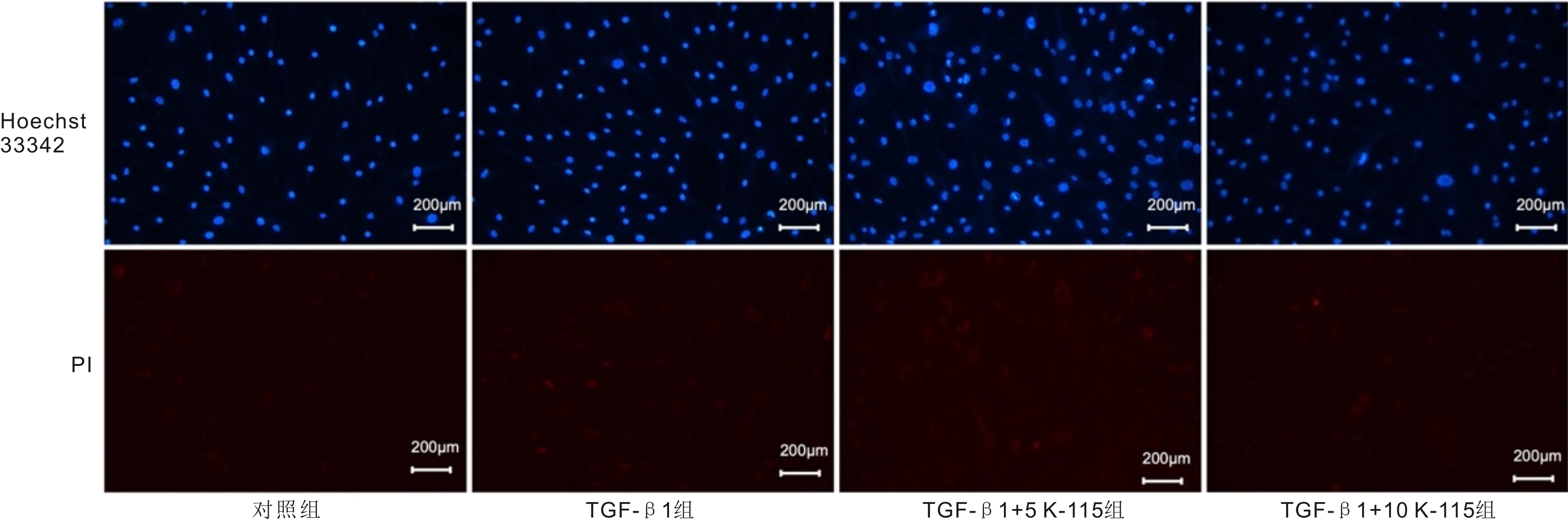
图4 K-115对TGF-β1诱导的HTFs凋亡的影响。
3讨论
K-115作为一种Rho蛋白激酶的抑制剂,主要通过调控细胞骨架拉伸小梁网进而起到调控眼压的作用。体外实验证实K-115可以阻断TGF-β2诱导的人结膜成纤维细胞活化及胶原表达[7]。另有研究证实局部应用Rho蛋白激酶抑制剂AMA0526可以通过抑制胶原组织在滤过通道的沉积提高实验性滤过手术的效果[13]。与本研究发现的K-115可能参与调控滤过道瘢痕形成的结论相似。但是针对涉及Rho蛋白激酶抑制剂这一类药物调控GFS术后瘢痕形成的机制目前还没有定论,有研究证实Rho蛋白激酶抑制剂Y-27632通过调控TGF-β和MAPK通路抑制GFS术后瘢痕形成[14],但是细胞因子系统作用错综复杂,是否有其他机制参与仍需要进一步研究。
GFS术后滤过道瘢痕形成是影响手术成功率的主要原因。以往研究显示,在瘢痕形成进程中HTFs起着重要作用,在多种因素的诱导下,HTFs会被诱导活化,活化后细胞的增殖及迁移能力增强,进而加速伤口愈合,促进滤过道的瘢痕形成[11]。在这些刺激因素中TGF-β是促进局部伤口愈合,诱导HTFs活化的重要因子[12]。本研究应用TGF-β1诱导HTFs活化,建立滤过道瘢痕化的细胞模型,进一步观察K-115对细胞增殖及活化的影响。细胞增殖实验结果提示K-115可以抑制TGF-β1诱导的细胞增殖,同时划痕试验提示K-115可以降低TGF-β1诱导的细胞迁移,提示K-115可能通过抑制细胞增殖、迁移能力进而调控HTFs的活化增殖能力。
本研究发现,TGF-β1组细胞内自噬小体数量较对照组增加,提示在刺激因素TGF-β1的作用下,细胞通过增加自身的自噬能力维持细胞的稳定状态,同时发现K-115处理组细胞内自噬小体数量较TGF-β1组进一步增多,这与抗代谢药物雷帕霉素诱导的HTFs内自噬小体增多的现象一致,提示K-115可以增强细胞的自噬能力。自噬是维持自身稳定性的生物学现象,广泛存在于人体的各个器官。研究证实,细胞的自噬作用在调控器官纤维化的过程中发挥着重要作用,细胞自噬功能缺陷会导致局部胶原大量沉积,促进瘢痕形成,对细胞自噬功能的调控在肝、肺、肾等器官纤维化性疾病的治疗中已经显示出了巨大的潜力[9-11]。自噬在青光眼中的作用也愈来愈受关注,虽然目前的研究多集中在小梁网细胞和神经节细胞[15-18],但也有部分研究显示不同药物可以通过自噬通路调控GFS术后的瘢痕化过程[19-21]。本研究结果提示K-115可以增加TGF-β1刺激而诱导的HTFs自噬,这种自噬功能的增强在维持细胞的稳态及抑制细胞活化方面具有一定的作用,K-115可能参与调控维持HTFs的稳态,进而抑制HTFs的活化增殖及迁移能力。此外,本研究中Hoechst 33342/PI染色实验未显示K-115导致细胞凋亡,这和以往抗代谢药物诱导细胞死亡的抗瘢痕机制不同,为K-115抗瘢痕特性的作用机制提供了参考,但这种抗瘢痕机制还有待进一步在体实验的研究证实。
综上,本研究结果证实K-115具有调控HTFs活化的能力,提示其具有调节GFS相关结膜下瘢痕形成的潜在疗效,有望成为一种新的抗瘢痕药物,由于该药物是一种局部应用的降眼压药物,如果抗瘢痕效果能够得到明确,将成为一种更为简单便捷的抗瘢痕临床治疗策略。
