双金属有机骨架衍生的Fe-CrSe/C负极材料制备及储锂性能
2022-09-16陈修栋简佳琴刘培芳曹小华刘金杭
陈修栋 简佳琴 严 平 刘培芳 曹小华 刘金杭*,
(1九江学院化学化工学院,九江 332005)(2北京化工大学有机无机复合材料国家重点实验室,北京 100029)(3信阳师范学院分析测试中心,信阳 464000)(4江西省生态化工工程技术研究中心,九江 332005)
人类社会经济快速发展,造成了许多环境问题以及燃料供应的枯竭,当前发展清洁能源至关重要[1]。由于水能、风能、太阳能、潮汐能等清洁能源具有间歇性的特征,对储能器件提出了更高的要求[2]。目前许多高效的储能器件已经被开发,诸如锂离子电池、锂金属电池、钠离子电池、锂硫电池和超级电容器等[3]。锂离子电池以其充电速度快、能量密度高、无记忆效应和循环寿命长等优势受到了广泛的关注[4]。但是商业化的石墨负极理论比容量只有372 mAh·g-1且倍率性能较差[5-6],不能满足未来高储能器件的需求,故具有优异电化学性能的负极材料得到了广泛关注。
具有孔隙率高、比表面积高、热稳定性好、密度低和晶体结构有序等优点的金属有机骨架(MOFs)是由金属离子与有机配体通过配位键连接而成的多孔材料[7-8]。然而,MOFs直接作为电极材料时,往往具有低电导率和较差的循环稳定性[9]。MOFs可以被用作牺牲模板来获得各种多孔纳米金属衍生材料及其复合材料(金属氧化物、金属硫化物、金属硒化物),其中金属硒化物具有更高的初始库仑效率和更稳定的循环性能。由于MOFs中的有机配体在惰性气氛中退火碳化,可使得由MOFs衍生的功能材料具有多孔以及空心微粒结构,有利于锂离子的运输。同时,碳化得到的碳框架封装了电化学活性的纳米粒子,提高了电极材料的电子导电性,确保锂离子和电子的快速扩散。因此,合成原位碳包覆金属硒化物作为锂离子电池负极材料将会得到广泛应用。
我们以对苯二甲酸(H2DBC)和三氯化铬(CrCl3)为原料,通过微波法合成Cr-MOF,后续通过加入九水合硝酸铁继续进行微波反应以得到双金属有机骨架材料Fe-Cr-MOF。Fe-Cr-MOF和Cr-MOF分别与硒粉混合在氮气气氛下进行退火合成Fe-CrSe/C和CrSe/C衍生材料,并分别作为锂离子电池负极组装成半电池进行测试。相比之下,Fe-CrSe/C展现出优良的电化学性能(在100 mA·g-1的电流密度下循环150圈还能维持891.6 mAh·g-1的比容量),具有潜在的应用前景。
1 实验部分
1.1 试剂与仪器
H2DBC、CrCl3、九水合硝酸铁、聚偏二氟乙烯(PVDF)、N,N-二甲基甲酰胺(DMF)、1-甲基-2-吡咯烷酮(NMP)、无水乙醇均为分析纯(AR)且均购自国药集团化学试剂有限公司。乙炔黑、锂片、铜箔、电解液、聚丙烯多孔膜(隔膜)均购自苏州乾民化学试剂有限公司。
所用仪器:单模微波反应器,上海屹尧仪器科技发展有限公司;SmartLab型X射线粉末衍射仪(XRD,CuKα辐射,波长λ=0.154 06 nm,管电压为40 kV,管电流为30 mA,扫描范围为5°≤2θ≤85°,扫描速度为 5(°)·min-1),日本理学公司;Hitachi S-4800型场发射扫描电子显微镜(SEM,工作电压1 kV),日本日立公司;Tecnai G2 F20 S-TWIN型多功能场发射透射电子显微镜(TEM,工作电压20 kV),美国FEI公司;激光拉曼光谱测试仪,英国Renishaw公司;ASAP 2460型比表面积和孔径分布测试仪(BET),美国麦克仪器公司;STA449F3 Jupiter型热重(TG)分析仪,德国耐驰公司。
1.2 材料制备
称取0.5 mmol CrCl3和0.5 mmol H2DBC分别溶于5 mL DMF得到A和B溶液,然后将B缓慢加入A中搅拌均匀,在200℃微波反应30 min。随后称取0.5 mmol九水合硝酸铁,直接加入上述反应体系中,接着在150℃下微波反应30 min[8-9]。用DMF、乙醇、水洗涤上述反应生成物,除去其中未反应的离子,然后置于真空干燥箱中干燥得到双金属有机骨架前体材料(Fe-Cr-MOF)。将Fe-Cr-MOF与硒粉按照质量比4∶1混合均匀后放置于瓷舟中,在氮气保护下,500℃退火处理2 h得到复合电极材料(Fe-CrSe/C)。上述操作中不加入九水合硝酸铁且不进行后续微波反应,则最终得到的MOF前体材料为Cr-MOF。Cr-MOF以上述步骤相同的条件进行硒化得到CrSe/C。
1.3 电池的组装
按照6∶2∶2的质量比分别称取活性材料、PVDF、乙炔黑,置于小试管内,加入溶剂NMP,再用匀浆机在35 000 rad·min-1条件下均浆6次(每次1 min),将其混合均匀。将均匀的材料涂在铜箔上,随后放入真空干燥箱内,在60℃条件下烘干12 h制成电极片,其每个极片上活性物质为1.4 mg·cm-2。锂离子半电池的组装是在充满氩气的手套箱中进行,将所制电极片用作工作电极,金属锂片作为对电极,Celgard 2300聚丙烯作为隔膜,1 mol·L-1LiPF6溶液作为电解液,组装成CR2032型纽扣电池。
1.4 电化学性能测试
电化学测试均在室温条件下进行,电池的恒电流充放电测试是通过深圳新威尔测试系统进行,电压范围为0.005~3.0 V。同时,使用上海辰华的CH1760E型电化学工作站对电池进行交流阻抗测试和循环伏安(CV)测试,CV扫描速率为0.1 mV·s-1,其中交流阻抗的测试范围为0.01 Hz~100 kHz。
2 结果与讨论
2.1 材料的结构和形貌分析
图1a和1b分别为Fe-Cr-MOF和Cr-MOF的氮气吸附-脱附等温线及孔径分布图。从图中可知,Fe-Cr-MOF和Cr-MOF材料孔径分布都呈现出介孔结构特征,但Fe-Cr-MOF(1 220 m2·g-1)的比表面积远大于Cr-MOF(48 m2·g-1)。这表明,与Cr-MOF相比,Fe-Cr-MOF为电解液浸润提供了更多的有效面积,同时也为锂离子在电极材料中的运输提供更多通道。图1c为Cr-MOF和Fe-Cr-MOF的TG分析曲线,由图可知,这2种材料质量的损失都随温度升高而增加。Cr-MOF在100℃左右质量开始出现减小,而Fe-Cr-MOF在200℃左右质量才出现减少,二者的质量损失都源于本身的热分解。Cr-MOF的质量损失明显要大于Fe-Cr-MOF的,这表明Fe-Cr-MOF比Cr-MOF的热稳定性更好。
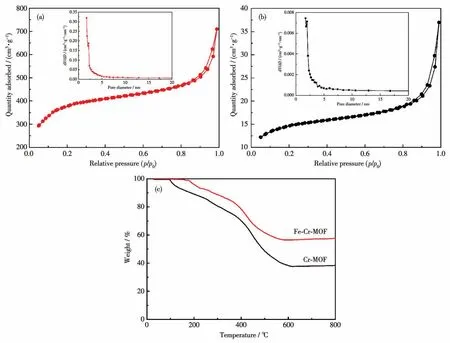
图1 (a)Fe-Cr-MOF和(b)Cr-MOF的氮气吸附-脱附等温线;(c)Cr-MOF和Fe-Cr-MOF的TG曲线Fig.1 Nitrogen adsorption-desorption isotherms of(a)Fe-Cr-MOF and(b)Cr-MOF;(c)TG curves of Cr-MOF and Fe-Cr-MOF
图2a为CrSe/C和Fe-CrSe/C的拉曼谱图,其中,在1 330和1 550 cm-1附近出现了2个特征峰,分别归属于碳的D峰和G峰,二者的相对强度比(ID/IG)表示无定型碳或缺陷碳在复合材料中所占比例。从图中可看出CrSe/C和Fe-CrSe/C的ID/IG值分别为1.02和1.08,因此,Fe-CrSe/C比CrSe/C具有更多的无定形碳。图2b为CrSe/C和Fe-CrSe/C的XRD图,从图中可知,Fe-CrSe/C在2θ=41.8°和54.8°处的峰分别归属为CrSe的(102)和(103)晶面。另外,Fe-CrSe/C在2θ=64.9°处有一个较强的衍射峰,主要归属于FeCr合金的(200)晶面。CrSe/C在2θ=27.6°、60.1°和69.1°处的峰分别主要归属于C峰和CrSe的(201)、(202)晶面。Fe-CrSe/C和CrSe/C的强峰位置不同,主要归因于Fe离子的引入造成了峰位置的变化[10]。
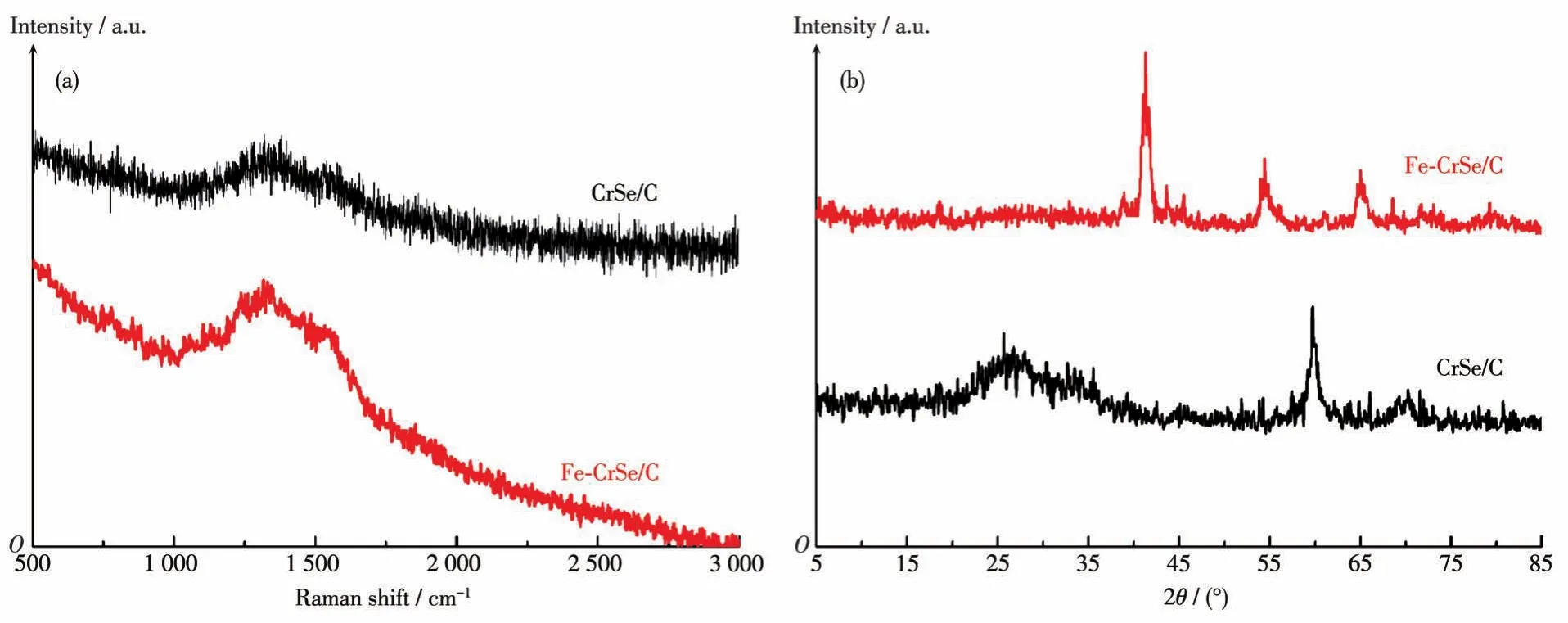
图2 CrSe/C和Fe-CrSe/C的拉曼谱图(a)和XRD图(b)Fig.2 Raman spectra(a)and XRD patterns(b)of CrSe/C and Fe-CrSe/C
图3a和3c分别为CrSe/C的SEM图和TEM图,图3b和3d分别为Fe-CrSe/C的SEM图和TEM图,从图中可观察出CrSe/C和Fe-CrSe/C均形成了纳米颗粒状的形貌。元素映射显示Fe-CrSe/C中的C、Se、Cr和Fe均匀分布,进一步佐证了双金属有机骨架衍生材料的成功合成(图3e~3i)。

图3 (a)CrSe/C和(b)Fe-CrSe/C的SEM图;(c)CrSe/C和(d)Fe-CrSe/C的TEM图;(e~i)Fe-CrSe/C的元素映射Fig.3 SEM images of(a)CrSe/C and(b)Fe-CrSe/C;TEM images of(c)CrSe/C and(d)Fe-CrSe/C;(e-i)Element mappings of Fe-CrSe/C
2.2 电化学性能分析
Fe-CrSe/C的CV曲线如图4a所示,在首圈阴极扫描过程中,Fe-CrSe/C分别在0.8、1.4和2.0 V附近出现了一个较强的还原峰,这些峰主要可以归因于金属锂与Fe-CrSe/C发生反应以及固体电解质界面膜的形成。在阳极扫描过程中,Fe-CrSe/C分别在1.8和2.3 V附近出现了一个强氧化峰,这主要由于脱锂反应。从第2圈循环开始,可以观察到还原峰向1.1 V位置移动,峰重叠性好,这说明Fe-CrSe/C电极具有优良的可逆性。图4b展示了Fe-CrSe/C的前3圈充放电曲线,该曲线与CV曲线相匹配,Fe-CrSe/C首圈初始放电和充电容量分别为1 229.7和958.4 mAh·g-1,首圈库仑效率为77.93%。首圈库仑效率低,主要是首圈循环过程中电极表面的固体电解质界面膜的生成和电解液分解引起的。在100 mA·g-1电流密度下测试了CrSe/C和Fe-CrSe/C的循环性能,如图4c所示。CrSe/C电极在150圈循环后只有254 mAh·g-1的可逆比容量。相比之下,Fe-CrSe/C在150圈循环后仍保持了891.6 mAh·g-1的较高充电容量。另外,还进行了CrSe/C和Fe-CrSe/C首圈循环后的电化学阻抗谱(EIS)测试(图4d),所测谱图由高频区半圆与低频区的直线组成,半圆直径越小,对应的界面电荷转移阻抗越小,更有利于电化学反应。从图中可知,Fe-CrSe/C(144 Ω)相比于CrSe/C(169 Ω)具有更小的电荷转移阻抗,表明Fe-CrSe/C电极具有更好的电导率,进一步解释了Fe-CrSe/C比CrSe/C具有更优异电化学性能。

图4 Fe-CrSe/C的CV曲线(a)和充放电曲线(b);CrSe/C和Fe-CrSe/C的循环曲线图(c)和循环首圈后的EIS谱图(d)Fig.4 CV curves(a)and charge-discharge curves(b)of Fe-CrSe/C;Cycle curves(c)and EIS spectra after the first cycle(d)of CrSe/C and Fe-CrSe/C
如图5a所示,测试了Fe-CrSe/C在不同扫描速率下的CV曲线。在不同扫描速率下的CV曲线形状相似,这说明Fe-CrSe/C电极具有优良的循环可逆性[11]。将lgi相对于lgv作图,其中i和v分别代表电流和扫描速率,则可获得斜率b(图5b)。众所周知,如果b值接近0.5,则扩散贡献在电极反应中起着关键作用,而当b接近1.0时,则是电容贡献主导了反应过程。在2个典型峰的位置,b值分别为0.28和0.36,这表明Fe-CrSe/C在充放电过程中主要是以扩散贡献为主[12-13]。此外,根据相应公式计算电容贡献与扩散贡献[14],如图5c所示。在不同的扫描速率下计算的电容贡献和扩散贡献所占的比例如图5d所示。在0.1 mV·s-1时,扩散贡献占90.94%。将扫描速率提高到 0.2、0.3、0.4和0.5 mV·s-1之后,扩散贡献分别为87.64%、85.28%、83.38%和81.78%。在扫描速率的不断提高下,电容贡献逐渐上升,这是因为锂离子在低扫描速率下相对更容易扩散,但是在较高的扫描速率时扩散则会被抑制。同时,Fe-CrSe/C在高扫描速率下的较高电容贡献清楚地展示出其独特的纳米微粒结构为锂离子提供了丰富的活性位点,从而提高了循环的稳定性。

图5 (a)Fe-CrSe/C在不同扫描速率下的CV曲线图;(b)lg i vs lg v图;(c)v1/2vs i/v1/2图;(d)在不同扫描速率下电容贡献和扩散贡献所占的比例Fig.5 (a)CV curves of Fe-CrSe/C at different scan rates;(b)lg i vs lg v plots;(c)v1/2vs i/v1/2plot;(d)Proportion of capacitance contribution and diffusion contribution at different sweep rates
在首圈充放电过程中在不同电压条件下进行了Fe-CrSe/C的原位EIS测试。如图6所示,电荷转移阻抗在整个过程中逐渐降低,这表明了电极Fe-CrSe/C的活化和高可逆性,进一步证明了Fe-CrSe/C具有较好的电化学性能。

图6 在不同充放电电压下Fe-CrSe/C的原位EIS谱图Fig.6 In situ EIS spectra of Fe-CrSe/C at different charge and discharge voltages
3 结 论
通过微波法合成了2种新型MOF衍生材料CrSe/C和Fe-CrSe/C,将其作为锂离子电池负极材料,组装成半电池进行电化学性能测试。结果表明,双金属有机骨架衍生的硒化物(Fe-CrSe/C)具有较好的电化学性能。在电流密度100 mA·g-1下,Fe-CrSe/C材料在循环150圈后比容量还能保持891.6 mAh·g-1。Fe-CrSe/C电极材料的研究为将来开发高性能的铬基MOF衍生电极材料提供了理论基础。
