近红外光热转换剂氧缺陷二氧化钼的制备及其在光热治疗中的应用
2022-09-16王曾学张训迪阳一鸣鹏张秀云郑婷婷
王曾学 刘 艳 赵 盼 张训迪 阳一鸣 孙 鹏张秀云 冯 玉 郑婷婷*, 陈 辰 李 伟*,
(1山东中医药大学药学院,济南 250355)(2山东中医药大学中医药创新研究院,济南 250355)(3山东中医药大学针灸推拿学院中医药新材料研究院,济南 250355)
0 引 言
肿瘤的临床治疗一直是生物医学研究领域的重点和难点,手术、放疗和化疗是目前临床应用的主要手段,然而这些传统的治疗方法在杀伤肿瘤组织的同时,对机体的免疫系统有较大的破坏。光热治疗(PTT)利用对人体组织有较强穿透力的近红外光,引发局部高热破坏肿瘤细胞,达到治疗肿瘤的目的,具有高效、微创和毒副作用小的优点。目前研究最广泛的近红外光热转换剂包括贵金属纳米材料[1-4]、黑磷[5-7]、碳基纳米材料[8-10]、有机化合物[11]以及半导体纳米材料[12-16]。过渡金属氧化物是半导体光敏剂中的一类代表,由于其具有原料丰富、制备简单、结构可调、性能稳定的优势,因此成为研究的热点[17-20]。但大部分过渡金属氧化物光敏剂对光的响应主要集中在可见光区,在生物应用上,穿透能力差,达到病变部位的光子有限,为实现PTT对深层组织肿瘤的治疗,减小对健康组织的伤害,开发具有近红外响应的过渡金属氧化物光敏剂具有深远意义。
过渡金属氧化物二氧化钼(MoO2)是一种在能带结构和电子传导方面具有金属性的化合物[21-22],其晶体结构属于单斜晶系,具有畸变的金红石型结构[23]。在MoO2晶体中,氧原子紧密堆积成八面体,Mo原子占据八面体的空隙,但是偏离中心位置,所以导带中Mo的电子离开原位,表面具有较高的自由电子密度,这使得MoO2具有金属性,从而表现出一定的局域表面等离子体共振效应(LSPR)[24-25],使其在近红外区具有光吸收能力。刘庄等[26-27]在油胺辅助下合成了MoOx超薄纳米片,但其稳定性较差,生理条件下易被氧化,而且纳米材料的油相表面不利于其生物学应用。目前报道的MoO2由于氧空位浓度较低,普遍存在光热转换率低、易氧化、稳定性差等问题[28-32]。
聚乙烯吡咯烷酮(PVP)作为一种非离子型高分子化合物,具有优良的生物相容性,可以吸附在纳米颗粒表面,阻止纳米颗粒继续长大,同时具有一定的还原性,可作为形成MoO2纳米颗粒的结构导向剂和还原剂。采用一步水热法合成MoO2纳米材料,借助PVP的还原作用获得具有丰富氧缺陷的MoO2纳米材料,借助其LSPR效应,实现高效的光热转化性能,并考察纳米材料的细胞毒性和细胞光热杀伤性能。
1 实验部分
1.1 实验原料
PVP购自百灵威试剂公司;五氯化钼(MoCl5)购自上海阿拉丁生化科技股份有限公司;青霉素-链霉素、磷酸盐缓冲液(1X PBS)、台盼蓝染液购自兰杰柯科技有限公司;胰酶购自赛国生物科技有限公司;DMEM基础培养基、胎牛血清(FBS)购自赛默飞世尔科技有限公司;Enhanced Cell Counting Kit-8(CCK-8)购自北京博奥森生物技术有限公司;二甲基亚砜(DMSO)购自北京索莱宝科技有限公司;人肝癌细胞CL-0103(Hep G2细胞)购自武汉普诺赛生命科技有限公司;人正常肝细胞(L02细胞)购自北纳生物科技有限公司。
1.2 氧缺陷MoO2(VO-MoO2)的制备
称取0.94 g PVP加入4 mL去离子水溶解,磁力搅拌30 min获得溶液A;称取0.273 g MoCl5,加入6.5 mL去离子水溶解,磁力搅拌30 min获得溶液B。将溶液A和溶液B混合,磁力搅拌30 min。取适量体积的混合溶液加入含聚四氟乙烯内衬的25 mL高压反应釜中,填充度约为50%,置于200℃烘箱中反应 12 h,冷却后取出,20 000 r·min-1离心 10 min,去掉上清液,加去离子水洗涤3次,冷冻干燥,得到VO-MoO2粉末。
1.3 材料表征
采用透射电镜(TEM,JEM-100CⅫ)观察样品的形貌和粒度大小,加速电压为80 kV,采用能谱(EDS)表征材料的元素组成。采用高分辨透射电镜(HRTEM,Philips Tecnai 20U-TWIN)观察样品的微观结构和晶体取向,加速电压为200 kV。采用X射线粉末衍射仪(XRD,Rigaku D/Max 2200PC)表征样品的物相结构,测试条件:CuKα辐射(λ=0.154 2 nm),石墨单色器,管电压40 kV,管电流20 mA,扫描速度10(°)·min-1,扫描范围 10°~80°。采用激光粒度仪(Brookhaven,ZetaPALS Instruments)测试样品的粒度分布。采用X射线光电子能谱仪(XPS,Perkin Elmer,PHI-5300 ESCA spectrometer)分析样品的表面原子状态,AlKα作为激发源,电子结合能用C1s峰284.6 eV进行校正。采用电子顺磁共振波谱(EPR,Bruker A 300)考察样品的氧缺陷情况。
1.4 近红外光吸收能力测定
将VO-MoO2粉末加入去离子水中分别配制浓度为 0、25、50、100、150 μg·mL-1的 VO-MoO2纳米颗粒胶体溶液,用紫外可见近红外分光光度计(Hitachi,UH4150)对样品进行吸收光谱扫描,并考察VO-MoO2最大吸光度与浓度的关系。
1.5 光热性能测定
将VO-MoO2粉末加入去离子水中分别配制成0、10、25、50、100、150 μg·mL-1的纳米颗粒胶体溶液,取1 mL纳米胶体溶液置于石英比色皿中,利用近红外激光器(VCL-808nmM1-7W)对纳米胶体溶液进行照射,激光器波长808 nm,功率为1 W,每20 s记录胶体溶液的温度,持续测量600 s,且每隔1 min用热成像相机拍照,用不同浓度下的纳米胶体溶液升温曲线评价材料的光热转换性能。
另取 1 mL 100 μg·mL-1的 VO-MoO2纳米胶体溶液于石英比色皿中,用近红外激光器对纳米胶体溶液进行照射,改变激光器照射功率(0、0.1、0.2、0.4、0.8、1.0 W),每20 s记录胶体溶液的温度,持续测量600 s,考察不同功率下纳米胶体溶液的光热转换性能。
在功率为1 W的808 nm激光照射下记录100 μg·mL-1的VO-MoO2纳米胶体溶液在600 s内的升温情况。关闭激光器,VO-MoO2纳米胶体溶液自然冷却,记录600 s内的温度变化,根据文献方法[33]计算VO-MoO2纳米材料的光热转换效率:
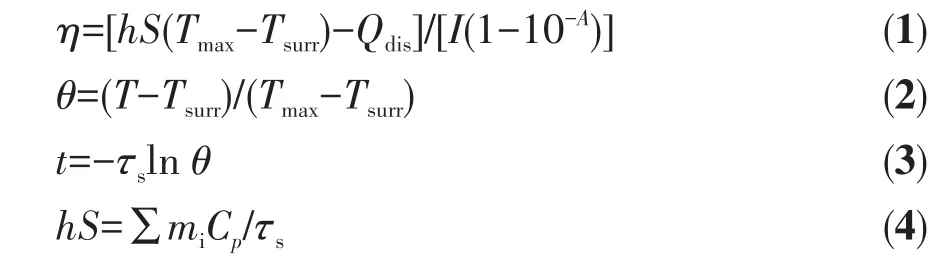
式中η为光热转换效率,h为传热系数,S为石英管的表面积,Tmax为平衡温度,Tsurr为环境温度,Qdis为石英比色皿的热量散失,I为照射激光功率,A为VO-MoO2纳米颗粒悬浮液在808 nm处的吸光度,t为液体冷却阶段时间,mi为VO-MoO2纳米颗粒悬浮液的质量,Cp为水的比热容,τs为样品系统时间常数,θ为无量纲温度驱动力。
1.6 稳定性测试
通过升降温循环测试考察VO-MoO2的光热稳定性,通过XRD、TEM、EDS、UV-Vis-NIS测试VO-MoO2升降温循环前后材料的组成、结构及光吸收能力,进一步证明材料的稳定性。取1 mL 100 μg·mL-1的VO-MoO2纳米胶体溶液于石英比色皿中,用808 nm激光器照射,功率为1 W,每隔20 s记录温度,持续记录温度600 s,停止照射,自然降温,继续记录温度600 s,以上为一个循环,重复上述循环10次以考察材料的光热稳定性。
1.7 细胞毒性测试
以含体积分数2%FBS的DMEM为培养基,将肝癌细胞Hep G2和正常肝细胞L02分别接种至96孔板中,每孔接种1×104个细胞,放入37℃恒温箱中培养24 h,加入用培养基稀释的VO-MoO2,浓度梯度为 0、50、100、200、300、400、500 μg·mL-1,每组5个平行对照孔,继续培养12 h后,PBS洗涤,分别加入100 μL体积分数10%的CCK-8的培养基,恒温箱中继续培养2 h,使用酶标仪在450 nm波长处检测吸光度并按照式5进行细胞存活率(R)计算:

其中 ODs、ODc、ODb分别为实验组、对照组和空白组在450 nm处的光密度。
1.8 癌细胞光热杀伤效果测试
通过近红外光照射后的细胞存活率分别考察VO-MoO2对癌细胞和正常细胞的体外光热杀伤效果。以含体积分数2%FBS的DMEM为培养基,将肝癌细胞Hep G2接种至96孔板中,每孔接种1×104个细胞,放入37℃恒温箱中培养24 h,实验组加入用培养基稀释的 VO-MoO2,浓度为 100 μg·mL-1,继续培养 12 h,取出 96孔板,将与1 mL 100 μg·mL-1VO-MoO2共孵育12 h的Hep G2细胞置于功率为1 W的808 nm激光下照射2 min,对照组为含1 mL 100 μg·mL-1VO-MoO2+无激光照射,空白组为不含VO-MoO2+无激光照射及不含VO-MoO2+激光照射,激光照射功率同实验组,操作结束后将细胞置于恒温培养箱中继续培养12 h。因VO-MoO2纳米材料本身在450 nm处有一定的吸光度,会对酶标仪450 nm处吸光度造成干扰,因此,采用台盼蓝染色法考察近红外光对癌细胞的光热杀伤效果。加入台盼蓝,显微镜下观察细胞颜色,并使用细胞计数板精确计数,分别计算实验组和对照组的细胞存活率。
VO-MoO2对正常肝细胞L02的体外光热杀伤效果实验方法同上述肝癌细胞Hep G2。
2 结果与讨论
2.1 材料的形貌与结构表征
TEM照片显示水热制备的VO-MoO2为类球形颗粒,粒度约18 nm,分散性良好,如图1a所示。图1b中的HRTEM照片显示了清晰的晶格条纹,结合XRD图分析可知其分别对应金红石型MoO2的(101)和(1ˉ11)晶面,插图中单个颗粒的衍射斑点清晰可见,说明其为单晶结构。图1c的XRD图与标准卡片PDF No.32-0671特征峰一致,表明VO-MoO2为单斜晶系金红石型结构。与商用MoO2相比,VO-MoO2的衍射峰明显宽化,说明其为纳米级颗粒。从图1d的粒径分布可以看出,VO-MoO2纳米颗粒的粒径分布较窄,平均粒径约为108 nm,由于VO-MoO2纳米颗粒表面包裹PVP且采用动态光散射测出的纳米颗粒粒径为水合半径,使得激光粒度仪检测出的粒径比TEM图像中的纳米颗粒大(由于加速电压的破坏作用以及衬度较小,包覆在纳米颗粒上的PVP在TEM图中基本不显示),平均ζ电位约为21 mV,表明溶胶状态较稳定。实验中发现多次洗涤VO-MoO2纳米颗粒时,纳米颗粒会出现明显的团聚现象,对应的动态光散射平均水合粒径及胶体溶液光学照片如图2所示。由图可知,离心、洗涤次数超过3次会显著降低胶体溶液的稳定性,使VO-MoO2颗粒聚集,说明PVP的包覆在一定程度上有利于VO-MoO2胶体溶液的稳定。
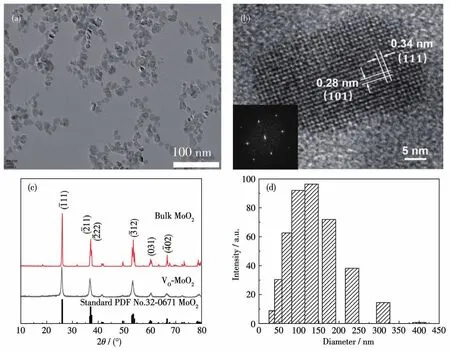
图1 VO-MoO2的(a)TEM图、(b)HRTEM图(插图:由HRTEM照片得到的傅里叶变换图)、(c)XRD图和(d)水合粒径分布图Fig.1 (a)TEM image,(b)HRTEM image(Inset:Fourier transform images obtained from HRTEM),(c)XRD pattern,and(d)hydration particle size distribution pattern of VO-MoO2

图2 (a)VO-MoO2多次洗涤后的平均粒径和(b)胶体溶液光学照片Fig.2 (a)Average particle sizes and(b)optical photographs of solutions of VO-MoO2after multiple washing times
为了证明合成的VO-MoO2含有丰富的氧缺陷,对样品进行了XPS、Raman谱图以及EPR表征,并与商用MoO2进行比较。O1sXPS谱图中结合能位于529.2和530.5 eV处的峰分别归属于晶格氧和缺陷氧[34],分峰后发现VO-MoO2中有更大比例的缺陷氧(图3a),而商用MoO2中以晶格氧为主(图3b)。VO-MoO2的Raman谱图(图3c)中出现了明显的拉曼振动峰,谱图中 VO-MoO2位于 228、276、329和 367 cm-1处的振动峰分别代表O2—Mo—O2、O1=Mo=O1、O3—Mo—O3和 O2=Mo=O2的弯曲振动,位于656、811和986 cm-1处的振动峰分别对应Mo—O2—Mo、Mo—O3—Mo和 Mo=O1的伸缩振动(On表示MoO2晶格中某个位置的氧),这表明氧缺陷的存在[35],而商用MoO2没有明显的拉曼振动峰。在EPR光谱中,商用MoO2和MoO3几乎没有EPR振动峰(图3d),而VO-MoO2中强烈的EPR振动峰也证实了大量氧缺陷的存在[25]。推测其反应原理为通过PVP的还原作用和反应釜的高温高压作用析出MoO2晶粒,借助MoCl5水溶液的酸性条件,H+在反应釜高温高压环境中刻蚀MoO2纳米颗粒,获得表面富氧缺陷MoO2纳米材料,经近红外光照射,入射的近红外光能在纳米材料表面与氧缺陷引起的高效传输的自由电子震荡波发生共振,同时氧缺陷能够加速MoO2光生电子和空穴的分离,使其具有高效电荷转移速率,显示出增强的LSPR效应,表现出对近红外光的强吸收[36]。

图3 (a)VO-MoO2和(b)商用MoO2的XPS谱图;(c)VO-MoO2和商用MoO2的Raman谱图;(d)VO-MoO2、商用MoO2和商用MoO3的EPR谱图Fig.3 XPS spectra of(a)VO-MoO2and(b)commercial MoO2;(c)Raman spectra of VO-MoO2and commercial MoO2;(d)EPR spectra of VO-MoO2,commercial MoO2,and commercial MoO3
2.2 近红外光吸收能力
材料的近红外吸收能力直接影响其光热转换效率,对合成的VO-MoO2进行UV-Vis-NIR吸收光谱测试,如图4a所示,VO-MoO2在400~1 100 nm范围内有一巨大的吸收峰,表明材料在可见光至近红外光区都具有优良的吸光性能,吸收峰峰值位于770 nm,这一峰值属于近红外Ⅰ区,随浓度的增加,VO-MoO2的可见光和近红外光吸收能力也依次增加,且最大吸收波长处的吸光度与浓度线性关系良好(图4b)。VO-MoO2的近红外吸收性能使其在作为PTT的光敏剂方面展示出巨大潜力。

图4 (a)不同浓度VO-MoO2的UV-Vis-NIR谱图;(b)在770 nm处VO-MoO2浓度与吸光度的线性关系Fig.4 (a)UV-Vis-NIR spectra of different concentrations of VO-MoO2;(b)Linear relationship between the concentration of VO-MoO2and the absorbance at 770 nm
2.3 光热转换性能
将VO-MoO2在808 nm激光器下照射10 min,以去离子水为对照,每20 s记录温度。图5a显示了不同浓度的VO-MoO2的升温曲线,随浓度增大,VO-MoO2升温能力逐渐增强,150 μg·mL-1VO-MoO2经照射10 min后温度升高至57.3℃,升温达35.8℃,而去离子水经照射10 min后,温度变化不明显。改变激光的辐照功率,100 μg·mL-1VO-MoO2溶液最高温度随功率增大而升高,功率为1 W时,经10 min照射温度,升高至57.5℃,约升温31.5℃(图5b)。一般的PTT,温度升高至50℃以上便可产生较好的疗效,因此选用100 μg·mL-1的 VO-MoO2胶体溶液在808 nm激光下照射10 min进行光热转换效率计算。图5c为一个升降温循环过程,由式2拟合得到t--lnθ关系图(图5d),由线性关系得τs=235.3 s,根据式1、4计算可知VO-MoO2溶液的η达67.9%。

图5 (a)不同浓度VO-MoO2的升温曲线(激光功率1.0 W);(b)不同辐照功率下VO-MoO2的升温曲线(浓度100 μg·mL-1);(c)VO-MoO2的升降温曲线(浓度100 μg·mL-1,激光功率 1.0 W);(d)t--ln θ拟合曲线Fig.5 (a)Temperature rise curves of different concentrations of VO-MoO2(laser power of 1.0 W);(b)Temperature rise curves of VO-MoO2at different irradiation powers(concentration of 100 μg·mL-1);(c)Temperature rise and fall curves of VO-MoO2(laser power of 1.0 W and concentration 100 μg·mL-1);(d)t--ln θ fitted curve
在808 nm激光照射下VO-MoO2胶体溶液会产生大量的热量。图6为不同浓度的VO-MoO2在808 nm激光照射下的升温情况,去离子水照射10 min后温度从20.0℃上升到24.8℃,升温幅度仅有4.8℃,而相同体积的 100 μg·mL-1VO-MoO2胶体溶液从20.0℃上升到了69.6℃,升温幅度高达49.6℃,由此可证明VO-MoO2是一种优良高效的光热转化材料。

图6 近红外光照(1 W)下不同浓度VO-MoO2的热成像图Fig.6 Thermal images of VO-MoO2with different concentrations under near-infrared illumination(1 W)
2.4 光热稳定性
为研究材料的稳定性,将100 μg·mL-1VO-MoO2在808 nm 1.0 W激光功率下照射10 min,自然冷却至室温,重复10个循环,如图7a所示,VO-MoO2纳米材料每个循环照射可达到的最高温度几乎一样,每个循环升温情况无差异,表明VO-MoO2具有优异的光热性能,其光热性能不会随着光照次数的增多而发生变化。每个升降温循环后的UV-Vis-NIR谱图如图7b所示,材料的光吸收能力几乎无变化,而随循环次数增加最大波长处吸光度轻微增加,这可能是溶液照射过程中升温导致的微量蒸发所致。

图7 (a)VO-MoO2胶体溶液循环照射升降温曲线;(b)VO-MoO2胶体溶液循环照射不同次数的UV-Vis-NIR谱图Fig.7 (a)Temperature rise and fall curve of VO-MoO2colloidal solution under cyclic irradiation;(b)UV-Vis-NIR spectra of VO-MoO2colloidal solution after the different times of cyclic irradiation
经过10个升降温循环测试后,材料的粒径、组成及结构变化见图8。从TEM照片(图8a、8b)及水合粒径变化图(图8f)中看出循环前后材料的形貌及颗粒大小基本无变化。EDS谱图(图8c、8d)显示了循环前后材料基本组成都是Mo和O两种元素(图中C和Cu来自制样用的碳膜和铜网)。XRD图重现性良好(图8e),都为单斜相二氧化钼。循环前后的材料组成和结构表征进一步证明VO-MoO2纳米材料具有优良的稳定性。

图8 VO-MoO2循环照射(a)前和(b)后的TEM图;VO-MoO2循环照射(c)前和(d)后的EDS谱图;(e)VO-MoO2循环照射前后的XRD图;(f)VO-MoO2循环照射不同次数水合粒径变化Fig.8 TEM images of VO-MoO2(a)before and(b)after cyclic illumination;EDS spectra of VO-MoO2(c)before and(c)after cyclic illumination;(e)XRD patterns of VO-MoO2before and after cyclic illumination;(f)Hydration particle sizes of VO-MoO2after the different times of cyclic irradiation
2.5 CCK-8细胞毒性
将人源高转移性肝癌细胞Hep G2和正常人体肝细胞L02用于VO-MoO2的细胞毒性评估。采用CCK-8法检测0~500 μg·mL-1浓度范围内的VO-MoO2对Hep G2细胞和L02细胞的毒性,将Hep G2细胞和L02细胞分别与不同浓度VO-MoO2纳米材料共孵育24 h,加入CCK-8试剂,采用酶标仪测定吸光度,根据式5计算细胞存活率。如图9所示,在0~300 μg·mL-1的低剂量组中Hep G2细胞和L02细胞存活率无下降,反而表现出一定程度的增殖,这可能是由于VO-MoO2表面残留的少量PVP具有较好的生物相容性,陈等[37]也报道了聚乳酸经过PVP修饰后,更具有细胞亲和性,在细胞孵育过程中PVP对细胞具有一定的保护作用和促增殖作用。当VO-MoO2浓度增大到400 μg·mL-1时,Hep G2细胞存活率降低至69.2%,L02细胞存活率降低至56.5%;VO-MoO2对L02细胞的影响趋势与对Hep G2细胞的影响基本一致,在300 μg·mL-1之前对细胞无损伤,但在更高的浓度下,细胞的存活率显著降低。根据光热转换性能测试结果可知,当VO-MoO2浓度达到100 μg·mL-1时,足以达到较好的疗效,且在此治疗剂量下,VO-MoO2对2种细胞无毒性,表面包覆的少量PVP对细胞具有一定的保护和促增殖作用。

图9 Hep G2细胞和L02细胞与不同浓度VO-MoO2孵育后的细胞存活率Fig.9 Cell survival rates of Hep G2 cells and L02 cells incubated with different concentrations of VO-MoO2
2.6 细胞内的光热杀伤性能
分别考察了VO-MoO2对肝癌细胞Hep G2和正常肝细胞L02的光热杀伤性能。经台盼蓝染色后,正常活细胞的细胞膜结构完整,台盼蓝不能进入细胞内,而丧失活性的细胞的细胞膜不完整,通透性增加,可被台盼蓝染成蓝色。100 μg·mL-1VO-MoO2与肝癌细胞Hep G2共孵育后经台盼蓝染色,空白组(图10a)和对照组(图10b、10c)均为细胞膜完整、活力正常的细胞,而实验组(图10d)细胞均被染成蓝色。经细胞计数板计数,空白组和对照组细胞存活率均在 99% 以上,而与 100 μg·mL-1VO-MoO2共孵育的Hep G2细胞经808 nm激光照射2 min后细胞存活率为0。

图10 Hep G2细胞(a)正常培养后台盼蓝染色图和(b)经808 nm激光照射后台盼蓝染色图;(c)Hep G2细胞与VO-MoO2共孵育后台盼蓝染色图;(d)Hep G2细胞与VO-MoO2共孵育经808 nm激光照射后台盼蓝染色图Fig.10 Trypan blue staining photographs(a)in normal culture background and(b)irradiated by 808 nm laser of Hep G2 cells;(c)Trypan blue staining of co-incubation of Hep G2 cells with VO-MoO2;(d)Trypan blue staining of Hep G2 cells co-incubated with VO-MoO2under 808 nm laser irradiation
同等条件下的L02细胞经台盼蓝染色,空白组(图11a)、对照组(图11b、10c)及实验组(图11d)除极个别细胞为蓝色外,绝大多数细胞为未染色的活力正常细胞,经细胞计数板计数,无激光照射的空白组和对照组细胞存活率为99%,激光照射空白组细胞存活率为97%,实验组细胞存活率为96%。

图11 L02细胞(a)正常培养后和(b)经808 nm激光照射后台盼蓝染色图;(c)L02细胞与VO-MoO2共孵育后台盼蓝染色图;(d)L02细胞与VO-MoO2共孵育经808 nm激光照射后台盼蓝染色图Fig.11 Trypan blue staining photographs(a)in normal culture background and(b)irradiated by 808 nm laser of L02 cells;(c)Trypan blue staining of co-incubation of L02 cells with VO-MoO2;(d)Trypan blue staining of L02 cells co-incubated with VO-MoO2under 808 nm laser irradiation
以上结果表明用VO-MoO2作为光敏剂进行PTT对正常组织细胞基本没有损伤,但对癌细胞具有显著的光热杀伤性能,可能是由于VO-MoO2纳米颗粒外层包覆的PVP增强了VO-MoO2在肿瘤细胞中的通透性和滞留作用,使VO-MoO2在肿瘤细胞内蓄积[38-39],经近红外光照射后对癌细胞具有显著的光热杀伤性能,将其作为PTT光敏剂具有广阔的前景和发展潜力。
为全面评估VO-MoO2纳米材料的光热转换和光热杀伤性能,总结了文献报道的部分光热转化剂的性能参数,见表1。VO-MoO2纳米材料光热转换效率达 67.9%,100 μg·mL-1VO-MoO2与癌细胞共孵育后经808 nm激光照射2 min后,癌细胞杀伤率为100%,显著优于文献报道的光敏剂的性能参数。

表1 光敏剂性能参数比较 Table 1 Comparison of performance parameters of photosensitizers

续表1
3 结 论
通过水热法在还原条件下制备的VO-MoO2因具有大量氧缺陷,表现出极佳的LSPR特性,从而具有优异的近红外光学吸收性质。100 μg·mL-1VO-MoO2在808 nm激光照射下,短时间内升温达到31.5℃,光热转化效率高达67.9%,材料具有良好的光热稳定性,经10次循环照射,近红外吸收能力、组成及结构均未发生变化,有利于多次治疗;因PVP的包覆作用,低剂量的VO-MoO2对细胞没有毒性,反而具有一定的细胞增殖作用,因此该光热制剂具有优异的生物相容性。低剂量的VO-MoO2经808 nm近红外光照射对癌细胞具有显著的光热杀伤性能,该VO-MoO2作为PTT的光敏剂具有广阔的前景和发展潜力。
