施氮对苜蓿初花期光合日变化、叶片形态及干物质产量的影响
2022-09-16孙延亮赵俊威刘选帅李生仪马春晖王旭哲张前兵
孙延亮,赵俊威,刘选帅,李生仪,马春晖,王旭哲,张前兵
(石河子大学动物科技学院,新疆 石河子 832003)
氮素是植物生长发育所必需的营养元素,植物生长所需要的主要矿物质元素中,氮素占40%以上,且氮素是植物体内核酸、氨基酸和蛋白质等大分子有机氮化合物的重要组成元素,也是植物叶绿素、植物激素、光合酶及维生素的主要成分,因此氮在植物生命活动中具有首要地位,被称为“生命元素”[1-2]。目前为止,地球上可自由获得的氮主要来源于大气中的N2,但是大部分植物依赖其可利用的氮形式(主要为铵盐和硝酸盐)来生长,而这些氮基质的可利用性则依赖于不同的氮转化反应,包括豆科植物的根瘤菌固氮作用,微生物的硝化作用、氨化作用和同化作用。此外,土壤有机物的分解和植物根系分泌物也是氮素输入的重要部分[3-4]。研究表明,不施氮肥土壤可利用氮的生成不能满足植物的吸收利用,会造成土壤氮的亏缺,而氮肥的过量施用,则会严重扰乱土壤原有的氮素循环,影响土壤生产力,并导致严重的环境污染[5]。紫花苜蓿(Medicago sativa)是我国大规模种植的优质牧草植物,因其具有干物质产量高、营养品质好、适应性强等特点,被誉为“牧草之王”[6]。新疆农田土壤普遍缺氮,苜蓿与根瘤菌的共生固氮量又不能满足植株生长需求,因此外源氮的添加对提高苜蓿干物质产量和产业可持续发展具有不可替代的重要作用[7]。
植物的光合作用是干物质积累和产量形成的基础,较高的光合面积和光合速率是获得高产的基础[8]。叶片是植物进行光合作用的主要场所,其结构和功能与植物光合作用密切相关[9]。研究表明,不同氮素用量对植物叶片形态、光合速率及群体质量影响显著,施氮可以促进叶面积的增大,进而增加光的捕获面积[10];在低氮条件下,群体叶面积相对适宜,植物叶片倾角较小,且基角和开张角表现为下层叶>中层叶>上层叶,因此植物能够获得更多的光照进行光合作用,最后群体光合生物量积累较高,在高氮条件下,上层叶片叶面积更大且叶片倾角增加,对中下层叶片造成明显的遮荫现象,导致中下层叶片光合速率的下降,进而导致群体质量的降低[11]。苜蓿干物质产量还远未达到其生物学极限,光合作用是构成植物生物量的最主要因素,营养元素的不足被认为是植物光合和生长的潜在限制因素[12]。研究发现,适量的氮添加可以缓解苜蓿生长的氮限制,促进苜蓿叶片的光合作用,但随着氮肥施用量的增加,氮素添加的正向效应发生了转移,由于氮的施用量超过了苜蓿生长发育的需要,苜蓿的生长促进作用不会进一步增加,甚至会抑制苜蓿的生长[13]。此外,当土壤水分不足时,施氮量的增加有助于脱落酸(abscisic acid,ABA)的降低,从而促进植物叶片气孔导度和光合速率的增加[14]。
目前,关于紫花苜蓿光合特性的研究主要集中在品种间的比较以及水分胁迫、高温胁迫、CO2浓度等环境因子方面,而关于紫花苜蓿叶片形态结构特征与光合日变化关系以及对外界环境的适应性方面的研究较少,尤其是施氮对滴灌苜蓿叶片形态、光合日变化及干物质产量的影响机制鲜见报道。因此,本研究设置了4个施氮水平,对紫花苜蓿光合日变化、叶片形态结构变化及产量构成等指标进行测定,探讨不同施氮水平下紫花苜蓿叶片结构和光合特性的变化规律,分析叶片氮含量、叶片形态、光合日变化与干物质产量之间的关系,以期进一步明确施氮对紫花苜蓿干草产量形成的影响机制,进而为优化实际生产中紫花苜蓿的氮管理策略提供理论依据和技术参考。
1 材料与方法
1.1 试验地概况
试验地位于新疆石河子市石河子大学牧草实验站(44°20′N,86°30′E,海拔420 m),地处天山北麓中段,准噶尔盆地南缘,属于温带大陆性干旱气候。全年降水稀少,气候干燥,冬季长而严寒,夏季短而炎热,试验区以灰漠土为主。土壤耕层(0~20 cm)含有机质21.56 g·kg-1,全氮1.18 g·kg-1,全磷0.53 g·kg-1,速效钾119.8 mg·kg-1。
1.2 试验设计
试验采用单因素随机区组设计,设置4个施氮水平,分别为施氮肥:0(CK)、60(N1)、120(N2)和180 kg·hm-2(N3),重复3次,共12个小区。试验所用氮肥为尿素(含N 46%),通过滴灌系统采用“氮随水走”的高效节水节肥方式,在苜蓿返青后分枝期及前3茬刈割后3~5 d随水滴施。
供试紫花苜蓿品种为高产、抗盐碱、耐低温的WL366HQ,于2019年进行人工条播,播种量为18 kg·hm-2,播种行距为20 cm,播种深度为2 cm,播前进行土地深翻,为苜蓿根系的深入提供良好环境,播后及时进行镇压,有利于种子和土壤的紧密结合以及土壤表层的保墒。滴灌带浅埋至地表下10 cm,间距为60 cm,所用滴灌带为内镶片式滴灌带,其滴头间距为20 cm。各小区面积均为24 m2(4 m×6 m),小区四周设置1 m的保护行,防止小区间养分、水分的渗透,田间管理措施除施肥外,其他灌溉、中耕除草、病虫害防治等管理均按照当地高产苜蓿田统一进行。
1.3 测定指标与方法
1.3.1 光合特性测定 于紫花苜蓿第二茬初花期期间(2020年6月26日,苜蓿开花5%~10%),采用Li-6400便携式光合作用测定系统,在晴朗无云的天气进行田间活体测定,随机选择生长良好的苜蓿植株,测定其倒数第3片完全展开的健康完整叶片,测定时间为10:00-20:00,每隔2 h测定1次,每个小区随机选取6个叶片测定,测定 指 标 包 括 净 光 合 速 率(net photosynthetic rate,Pn,μmol CO2·m-2·s-1)、胞 间CO2浓 度(intercellular CO2concentration,Ci,μmol·mol-1)、气孔导度(stomatal conductance,Gs,cm·s-1)、蒸腾速率(transpiration rate,Tr,mmol H2O·m-2·s-1)等生理因子,并记录光合有效辐射(photosynthetically active radiation,PAR,μmol·m-2·s-1)、田间CO2浓 度(field CO2concentration,Ca,μmol·mol-1)、空 气 相 对 湿 度(relative air humidity,RH,%)、气 温(atmospheric temperature,Ta,℃)、叶表饱和蒸汽压(leaf surface saturated vapor pressure,Vpdl,Kpa)等环境因子。苜蓿叶片的气孔限制值(stomatal limitation value,Ls)和瞬时水分利用效率(water use efficiency,WUE)分别采用以下公式计算:

1.3.2 叶片性状 每个小区采集12个叶片(倒数第3片完全展开的健康完整叶片)带回实验室,使用扫描仪(EpsonScan V700,日本)获取叶片的图像,采用Image Pro Plus软件对叶长、叶宽和叶面积(leaf area,LA)进行测量;每个小区选12株具有代表性的苜蓿植株,剪取苜蓿全株成熟叶片(未展开叶片和枯黄叶片除外),通过Image Pro Plus软件测定其总面积,然后烘干称重,比叶重(specific leaf weight,SLW)通过叶片烘干总重与总面积的比值计算;叶片氮含量采用凯氏定氮法测定。
1.3.3 干物质产量及茎叶比 采用样方法测定,在光合测定结束后随机选取长势一致且能够代表本小区长势的苜蓿样方(1 m×1 m)进行刈割,重复3次,留茬5 cm左右,另取400 g左右带回实验室,于105℃下杀青30 min后65℃烘干至恒重,计算出苜蓿含水率并进一步折算出苜蓿干物质产量;将烘干后的苜蓿样品进行茎叶分离,并分别称重,茎叶比通过茎秆的重量和叶片的重量的比值计算。
1.3.4 光合产物测定 将烘干粉碎后的全株苜蓿样品通过蒽酮比色法对淀粉和可溶性糖含量进行测定[15]。
1.4 数据处理与分析
采用Microsoft Excel 2016整理试验数据,采用SPSS 22(SPSS Inc.,美国)进行方差分析、数据的z-score标准化,采用Origin Pro 2021(Origin Lab,美国)进行主成分分析(principal component analysis,PCA)和绘图,采用Image Pro Plus 6.1(Media Cybernetics,美国)对扫描苜蓿叶片获得的图像进行叶长、叶宽、叶面积的测量;采用IBM SPSS AMOS 24(SPSS Inc.,美国)进行结构方程模型的计算,分析主要环境因子与净光合速率和蒸腾速率的关系,以及叶片氮含量、主要光合性能和叶片形态指标与干物质产量的关系,采用多个模型适配性参数对模型进行合理的评价,主要包括卡方值与自由度之比小于3、显著性概率值大于0.05、近似误差平方根小于0.1、比较模型指数大于0.9、Tucker-Lewis指数大于0.9、拟合优度指数大于0.9、规范拟合指数大于0.9,当模型符合各个评价指标的标准时,说明该模型适配度较好。采用Microsoft PowerPoint 2016进行结构方程模型的绘制。
2 结果与分析
2.1 田间环境因子日变化
在10:00-20:00,光合有效辐射(PAR)日变化呈“单峰”曲线,从10:00开始,随着时间的推移,PAR逐渐增加,至14:00时达到最大值,之后逐渐下降,至20:00达到最低值(图1)。田间CO2浓度(Ca)的变化规律为“V”型,早上10:00为最大值,随后缓慢下降,在16:00降至最低值,随后又逐渐回升。在光合日变化测定期间,空气相对湿度(RH)的变化幅度为12.85%~28.95%,在10:00左右时为最高,此后随着温度的迅速升高而快速下降,在16:00降至最低值,之后随着大气温度的降低又有所回升。大气温度(Ta)在一天当中为10:00最低,此后随着光合有效辐射的增加而逐渐升高,在16:00达到最高点,为41.05℃,其峰值相对PAR略有滞后,之后随着光合有效辐射的降低而缓慢下降。叶表饱和蒸汽压(Vpd)l的变化规律和Ta的变化趋势一致。

图1 田间环境因子日变化Fig.1 Daily variation of environmental factors in the field
2.2 不同施氮水平对苜蓿叶片光合日变化的影响
2.2.1 紫花苜蓿叶片净光合速率日变化特征 施氮处理(N1、N2、N3处理)净光合速率(Pn)日均值均极显著大于不施氮处理(P<0.01),不同施氮水平下,紫花苜蓿叶片净光合速率日变化趋势均呈典型的“双峰”曲线(图2),光合测定期间,N2处理的Pn均高于其他处理,上午10:00-12:00呈快速上升趋势,12:00出现第一峰值,且为全天最大值,随后在14:00各处理紫花苜蓿均出现不同程度的“光合午休”,随后又呈上升趋势,在16:00左右出现第二峰值,此后又缓慢下降,至20:00降至一天中最低值。各处理紫花苜蓿的日平均净光合速率N2处理最高,其次分别为N3、N1、CK处理(图3a)。
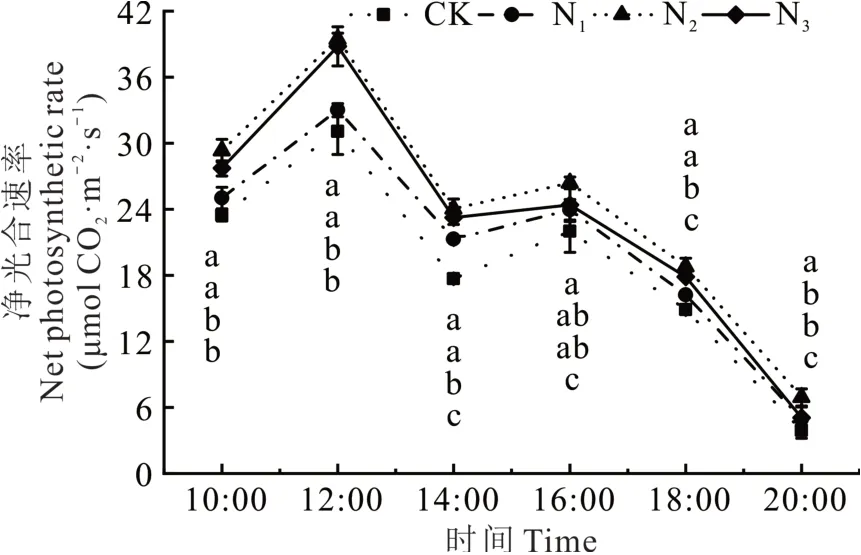
图2 不同施氮水平下苜蓿叶片净光合速率日变化Fig.2 Daily variation of net photosynthetic rate of alfalfa leaves under different levels of nitrogen application
2.2.2 紫花苜蓿叶片蒸腾速率日变化特征 不同施氮水平下,紫花苜蓿叶片蒸腾速率(Tr)日变化进程与净光合速率基本一致,均为不对称“双峰”曲线,但其峰值出现时间相对净光合速率滞后2 h左右(图4)。光合测定期间,N2处理的Tr均高于其他处理,上午10:00-14:00呈快速上升趋势,14:00出现第一峰值,且为全天最大值,随后在16:00时各个处理均处在谷底,第二峰值出现在18:00左右,此后Tr急速下降,至20:00达到一天中最低值。各处理紫花苜蓿的日平均蒸腾速率由大到小的顺序依次为N2>N3>N1>CK处理,且N2、N3处理之间差异不显著,但施氮处理均显著大于不施氮处理(P<0.05)(图3b)。

图3 不同施氮水平下苜蓿叶片光合参数日均值Fig.3 Daily average values of photosynthetic parameters of alfalfa leaves under different levels of nitrogen application

图4 不同施氮水平下苜蓿叶片蒸腾速率日变化Fig.4 Daily variation of transpiration rate of alfalfa leaves under different levels of nitrogen application
2.2.3 紫花苜蓿叶片胞间CO2浓度日变化特征 不同施氮水平下,紫花苜蓿叶片胞间CO2浓度(Ci)日变化进程呈现“V”型的变化(图5),上午10:00为全天的最大值,随着时间的推移,苜蓿叶片Ci逐渐下降,在14:00达到一天中最低值,此后,在20:00又快速回升至“V”型另一个高点。各处理紫花苜蓿的日平均Ci中N2处理最低,其次分别为N3、N1、CK处理且施氮处理均显著小于不施氮处理(P<0.05)(图3c)。

图5 不同施氮水平下苜蓿叶片胞间CO2浓度日变化Fig.5 Daily variation of intercellular CO2 concentration in alfalfa leaves under different levels of nitrogen application
2.2.4 紫花苜蓿叶片气孔限制值日变化特征 不同施氮水平下,紫花苜蓿叶片气孔限制值(Ls)日变化进程呈现“倒V”型的变化趋势,整体变化规律与胞间CO2浓度相反(图6)。上午10:00和下午20:00为气孔限制值较低的两个时间点,由于温度的升高,上午10:00-14:00为快速增长阶段,14:00到达全天最大值,随后缓慢降低。其中施氮处理紫花苜蓿的日平均气孔限制值均显著大于不施氮处理(图3d)。

图6 不同施氮水平下苜蓿叶片气孔限制值日变化Fig.6 Daily variation of stomatal limitation value of alfalfa leaves under different levels of nitrogen application
2.2 .5紫花苜蓿叶片水分利用效率日变化特征
不同施氮水平下,紫花苜蓿叶片水分利用效率(WUE)日变化进程均呈不对称“双峰”曲线(图7),苜蓿叶片水分利用效率在上午的10:00-12:00为一天中最高的时段,其中12:00出现第一个峰值,随后快速下降,于14:00达到谷值,这是由于苜蓿“光合午休”导致净光合速率下降,16:00达到第二个峰值,但第二个峰值明显低于第一个峰值。各处理紫花苜蓿的日平均水分利用效率由大到小的顺序依次为N2>N3>N1>CK处理(图3e)。
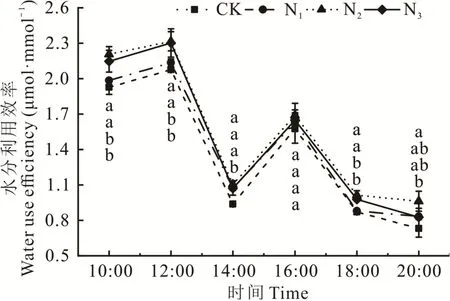
图7 不同施氮水平下苜蓿叶片水分利用效率日变化Fig.7 Daily variation of water use efficiency of alfalfa leaves under different levels of nitrogen application
2.3 不同施氮水平对苜蓿叶片形态结构的影响
紫花苜蓿叶面积、叶长、叶宽、比叶重均随着施氮水平的增加呈先增加后降低的趋势(表1)。N2处理下紫花苜蓿的叶面积和比叶重显著高于其他各处理(P<0.05),N2和N3处理间的叶长和叶宽差异不显著(P>0.05),但N2和N3处理均显著高于CK和N1处理(P<0.05)。施氮水平对初花期紫花苜蓿叶面积、叶长、叶宽、比叶重均具有极显著的影响(P<0.01)。由F值可知,施氮水平对紫花苜蓿叶片形态结构的影响最大的为叶面积,其次为比叶重、叶长和叶宽。

表1 不同施氮水平下苜蓿叶片形态结构变化Table 1 Changes in morphological structure of alfalfa leaves under different levels of nitrogen application
2.4 不同施氮水平对苜蓿干物质产量构成、光合产物以及叶片氮含量的影响
随施氮量的增加,紫花苜蓿的干物质产量、叶干重、茎干重、叶片氮含量、淀粉、可溶性糖含量均呈先增加后降低的趋势,而茎叶比则呈先降低后增加的趋势(表2)。紫花苜蓿的干物质产量、叶干重、可溶性糖含量为N2处理显著高于CK和N3处理(P<0.05),施氮处理间紫花苜蓿的茎干重和茎叶比差异不显著(P>0.05),但施氮处理的茎干重显著大于不施氮处理(P<0.05),茎叶比显著小于不施氮处理(P<0.05),且N2处理的叶片氮含量、淀粉含量显著大于其他各处理(P<0.05)。施氮水平对初花期紫花苜蓿干物质产量、叶干重、茎干重、叶片氮含量和淀粉均具有极显著影响(P<0.01),对茎叶比和可溶性糖具有显著影响(P<0.05)。由F值可知,施氮水平对叶片氮含量影响最大,其次分别为叶干重、干物质产量、淀粉、茎干重、可溶性糖、茎叶比。

表2 不同施氮水平下苜蓿干物质产量构成、光合产物和叶片氮含量Table 2 Dry matter yield components,photosynthetic products and nitrogen content of leaves of alfalfa at different nitrogen application levels
2.5 不同施氮水平下紫花苜蓿干物质产量、叶片形态以及光合作用的主成分分析及综合评价
通过主成分分析对不同施氮水平下苜蓿干物质产量、叶片形态以及光合作用进行综合评价(图8),综合特征值大于1且累计方差贡献率大于90%来确定最佳的主成分数。结果表明,第1主成分对总方差贡献率达89.5%,其中比叶重、干物质产量、叶面积、叶宽、叶片氮含量、净光合速率、蒸腾速率、胞间CO2浓度、水分利用率贡献较大,第2主成分对总方差贡献率达8.0%,其中可溶性糖和淀粉贡献较大,而比叶重贡献最小,主成分1和主成分2累计贡献率达到97.5%,可以代表紫花苜蓿干物质产量、叶片形态以及光合作用的绝大部分信息。不同处理下,第1主成分得分由高到低依次为N2>N3>N1>CK处理,第2主成分得分由高到低依次为N1>N2>CK>N3处理,综合主成分1和2可知,不同施氮处理下干物质产量、叶片形态以及光合作用综合得分最高的为N2处理,其次分别为N3、N1和CK处理。

图8 不同施氮水平下苜蓿干物质产量、叶片形态以及光合作用的主成分分析Fig.8 Principal component analysis of dry matter yield,leaf morphology and photosynthesis of alfalfa under different levels of nitrogen application
2.6 基于结构方程模型综合分析主要环境因子与净光合速率和蒸腾速率的关系
4个环境因子共解释了净光合速率84%的差异,通过标准化影响柱状图可以发现(图9),叶表饱和蒸汽压(rd=-0.31,rd:直接回归权重系数)对净光合速率有直接影响;空气相对湿度直接(rd=0.33)和间接(ri=0.26,ri:间接回归权重系数)通过叶表饱和蒸汽压影响净光合速率;光合有效辐射直接(rd=0.96)或间接(ri=-0.23)通过空气相对湿度(r=0.01,r:回归权重系数)、大气温度(r=0.54)以及叶表饱和蒸汽压(r=-0.26)影响净光合速率;大气温度直接(rd=0.03)或间接(ri=-0.61)通过空气相对湿度(r=-0.90)和叶表饱和蒸汽压(r=0.01)影响净光合速率。4个环境因子还解释了蒸腾速率73%的差异,通过标准化影响柱状图可以发现,叶表饱和蒸汽压(rd=-0.61)对蒸腾速率有直接影响;空气相对湿度直接(rd=-0.76)和间接(ri=0.51)通过叶表饱和蒸汽压影响蒸腾速率;光合有效辐射直接(rd=0.67)或间接(ri=0.17)通过空气相对湿度(r=0.01)、大气温度(r=0.54)以及叶表饱和蒸汽压(r=-0.26)影响蒸腾速率;大气温度直接(rd=-0.03)或间接(ri=-0.06)通过空气相对湿度(r=-0.90)和叶表饱和蒸汽压(r=0.01)影响蒸腾速率。

图9 基于结构方程模型综合分析主要环境因子与净光合速率和蒸腾速率的关系Fig.9 Integrated analysis of the relationship between major environmental factors and net photosynthetic rate and transpiration rate based on structural equation model
2.7 基于结构方程模型综合分析叶片氮含量、主要光合性能和叶片形态指标与干物质产量的关系
叶片氮含量、叶面积、比叶重、净光合速率、蒸腾速率共解释了干物质产量88%的变异,通过标准化影响柱状图可以发现(图10),净光合速率(rd=0.60)对干物质产量有直接影响;蒸腾速率直接(rd=-0.02)或间接(ri=0.53)通过净光合速率(r=0.89)影响干物质产量的形成;叶面积直接(rd=-0.07)或间接(ri=0.59)通过比叶重(r=0.65)和蒸腾速率(r=0.90)影响干物质产量的形成;比叶重直接(rd=0.18)或间接(ri=0.02)通过蒸腾速率(r=0.05)影响干物质产量的形成;叶片氮含量直接(rd=0.30)或间接(ri=0.56)通过叶面积(r=0.84)、比叶重(r=0.27)、净光合速率(r=0.09)和蒸腾速率(r=0.03)影响干物质产量的形成。

图10 基于结构方程模型综合分析叶片氮含量、主要光合性能和叶片形态指标与干物质产量的关系Fig.10 Integrated analysis of leaf nitrogen content,major photosynthetic properties and leaf morphological indicators in relation to dry matter yield based on structural equation model
3 讨论
3.1 不同氮素水平对紫花苜蓿干物质产量的影响
土壤氮含量和生物固氮是紫花苜蓿两个可供选择的氮获取策略,外源氮的添加能够有效地增加土壤氮资源有效性,而土壤氮有效性能够将苜蓿植株间竞争的压力从地下转移到地上,以诱导更多的资源分配到以叶片为主的地上部分[16]。本研究中,苜蓿干物质产量随着施氮量的增加呈先增加后降低的趋势,对比不施氮处理,氮添加显著提高了干物质产量,目前关于苜蓿在种植过程中是否需要额外的氮肥添加或者氮肥添加量的大小以提高其干物质产量这一关键问题上仍存在较大争议,有一部分观点认为苜蓿可以与根瘤菌共生固氮,将大气中的氮气转化为可以供植物吸收利用的形态以满足自身植株生长的需要,因此,氮肥的添加并不会对苜蓿的生长有促进作用[17],也有一部分观点认为施少量的氮能够促进苜蓿的生长,在苜蓿生长初期及衰老期苜蓿根瘤菌固氮酶活性较弱,外源氮的添加能够显著的提高苜蓿的干物质产量[13]。相反,氮肥的过量施入则会抑制苜蓿的生长发育,过量的氮添加会破坏土壤微环境,土壤本身具有一定的缓冲能力,其所含有的铵态氮和硝态氮在被植物吸收时向土壤释放的H+和OH-能够相互中和,当外界添加铵态氮或硝态氮的任意一种就会打破这种平衡[18],同时,土壤的酸化和碱化并不利于微生物的活动与繁殖,进而影响苜蓿田的生物固氮以及土壤养分平衡和可持续利用能力[19]。对于氮肥添加是否促进或者抑制苜蓿的生长,或是没有影响,本研究认为,除了可能由上述的根瘤菌固氮、土壤pH值和微生物数量的变化造成的影响外,还可能与苜蓿品种特性、地区间环境差异及土壤基础养分含量密不可分,因此,施氮对苜蓿干物质产量的作用效果因不同的研究地区而导致研究结果不同。本研究中,对比不施氮处理,施氮处理苜蓿叶片干重增加了7.83%~11.98%,茎秆干重增加了3.6%~6.4%,叶片干重增加幅度更大,说明施氮处理下苜蓿植株会将更多的生物量向叶片分配,同时,本研究中施氮处理茎叶比的下降也能够反映这一点。
3.2 不同氮素水平对紫花苜蓿光合作用的影响
植物光合作用是维持自身生命活动的主要能量来源,实际光能转化效率仅为理论值的25%左右,仍有很大的提升空间,进一步地提高光能转化效率已成为大幅度提高作物干物质产量的重要甚至是唯一可行的途径[20]。本研究中,在光合日变化测定期间,施氮处理的净光合速率、蒸腾速率和水分利用效率均高于不施氮处理,这说明施氮能够促进苜蓿的光合作用。研究表明,叶绿素是植物进行光合作用的重要物质基础,氮素能够提高苜蓿叶片的叶绿素含量,并延缓叶片的衰老速度,进而提高苜蓿生长后期的叶片氮含量和净光合速率[21],此外,施氮能够促进叶片栅栏组织和海绵组织的发育,高度发达的栅栏组织既能够最大限度利用衍射光进行光合作用,又能够促进叶片水分的高效运输,并避免叶肉组织被强光照灼烧,而海绵组织的增厚能够为光合过程中气体的交换提供足够的空间,栅栏组织和海绵组织的协同优化可以更有效地促进苜蓿光合作用的提高[22]。在本研究中,施氮处理下的胞间CO2浓度低于不施氮处理,这可能是由于施氮条件下苜蓿净光合速率增加,同时叶片内的CO2消耗加快,气体交换的速度并不能达到叶片同化CO2的速率,从而导致胞间CO2浓度的下降。
逆境常常抑制植物光合作用,使得植物光合作用能力明显降低[23]。大多数植物在夏季中午均有光合“午休”的现象,特别是在干旱胁迫以及营养供给不足等逆境条件下。本研究中,不同施氮水平下,紫花苜蓿净光合速率日变化均呈不对称“双峰”曲线,中午14:00出现光合“午休”,此时光抑制程度最严重。与前人的研究结果相比[24],本研究中的光合“午休”出现的时间延迟了1~2 h,导致光合午休出现时间不一致,一部分原因可能是试验地点处于不同的时区,具有2 h左右的时差,还可能是因为苜蓿生长的年限不同,本研究是在苜蓿种植的第2年进行,对强光照和高温具有很好的适应性,而前人的研究中苜蓿生长年限在4年以上,这时苜蓿的生长性能及光合能力均有所下降,进而导致光合作用的高峰和低谷出现时间有所差异[25]。另有研究认为,苜蓿并不全会出现光合“午休”现象,本研究结果与此不一致,可能是由于未出现光合午休的苜蓿品种具有较强的光合能力和应对高温环境的适应能力,以及灌溉方式、光照辐射和空气湿度的高低不同等[26]。
植物叶片光合作用的气体交换主要受气孔因素和非气孔因素的影响[27],本研究中,苜蓿叶片净光合速率和气孔限制值随着施氮量的增加呈先增加后降低的趋势,而胞间CO2浓度呈先降低后增加的趋势,不同施氮条件下苜蓿叶片净光合速率和胞间CO2浓度呈负相关,这说明低氮和高氮条件下苜蓿光合作用主要受到非气孔因素的影响,这可能是由于低氮和高氮均会对苜蓿造成胁迫,导致苜蓿光合酶受到抑制从而使光合能力下降[27]。本研究中,在10:00-12:00,苜蓿净光合速率和气孔限制值呈上升的趋势,而胞间CO2浓度呈下降的趋势,这说明在这个时间段净光合速率主要受到环境因子和光合活性的影响,与胞间CO2浓度的变化关系不大;在12:00-16:00,苜蓿叶片的净光合速率和胞间CO2浓度均呈先降低后增加的趋势,气孔限制值呈相反的趋势,净光合速率和胞间CO2浓度呈正相关,这说明光合“午休”的出现主要受到胞间CO2浓度的限制,这可能是由于中午光照强,气温高,苜蓿叶片水分蒸发快,为了适应外界环境变化,苜蓿叶片部分气孔关闭,导致叶片气孔导度下降[24],从而影响苜蓿叶片内CO2的交换;在16:00-20:00,这个时间段与上午12:00之前规律一致,净光合速率和气孔限制值与胞间CO2浓度均呈负相关,说明这个时间段限制净光合速率的主要是光照强度和光合活性的下降。
3.3 不同氮素水平对紫花苜蓿叶片形态结构的影响
叶片是苜蓿进行光合作用的主要场所,光合作用是苜蓿干物质产量形成的基础,叶片形态作为苜蓿生产最重要的生长指标,是除单叶光合速率以外决定最终干物质产量的重要参数[28-29]。植物叶片的形态结构变化与其生理功能和外界环境密切相关,在长期氮肥添加的影响下,叶片的形态结构会发生一定的生理性适应[19]。氮素对苜蓿叶片形态结构的影响是多方面因素综合作用的结果,研究表明,氮素对植物叶片栅栏细胞的分裂和发育以及海绵细胞的发育有促进作用,尤其是在植物生长中后期,随着氮含量的增加这种促进作用逐渐增强[2]。氮还是光合色素合成的必要成分,施氮可以提高光合色素含量,进一步提高叶片的光合固碳能力,在叶片氮限制的条件下,添加适宜的氮肥有助于提高植物的光能利用效率[23]。本研究中,施氮处理苜蓿叶长、叶宽、叶面积均显著高于不施氮处理,这与前人的研究相一致[30]。氮是叶绿素和光合蛋白质的重要组成部分,能够有效地促进叶片的生长[31]。叶面积的增大能有效增加植物叶片的捕光面积,提高植物的生长速率,但是,叶面积的增大会升高植物的蒸腾速率,造成细胞水势和膨压的升高。而当氮肥过量时会造成叶片CO2同化能力降低,不利于中后期叶片光合同化物的积累与运输,进而抑制苜蓿的叶片生长。氮素除了直接作用于植物叶片面积的增加,还能够延缓叶片的衰老。研究表明,叶片衰老与植物体自身的生命周期有关,并受到叶片氮缺乏的诱导,叶片氮缺乏最先出现在下层叶片上,从叶尖沿着叶片中脉向着叶片基部逐渐失绿干枯[22]。有研究表明,ORE1是调控拟南芥(Arabidopsis thaliana)叶片自然衰老的关键转录因子,过量表达会诱导叶片提前出现衰老,其中ORE1是缺氮诱导叶片衰老的主要因素,并受到NLA/PHO2的调节[8]。此外,施氮还能够促进比叶重的增加,升高的比叶重主要是由于栅栏叶肉层的增加或者栅栏细胞的延伸,与此同时,叶片韧性和密度会影响叶片色素的含量和分布,从而说明比叶重和光合作用密切相关[22]。
4 结论
施氮能够增加紫花苜蓿的净光合速率、蒸腾速率和水分利用效率,降低胞间CO2浓度。随着施氮量的增加,紫花苜蓿的叶长、叶宽、叶面积、比叶重,以及叶片干重、茎秆干重、干物质产量、叶片氮含量、淀粉和可溶性糖含量均呈先增加后降低的趋势。综合来看,增施氮肥有助于苜蓿光合面积和光合速率的协同改进,有利于光合产物的合成,从而促进苜蓿干物质产量的提高,当施氮量为120 kg·hm-2时提升效果最为明显。
