LmNotch基因在飞蝗翅发育中的功能分析
2022-09-16徐子龙张福斌武兆辰张建珍赵小明
徐子龙,张福斌,武兆辰,张 晶,,张建珍,赵小明*
(1. 山西大学生命科学学院,太原 030006;2. 山西大学应用生物学研究所,太原 030006)
昆虫是世界上数量最多、种类最大的生物类群,也是唯一一种进化出了飞行能力的无脊椎动物。翅在昆虫迁飞、求偶、觅食和躲避敌害等方面具有重要作用[1]。昆虫的翅是由外胚层发育而来,完全变态昆虫是由保留在幼虫体内的器官芽经过完全变态发育成为完整的翅,如黑腹果蝇Drosophila melanogaster等;渐变态昆虫则由若虫的“翅芽”经过不完全变态发育成为完整的翅,如飞蝗Locusta migratoria等[2]。因此,对昆虫翅发育过程的研究将有助于了解昆虫的变态。昆虫翅发育的控制是一个非常精确和复杂的过程。目前,对昆虫翅发育机制的研究主要来自黑腹果蝇[3]。在果蝇中,翅的发育受到 Decapentaplegic(Dpp)、Wingless(Wg)、Hedgehog(Hh)、Hippo、Notch以及JNK等信号通路的调控[4-6],而且在许多不同的动物中,这些信号通路在进化上是高度保守的。目前,在很多模式昆虫中这些信号通路中的一些影响翅发育的关键基因已被鉴定出来,如黑腹果蝇和赤拟谷盗Tribolium castaneum等[7-10]。
Notch信号通路在动物中是高度保守的,在细胞发育过程中控制细胞命运,并维持成体组织的稳态[11,12]。Notch信号通路主要由Notch受体、Notch配体、转录因子、其他效应子与Notch调节分子构成[13]。其激活依赖于一个细胞膜上的配体与相邻细胞的 Notch受体结合,这种结合使得 Notch的胞内结构域 NICD(intracellular domain of Notch)释放,之后进入细胞核内与转录因子CSL结合,调控其下游的基因表达[14,15]。Notch是一个300 kDa的单次跨膜蛋白,由一个大的胞外区域、一个单一的跨膜部分和一个小的胞内区域组成[16],其中胞外结构域由多个数量不同的EGF(epidermal growth factor)重复单元、3个Lin12/Notch repeats(LNRs)和一个邻近跨膜结构域组成,胞内结构域包括一个RAM(recombination binding protein-J-associated molecule)区域、7个锚蛋白重复结构域(Ankyrin)、一个TAD反激活区域(transactivation domain)和一个C末端区域[11]。在昆虫翅发育研究中,Notch信号通路直接参与果蝇背部翅原基边界的形成以及翅细胞的增殖分化[17]。然而,在非模式昆虫中翅发育相关基因的鉴定及功能仍不清楚。
飞蝗是一种典型的渐变态昆虫,也是世界性农业害虫。本文以Notch信号通路受体为研究对象,探讨其在飞蝗翅发育中的功能,以期为渐变态昆虫翅发育机制研究提供理论依据,同时为蝗虫防治寻找新分子靶标,从而为蝗灾生物防治提供基础资料。
1 材料与方法
1.1 试验材料
试验所用飞蝗虫卵保存于本实验室的昆虫饲养室,于人工孵化箱中孵化后移至干净的纱笼中,每天喂食新鲜的小麦幼苗(3龄后辅以麦麸),待其生长至5龄后进行试验。培养温度为(30±2)℃,湿度为(40±10)%。
1.2 相关试剂
RNA提取试剂(RNAiso Plus)购于大连宝生物公司(TaKaRa);双链RNA合成试剂盒购于Promega公司;胶回收试剂盒购于天根公司(TIANGEN);HiScriptⓇⅢ RT SuperMix for qPCR(+gDNA wiper),ChamQ Universal SYBR qPCR Master Mix购于南京诺唯赞生物科技有限公司。
1.3 cDNA序列获取及聚类分析
基于飞蝗转录组和基因组数据库,搜索得到LmNotch基因的cDNA序列。将其cDNA序列翻译成氨基酸序列,并对其编码蛋白的功能域进行分析。下载人Homo sapiens、小鼠Mus musculus、黑腹果蝇D.melanogaster、亚洲玉米螟Ostrinia furnacalis、棉铃虫Helicoverpa armigera、赤拟谷盗T. castaneum、德国小蠊Blattella germanica等物种的Notch氨基酸序列,利用MEGA 6.0软件的Neighbor-Joining方法构建系统进化树,独立分析1000次,数值代表bootstrap估算值。
1.4 总RNA的提取及表达特性分析
摘取5龄飞蝗第1~8 d(N5D1-N5D8)的翅芽(WP)组织,同时取5龄第6 d的若虫各个组织包括足(LG)、体壁(IN)、翅芽(WP)、脂肪体(FB)、前肠(FG)、中肠(MG)、后肠(HG)、胃盲囊(GC)、精巢(TE)、卵巢(OV)。利用RNAiso Plus提取总RNA,最终定量至0.5 μg/μL。根据反转录说明书进行反转录,得到cDNA。通过Primer Premier 5.0软件设计LmNotch基因的特异性荧光定量引物(表1,由生工公司合成),以RPL-32为内参基因,利用qRT-PCR的方法检测LmNotch的时期和组织表达情况,设置4次重复试验,结果用2-ΔΔCt法进行分析[18]。

表1 试验中所用引物Table 1 Primers used in this experiment
1.5 RNA干扰和H&E染色
根据LmNotch的cDNA序列设计并合成带有T7启动子序列的特异性引物(表1,由生工公司合成),以5龄若虫翅芽cDNA为模板进行PCR扩增,扩增产物通过琼脂糖凝胶电泳检测纯度后利用胶回收试剂盒进行胶纯化。以1 μg胶回收产物为模板利用dsRNA合成试剂盒合成LmNotch基因的dsRNA(dsLmNotch),将产物进行琼脂糖凝胶电泳检测为单一条带后定量至2 μg/μL。选取24 h内的5龄第1 d的飞蝗,对其注射dsLmNotch(注射数量为42只),每只的注射剂量为10 μg,同时注射等量的dsGFP(共47只)作为对照。取5龄第6 d(N5D6)的飞蝗翅芽组织,一部分用于沉默效率检测,检测时取6组重复,每组设2次技术重复,另一部分用 3%戊二醛进行固定。同时摘取对照组和处理组蜕皮前(N5D7)的翅芽,用 3%戊二醛固定,随后送往武汉塞维尔生物科技有限公司进行石蜡切片和H&E(伊红和苏木精)染色。剩余虫子正常饲养进行表型观察。
1.6 LmNotch对其他翅发育相关基因表达的影响
利用课题组飞蝗转录组数据库,识别翅发育相关基因包括Dpp、Omb(optomotor-blind)、Salm(spalt major)、Salr(spalt related)、Yorkie以及翅特异表皮蛋白基因LmACP7、LmACP8、LmACP19。分别以RNA干扰的处理组和对照组个体翅芽组织cDNA为模板,利用qRT-PCR检测其他翅发育相关基因的表达,检测引物见表1(由生工公司合成)。
1.7 数据统计与分析
采用2-ΔΔCt法对LmNotch基因在不同发育天数和不同组织中的相对表达量、RNA干扰后LmNotch沉默效率以及沉默LmNotch后翅发育相关基因的相对表达量进行分析,采用Studentt-test方法进行差异表达分析(*P<0.05表示差异显著,**P<0.01表示差异极显著)。
2 结果与分析
2.1 LmNotch功能域及聚类分析
根据飞蝗转录组和基因组数据库,搜索获得LmNotch基因cDNA序列,该基因含有7455 bp开放阅读框,编码2484个氨基酸。通过对LmNotch基因编码蛋白进行结构分析发现其含有36个EGF(epidermal growth factor)重复单元、3个NL(Lin-12/Notch)结构域、1个NOD(NOTCH protein domain)结构域、1个NODP结构域、7个ANK(Ankyrin repeats)结构域和1个DUF3454(Domain of unknown function)区域(图1A)。聚类分析显示,Notch在物种间保守性较高,且LmNotch与蜚蠊目Notch聚为一支(图1B)。

图1 Notch蛋白结构域与聚类分析Fig. 1 Phylogenetic and domain analysis of LmNotch
2.2 LmNotch在5龄飞蝗中的表达特性
利用qRT-PCR进行LmNotch的表达特性检测,结果显示LmNotch在5龄若虫翅芽发育第1~4 d的表达量较高(N5D1~N5D4),而在第5~8 d表达量较低(N5D5~N5D8)(图2A);LmNotch在足、翅芽、前肠和卵巢中有较高表达,而在其他组织中表达量相对较低(图2B)。
2.3 LmNotch生物学功能分析
对5龄第2 d的飞蝗注射dsLmNotch,以注射等量dsGFP的飞蝗为对照,取翅芽检测沉默效率。结果显示,相对于对照组,处理组中LmNotch表达极显著降低(图3A)。表型观察结果显示,对照组飞蝗均能蜕皮至成虫,而注射dsLmNotch的飞蝗约70%无法完成蜕皮过程产生致死表型,另有10%的飞蝗能够蜕至成虫但出现翅紊乱表型(图3B,3C)。分别对N5D6和N5D7的对照组和处理组飞蝗翅芽进行石蜡切片和H&E染色分析,结果显示,对照组中N5D6和N5D7翅芽旧表皮发生降解,形成大量新表皮并产生折叠,上下两层新表皮间形成空腔,而处理组中翅芽旧表皮虽能够正常降解但翅上下两层表皮之间腔空间增大,新表皮无法完整形成(图4)。

图3 注射dsRNA后对LmNotch基因表达及飞蝗翅发育的影响Fig. 3 Effects of dsLmNotch on the expression of LmNotch and the wing development of L. migratoria
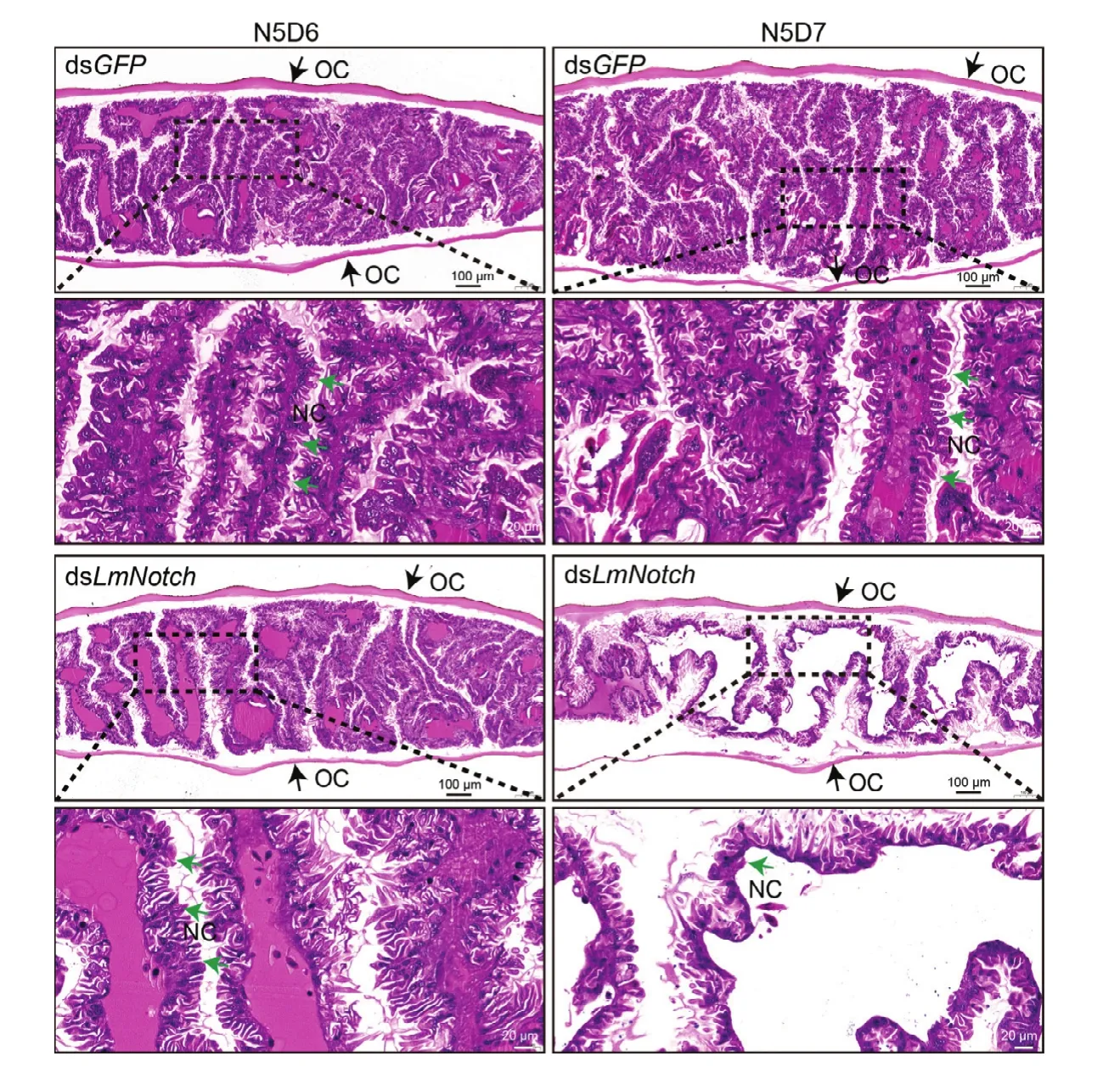
图4 LmNotch沉默后的翅芽H&E染色观察Fig. 4 The observation of wing pads stained by H&E staining at N5D6 and N5D7 after the silence of LmNotch
2.4 LmNotch影响翅发育相关基因的表达
利用qRT-PCR检测沉默LmNotch的表达后翅发育相关基因及翅特异表皮蛋白基因的表达,结果显示Dpp、Omb、LmACP7和LmACP8基因的表达量显著降低,而Yorkie和LmACP19的表达量显著升高(图5)。

图5 沉默LmNotch后翅发育相关基因的表达情况Fig. 5 The expression of wing development genes detected by qRT-PCR after silencing of LmNotch
3 讨论
本文基于飞蝗翅转录组数据库,获得了Notch信号通路中关键受体因子Notch。与其他物种Notch类似,飞蝗Notch含有EGF重复单元、Lin-12/Notch结构域、NOD/NODP结构域和ANK结构域,且该蛋白在物种间高度保守(图1),暗示其可能具有保守性功能。已有研究表明Notch在生物体的生长发育、器官形成中的细胞分化增殖和凋亡具有重要作用[19]。如果蝇中,Notch的重复单元EGF-23到EGF-29发生单个氨基酸替换时,导致果蝇Notch信号的异常从而发生表型变化[20]。在哺乳动物中,研究表明Notch信号通路对哺乳动物的神经系统和生殖系统等发育具有重要作用[21]。
在无脊椎动物中,昆虫是唯一有翅的生物类群。昆虫翅的发育受到一系列信号通路的控制,如Hippo,Wingless,Dpp和 Notch等信号通路。在家蚕Bombyx mori中,干扰 Hippo信号通路中转录共激活因子BmYorkie3的表达能够抑制翅生长发育[22]。Dpp信号通路靶基因Sal(Salm和Salr)是飞蝗和果蝇翅生长发育所必需的[23]。在飞蝗中,LmNotch在翅芽组织中高表达(图2),可能参与飞蝗翅的发育。利用飞蝗对RNA干扰的敏感性,合成并向5龄若虫注射LmNotch基因dsRNA,结果显示LmNotch沉默效率达到90%以上,且沉默LmNotch的飞蝗个体出现蜕皮困难和翅紊乱的表型(图3),表明LmNotch在飞蝗蜕皮和翅发育中发挥了重要作用,但LmNotch如何影响飞蝗蜕皮和翅发育尚不清楚。据报道,Notch受体与配体Delta和/或Serrate结合后,会经历一系列的蛋白水解,从而产生Notch胞内结构域(Notch intracellular domain,NICD)[24]。NICD转移到细胞核中,与转录因子Hairless和协同激活因子Mastermind结合,刺激下游靶基因的表达[25]。为了探讨LmNotch在飞蝗翅发育中的下游靶基因,作者根据果蝇翅发育相关基因序列(Dpp,Omb,Salm,Salr和Yorkie)搜索获得了飞蝗同源基因序列并检测了沉默LmNotch表达后翅发育相关基因的表达变化。结果发现,沉默LmNotch表达后Dpp和Omb表达显著下降,Yorkie表达显著上升,而Salm和Salr没有显著变化(图5)。2014年,Djiane等[26]研究发现Notch能够抑制果蝇翅原基中Yorkie的活性,这与本试验结果一致。同样在果蝇翅发育研究中,Dpp对其下游基因omb起正调节的作用[27],而在飞蝗中沉默LmNotch表达后能够降低Dpp和Omb的表达。上述结果表明,LmNotch能够调控Hippo和Dpp信号通路中关键基因的表达进而影响翅的发育。
昆虫翅的发育除了受一系列复杂的基因控制外,还依赖于细胞的一系列功能和细胞外基质。本课题组前期研究中发现飞蝗翅特异表皮蛋白基因(LmACP7,LmACP8和LmACP19)在翅表皮细胞外基质形成和稳定性方面发挥重要作用,这些基因的缺失可导致飞蝗翅发育异常[28-30]。本文研究发现,沉默LmNotch表达后能够显著抑制LmACP7和LmACP8的表达,而促进LmACP19的表达(图5),这可能是导致翅表皮形成异常的原因之一(图4),这些结果暗示LmNotch可能通过调控翅表皮蛋白基因的表达参与飞蝗翅表皮细胞外基质的形成,然而其具体作用机制如何,还需要进一步研究。
