高温低氧对菌核存活率和土壤微生物组成的影响
2022-09-16王嘉豪洪雨欣李聪聪吴波明
王嘉豪,洪雨欣,李聪聪,吴波明
(中国农业大学植物保护学院,北京 100193)
由核盘菌Sclerotinia sclerotiorum引起的菌核病可在油菜、向日葵、大豆、胡萝卜等多种作物上造成严重的产量损失[1-5]。解决菌核病防治问题对我国经济作物生产和粮油食品稳定供给具有重大意义和经济价值。菌核病的田间侵染源主要是土壤中存活的菌核。在较长时间持续湿润条件下,存活的菌核可萌发产生子囊盘[6],释放数量巨大的子囊孢子,侵染周边植株的地上部分,造成常见的顶枯、倒伏等症状[7,8]。菌核也可直接萌发产生菌丝侵染作物的根及地下块茎等组织,田间菌核数量高时,菌丝侵染可导致植株在苗期大量猝倒死亡[9]。由于抗菌核病品种培育难度较大,菌核病的防治主要依赖施用药剂保护植物的易感器官(花),同时减少土壤中存活的菌核数量。与非寄主植物轮作已经被证明可有效减少菌核数量。例如,稻油轮作早已在我国长江流域广泛推广,在油菜菌核病防控中起到了重要作用[10-12]。但是,在水资源缺乏地区或不适合种植水稻的山地,由于核盘菌的寄主范围十分广泛[5],可用于轮作的作物非常少,而且与旱作物轮作需要间隔多年才能有效地控制菌核病[10-13],轮作在实际生产中很难推行。在探索轮作替代方案过程中研究者发现,在实验室高温、高湿和低氧条件下核盘菌存活率可在短时间内迅速降低[14],夏季田间淹水2~3周可以显著减少土壤中存活的菌核数量,从而减轻菌核病的发生[15,16]。尽管已知芽胞杆菌[3,17-21]、假单胞杆菌[20]、链霉菌[3]、盾壳霉[3,22]、木霉[3,7,21,23]、镰孢菌[24]、粘帚霉[25]等多种微生物对核盘菌引起的菌核病具有一定生物防治效果,但是,高温、高湿和低氧条件下土壤中菌核快速死亡的原因和具体机制尚不明确。本研究的目的就是探索高温、高湿、低氧条件对菌核存活率的影响,分析这一过程中土壤微生物结构的变化,以期为通过调节土壤微环境和微生物组成,在短时间内降低土壤存活菌核数量,从而实现防控作物菌核病目标提供理论依据。
1 材料与方法
1.1 土壤样本及供试菌株
所用土壤包括采集于安徽省黄山市徽州区油菜田表土(0~10 cm)和池塘淤泥。采集后先自然风干,然后粉碎并过 10目筛除去植物残体等大块杂质。所用菌株采集自江西婺源的油菜菌核病受害植株,经分离纯化得到核盘菌菌核。在锥形瓶中灭菌马铃薯块上扩大培养4周左右得到大量高质量菌核,洗净风干后,选取饱满、颜色深黑、大小一致且外表无损伤的菌核用于实验。
1.2 菌核处理
试验采用多因素随机区组设计,试验1包括土壤(池塘淤泥和油菜田土)、水分(风干和加水10 mL/50 g土)、温度(15 ℃和35 ℃)、氧气(正常氧和低氧)和时间(1、2、4周)5个因素, 48个处理;试验2包括灭菌(灭菌和不灭菌)、水分(加水5、10和15 mL/50 g土)、氧气(低氧和正常氧)和温度(15 ℃和25 ℃)4因素,24个处理(时间均为4周);试验3包括灭菌(灭菌和不灭菌),水分(风干和加水10 mL/50 g土)、温度(15 ℃、25 ℃和35 ℃)、氧气(正常氧和低氧)和时间(2、4周)5因素,48个处理。每个处理包含一个直径90 mm培养皿,其中加入50 g风干土壤及50颗挑选好的菌核,尽量将菌核完全用土壤覆盖。加水处理组用移液枪均匀加入10 mL无菌水,低氧处理将培养皿(不加盖)放入12 cm×17 cm 的真空袋中,用真空包装机抽净袋中空气并封口。抽真空时间为30 s,封口时间为3 s,真空度约为0.098 MPa。将各处理置于相应温度的恒温培养箱中培养。所有试验均重复3次。
1.3 土壤采样及菌核萌发率检测
分别在处理1(试验1特有)、2、4周后进行采样检测。首先,每个处理收集菌核周围附着的土壤约10 g,装入50 mL离心管中,保存于-20 ℃冰箱中用于土壤微生物多样性分析。然后,在流动自来水下筛洗收集菌核,冲洗菌核表面土壤,再经过3%含氯消毒水处理3 min,75%酒精消毒1 min,无菌水漂洗3次后置于超净台中风干菌核表面水分,随后将菌核转移至含50 mg/L硫酸链霉素的PDA平板上,于25 ℃黑暗条件下培养7 d,每天统计菌核萌发情况。运用SAS软件(Rev. 9.4,SAS Institute Inc.,Cary,NC USA)对菌核萌发数据进行分析,首先进行Shapiro-Wilk正态性检验,因萌发率(x)数据不符合正态分布和方差齐性要求,数据经逻辑斯蒂转换(y= ln[(x+0.1)/(1.01-x)])后,再运用GLM过程进行方差分析。针对效应显著的因子,采用LSD法对不同处理的平均值进行多重比较。
1.4 土壤样本DNA提取与高通量测序
选取试验1的16个土壤样本和试验2的6个和试验3的8个样本作为代表,其中3-2-1与3-2-2、3-4-1和3-4-2、3-10-1和3-10-2、 3-12-1和3-12-2为重复(表1)。每个样本混匀后取0.5 g土壤用试剂盒(FastDNA®Spin Kit for Soil,安诺伦(北京MP Biomedicals)生物科技有限公司)提取每个样本的总DNA。借助NanoDrop 2000检测DNA的纯度和浓度,用1%的琼脂糖凝胶电泳检测其完整性。对合格DNA首先使用NEXTFLEX Rapid DNA-Seq Kit扩增细菌16S rRNA基因V3-V4区(引物为338F 5′-ACTCCTACGGGAGGCAGCAG-3′和 806R 5′-GGACTACHVG GGTWTCTAAT-3′)以及真菌的 ITS1 区(引物为 ITS1F 5′-CTTGGTCATTTAG AGGAAGTAA-3′和 ITS2 5′-GCTGCGTTCTTCATCGATGC-3′),进行 Miseq 文库构建。然后,采用 Illumina Miseq PE300平台进行测序。测序委托上海美吉生物医药科技有限公司完成。

表1 试验1和2中高通量测序样本编号及处理信息Table 1 Information of samples selected from experiments 1 and 2 for sequencing of bacterial 16S rDNA and fungal ITS region
1.5 测序数据分析
对测序获得的原始数据(reads),采用FASTQ软件移除适配序列、引物序列以及低质量序列,利用FLASH软件对优化后成对序列进行拼接,拼接时overlap最小值设为10 bp,最大配错率设为20%[26]。拼接后先利用UPARSE软件去除嵌合体,得到OTU(Operational Taxonomic Units)代表序列[27,28];利用RDP classifier平台的Silva 16S rRNA数据库和UNITE数据库分别对细菌16S rDNA和真菌ITS2序列进行分类注释,其中比对最小阈值设为 0.7并去除与线粒体和叶绿体序列及无法与数据库匹配的序列;纯净后的OTUs序列利用UPARSE按照97%相似水平进行聚类划分[29];然后对16S rDNA和ITS2序列分别进行抽样分析,评价不同样本数的覆盖率并制作稀释曲线;分析OTU丰富度(sobs)、Shannon多样性指数以及处理对不同真菌和细菌群落相对丰度的影响;最后,对OTUs根据bray-curtis算法获得不同样本的距离矩阵,再对矩阵进行层级聚类,对不同样本的细菌群落和真菌群落分别进行PCoA分析(principal co-ordinates analysis),并将结果可视化展示。
2 结果与分析
2.1 不同因素对菌核存活的影响
少部分 15 ℃加水处理组中菌核在实验过程中萌发产生白色菌丝,但菌核基本保持完好充实(硬度较高)。与此相对照,高温加水条件处理一周后,菌核未见萌发产生菌丝或子囊盘,但其质地弹性和硬度降低,黑色表皮剥离露出淡黄色髓质,继续培养至第4周,部分菌核髓质被完全分解,剩下片状黑色表皮残骸。方差分析发现土壤类型以及其与其他因素的互作对菌核存活没有显著影响(试验1结果未展示),所以后续分析中不再考虑土壤类型差别,3个试验的结果都表明高温、高湿和低氧可加快菌核死亡。以试验3结果为例,灭菌土壤中各处理的菌核萌发率都高于未灭菌土壤的相应处理(灭菌土壤中数据未展示),说明土壤中的生物因素可能会影响菌核萌发率。对未灭菌土壤方差分析发现,风干土壤中,菌核萌发率显著高于加水土壤(P<0.05),不加水处理2周后菌核平均萌发率为69.08%,而加水各处理菌核平均萌发率为34.33%;在加水的土壤中,15 ℃处理的菌核萌发率(平均51.67%)与25 ℃处理(平均42.17%)差异不显著,但都显著(P<0.05)高于 35 ℃处理(0);因试验中抽真空后密封未能达到完全厌氧条件,仅实现了低氧,在加水土壤中低氧处理的菌核萌发率在15 ℃和25 ℃(49.33%和37.67%)都低于正常氧的相应值(54%和46.67%),但是差异未达到显著水平,部分原因可能是在低氧处理中重复之间波动比较大,低氧处理不稳定;在风干土壤中,菌核萌发率在4周内基本没有明显变化,但在加水土壤中菌核的萌发率都随时间推移而显著(P<0.05)下降,在高温条件下,这种下降速度更快;高温和水分之间的互作显著(P<0.05),高温有水低氧组合菌核萌发率下降最快,2周内下降到 0%(图1,第 4周数据未展示)。
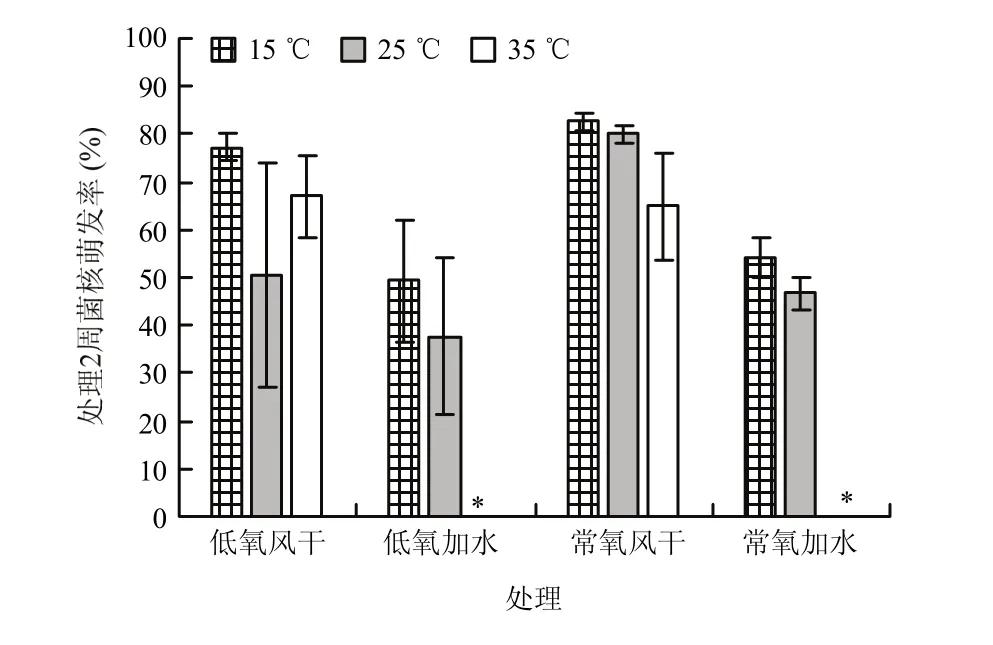
图1 不同条件下处理2周后不灭菌田间土壤中核盘菌菌核萌发率Fig. 1 Germination rate of S. sclerotiorum sclerotia after treatments under different conditions for 2 weeks in unautoclaved soil collected from rapeseed fields
2.2 测序结果及OTUs聚类分析
本研究3个试验得到的结果类似,重复测序的结果高度一致(2和3的结果未展示)。以试验1中16个样本结果为例,经对测序所得的reads进行质控过滤,获得有效的细菌16S rDNA序列碱基总数目为554704446 bp,序列平均长度为415 bp。有效的真菌ITS2序列总碱基数为348636327 bp,序列平均长度为239 bp。有效序列按97%相似水平聚类到6299个OTUs中。OTUs抽样分析得到的稀释曲线图(图2)表明,随着样本数量增加sobs指数开始时快速上升,但随后其上升速度随着抽样数量增加逐渐趋缓,并最终形成平台。这说明对样本微生物群落的检测比率接近饱和,本研究的测序量足够覆盖样本中的绝大部分物种。结果也显示,淤泥样本中细菌和真菌OUT数目都低于油菜土。

图2 油菜土和淤泥样品的细菌稀释曲线和真菌稀释曲线Fig. 2 Rarefaction curves of for bacteria and fungi in soils from rapeseed fields and a pond
细菌16S rDNA序列的多样性分析结果(表2)显示,第1周和第4周相比,正常氧气水平处理组的香农指数在15 ℃(5.63,4.38)和35 ℃(4.39,4.71)均有差异,但差异都不显著;而低氧处理的香农指数在15 ℃(3.17,4.47)和35 ℃(3.37,4.37)都显著升高(表2,t-检验箱线图未展示)。类似地,试验2样本测序结果也显示土壤含水量上升可增加细菌香农指数(数据未显示)。综合两个试验的结果表明,高温、低氧(含水)处理可增加土壤细菌多样性。

表2 不同处理油菜田土壤样本中细菌和真菌多样性(Shannon)指数Table 2 Bacterial and fungal alpha diversity index in moist soil samples after different treatments
真菌ITS2序列多样性分析显示,试验1中高温低氧条件下油菜土真菌群落的香农指数从第1周(4.20)到第 4周明显下降(1.49),其他处理的香农指数从第1到第4周变化不大(表2)。类似地淤泥样本中,高温和低氧处理中细菌多样性上升,但是真菌的多样性没有规律(表2)。试验 2结果也表明,加水土壤培育4周后25 ℃条件下的真菌香农指数低于 15 ℃(结果未显示)。综合两个试验结果表明,高温、低氧条件可降低土壤中真菌的多样性。
OTU聚类结果表明,低氧和正常氧处理的细菌群落分在2个不同类群中(图3A,试验2结果相似未显示)。PCoA分析显示,低氧和正常氧处理的细菌群落在第一维度上各自聚在一起,但第二维度上高温低氧的池塘淤泥细菌群落与其他低氧处理距离则较远(图4A)。

图3 基于OTUs序列的土壤样本(A-细菌, B-真菌)聚类分析结果Fig. 3 Cluster analysis based on OTUs sequences of soil bacteria (A) and fungi (B)

图4 基于OTUs序列的土壤样本本(A-细菌, B-真菌)PCoA分析结果Fig. 4 PCoA analysis based on OTUs sequences of bacteria (A) and fungi (B) in the rapeseed field and pond soil
真菌群落的聚类结果没有明显规律。4个高温正常氧样本(AB1和AB1-1、AB4和AB4-1)内部差别较小,但与其他样本差别较大,单独构成了一个分支(图3B)。PCoA分析显示,这4个样本距离很近,AA4-1和AA4,BB1和BA4, BA1-1、BB4、BB4-1、BB1-1和BA4-1距离非常近,其他样品则更加分散(图4B)。
2.3 不同微生物群落的相对丰度
土壤OTUs共检出18个门,包括细菌12个门、真菌6个门和一些未能分类的真菌。正常氧和低氧处理的细菌组成在门水平明显不同(图5)。低氧的4个处理中,厚壁菌门Firmicutes以71.81%-88.19 %的相对丰度都占据绝对优势;而在正常氧组中放线菌门(Actinobacteriota,22.87%~53.42%)和变形菌门Proteobacteria(21.95%~36.50%)丰度最高,正常氧15 ℃处理中拟杆菌门Bacteroidota也占有相对比重(图5)。油菜图样本和池塘淤泥样本间这些主要门所占比重虽有差别,但总体趋势相似(图5)。

图5 不同处理土壤样本中细菌物种(A-油菜土,B-池塘淤泥)门水平分布柱状图Fig. 5 Relative abundances of bacterial phylum categories in soil samples from rapeseed fields (A) and a pond (B)
在属水平,土壤样本中共检出68个属的细菌,其中狭义梭菌(Clostridiumsensu-stricto 1,10,11,12)是低氧处理下特有的属且占据较高丰度(图6);而 35 ℃正常氧处理 4周的样本中放线菌Streptomyces丰度(27.13%)明显高于其他样本(图6)。而淤泥样本中放线菌Streptomyces丰度在35 ℃正常氧处理中(7.12%~7,85%)也高于其他处理(0.1%~4.40%),但是因为总体占比较低并未排进前9大属(数据未展示)。

图6 不同处理土壤样本细菌物种(A-油菜土,B-池塘淤泥)属水平分布柱状图Fig. 6 Relative abundances of bacterial genera in soil samples in soil samples from rapeseed fields (A) and a pond (B)
在门水平,真菌中子囊菌门Ascomycota在所有样本中均有分布,且其相对丰度(57.27%~99.92%)在油菜土和池塘淤泥各处理样本中均占据绝对优势(图7)。需要注意的是,在池塘土(最高26.95%)中检出比油菜土中(最高15.04%)更多的无法分类真菌(unclassified fungi,图7B)。在属水平,各处理组共检出37个真菌属。其中相对丰度最高的属是篮状菌属Talaromyces,在高温正常氧气处理样品中相对丰度占比达到了62.18%~77.83%(图8);木霉属Trichoderma在正常氧15 ℃处理4周的油菜土(54.23%)和池塘土(91.17%)样本中相对丰度明显高于其他样本(图8)。值得注意的是低氧35 ℃下培养4周后核盘菌属Sclerotinia在油菜土中的相对丰度高达72.80%,显示此时已有大量菌核组织分解散布到土壤样本中(图8A),但比重在同样处理的池塘土中要低得多(图8B)。

图7 不同处理土壤样本真菌物种(A-油菜土,B-池塘淤泥)门水平分布柱状图Fig. 7 Relative abundances of fungal phylum categories in soil samples from rapeseed fields (A) and a pond (B)

图8 不同处理土壤样本真菌物种(A-油菜土,B-池塘淤泥)属水平分布柱状图Fig. 8 Relative abundances of fungal genera in soil samples from rapeseed fields (A) and a pond (B)
3 讨论
本研究发现高温、高湿和低氧水平,任一单因素处理均能够显著影响核盘菌菌核的萌发率,而在3个因素共同作用下,35 ℃低氧高湿条件下处理4周可造成菌核完全丧失活性。这一结果与汪国森等[30]得到的升高温度可以加快菌核死亡和Wu等[14]得到的低氧加速菌核死亡的研究结果相符合。水分是微生物活性所需,核盘菌菌核的两种萌发方式都需要一定的土壤湿度(低于饱和湿度)[14,31]。然而,这一结果表明如果高湿(饱和湿度常常伴随低氧)和高温条件配合,则核盘菌菌核不仅不能萌发产生菌丝或者子囊盘,其存活率还迅速下降。这个发现也解释了前人利用夏天水淹(高温、高湿、低氧)防治菌核病取得较好结果的原因[15,16]。农业生产中,两茬作物之间往往只有相对较短的休耕期,不足以种植一茬轮作作物。本研究的结果表明,利用这一间隔期创造高温、高湿和低氧条件可以在短时间内杀死土壤中的核盘菌菌核,从而实现防控菌核病的目标,尤其是如果这一间隔期发生在日光资源丰富的夏天时,高温条件更是为此提供了便利。
为探索高温、高湿、低氧条件下菌核快速死亡的原因,本研究通过对土壤中细菌16SrDNA和真菌ITS测序,分析了不同处理对细菌和真菌种群组成和丰度的影响。此前链霉菌属和木霉属在菌核病的生物防治中受到广泛关注,链霉菌属广泛存在于土壤中,其产生的代谢产物对包括核盘菌在内的多种植物病原真菌表现出很强的抗真菌活性[32],木霉属具有较强的几丁质分解能力,可寄生核盘菌菌丝和菌核促进菌核死亡[33]。但本研究结果表明,链霉菌和木霉菌都只适合有氧环境,在低氧条件下他们的丰度都大幅降低。这就基本确定不是高温、高湿、低氧条件下核盘菌菌核快速死亡的直接原因。本研究明确了高温低氧高湿处理使得细菌多样性水平上升,更具体地,高温低氧(高湿)处理可显著提高狭义梭菌的相对丰度,这类细菌几乎只在低氧处理土壤中才检测到,而且不同来源土壤中的结果相同,这暗指这类细菌在自然界中非常普遍。核盘菌菌核的快速死亡是否与这一类细菌相关,以及如何利用它们更好地防控菌核病还有待进一步研究明确。除此之外,我们在高温低氧处理油菜土样本中还检测到大量的核盘菌 DNA,这表明要么菌核在此条件下萌发产生了菌丝(因试验中未观察到白色丝状物,所以基本可以否定这一可能),要么菌核结构崩溃(自身或者其他微生物造成),菌核残渣散落到了周围土壤中。因此,后续研究也有必要进一步明确高温、低氧(高湿)处理对核盘菌菌核本身生理生化过程的影响。
综上所述,本研究明确了高温高湿低氧处理可以在短时间内杀死核盘菌菌核,初步明确了高温、高湿、低氧条件下狭义梭菌相对丰度上升最为明显,这为进一步明确其机制更好地利用这一现象防控作物菌核病打下了基础。
