外源表油菜素内酯和过氧化氢对低温处理后湘烟7号幼苗生理特性的影响
2022-09-15范敏向世鹏许金亮沈子奇张芸萍谢鹏飞李强
范敏,向世鹏,许金亮,沈子奇,张芸萍,谢鹏飞,李强*
外源表油菜素内酯和过氧化氢对低温处理后湘烟7号幼苗生理特性的影响
范敏1,向世鹏2,许金亮1,沈子奇1,张芸萍1,谢鹏飞2,李强1*
(1.湖南农业大学农学院,湖南 长沙 410128;2.湖南省烟草公司长沙市公司,湖南 长沙 410021)
以烤烟品种湘烟7号为材料,经4 ℃处理4 d后连续喷施0.01 mg/L表油菜素内酯( EBR、T1)和340 mg/L过氧化氢(H2O2、T2)4 d, 以进行低温处理后喷施蒸馏水的烟苗为低温处理对照(CK1),以未经低温处理喷施蒸馏水的烟苗为正常生长对照(CK2),测定烟草幼苗生物量、抗氧化酶(SOD、POD、CAT)活性、MDA含量、渗透调节物质及根系活力。结果表明:与CK2相比,湘烟7号烟苗经4 ℃低温处理后,根系活力及生物量降低,CAT活性、MDA、可溶性糖及脯氨酸含量升高,SOD、POD活性及可溶性蛋白含量无显著变化;与CK1相比,喷施EBR和H2O2的烟苗根系活力、根冠比、保护酶活性均明显提高,干物质量分别提高40%、20%,可溶性糖分别增加66.3%、51.3%,MDA含量分别降低37.8%、37.5%;低温处理后转入常温的第8天和第12天,喷施EBR、H2O2的处理与CK2相比,SOD活性、POD活性、可溶性糖、脯氨酸含量无显著差异,可溶性蛋白含量显著降低。恢复正常生长温度后,喷施外源EBR和H2O2均能加速烟苗生理指标恢复正常,其中以喷施EBR的效果更好。
湘烟7号;低温胁迫;表油菜素内酯;过氧化氢;幼苗生理特性
烟草有喜温、冷敏的特点。低温是造成烟株早花的主要原因,而早花是影响烟株品质的主要因素[1]。研究发现,当烟株遭遇低温胁迫时,首先会影响烟株的光合速率和呼吸作用,减少水分和养分的吸收利用率,抑制叶片生长发育,同时叶绿体超微结构受损,不利于光合作用积累有机物,植株生长发育迟缓[2–4]。此外,低温胁迫易造成植株体内抗氧化酶活性与渗透调节物质积累紊乱[5],导致烟草体内活性氧代谢平衡状态被破坏,抑制营养生长,加速生殖生长,开花期提前,产量降低,同时影响多酚代谢,引起烟叶褐变,降低烤烟质量,经济效益大幅度下降[6–7]。
为缓解低温对烟苗的危害,提高烟草经济效益,通过施用外源物质(如亚精胺、壳寡糖、甜菜碱、水杨酸等)可减轻低温胁迫对烟草的危害[8–10]。寇江涛[11]研究发现,表油菜素内酯不仅能够调控植物正常生长发育,还能提高植物对低温、干旱、重金属等胁迫的抗性。马法令等[12]研究发现,喷施外源表油菜素内酯(EBR)能减轻低温对细胞膜的损伤,提高长鞭红景天幼苗低温胁迫耐受性。传统观念认为,过氧化氢(H2O2)是对植物体有毒害作用的代谢物。但有研究[13]表明,低浓度的H2O2能作为局部和系统信号起作用,增强植物对各种生物和非生物胁迫的耐受性,且参与调控植物体内多种生理代谢和基因表达。近年来,H2O2在植物抗逆性中的作用受到关注,研究[14]表明,适宜浓度的外源过氧化氢处理不仅不会造成植物氧化伤害,反而能够通过提高植物自身抗氧化物酶活性,减少活性氧对植物的毒害作用,从而有效提高植物的抗逆性。
湘烟7号是湖南省烟草科学研究所选育的烟草新品种,其采烤叶数较多,上等烟比例、中等烟比例和中上等烟比例都较高,化学品质较好,抗病能力强,是重要的烤烟后备品种[15–16],在湖南省各烟区广泛种植。由于南方地区早春时期普遍存在因气温波动较大而出现“倒春寒”等低温伤害,不利于壮苗培育,导致幼苗成活率降低,缓苗期延长,烟叶产量和质量受到影响[17],笔者以湘烟7号为试验材料,用人工气候箱模拟低温环境,研究经历低温处理后,喷施外源表油菜素内酯(EBR)和过氧化氢(H2O2)对烟草幼苗恢复生长的作用,旨在为生产上利用外源EBR和H2O2加快烤烟幼苗经低温胁迫后恢复生长进程提供依据。
1 材料与方法
1.1 材料
烤烟品种湘烟7号,取自湖南省烟草种质资源管理库。0.01 mg/L表油菜素内酯(EBR)、340 mg/L过氧化氢购于上海易恩化学技术有限公司。
1.2 试验设计
取饱满度基本一致的湘烟7号种子,于50 ℃温水浸泡10 min,75%乙醇消毒30 s、10%的NaClO再消毒10 min后,播种于用1/4霍格兰(Hoagland)营养液完全浸湿的脱脂棉培养皿上,每皿点50~60粒,置于28 ℃人工气候箱中避光催芽4 d,取萌动一致的烤烟种子播种于育苗盘,每盆播种24株,光照14 h,昼夜温度分别为28 ℃和18 ℃,相对湿度75%,光照度为7000 lx。待烟苗长至7叶1心时,低温(4 ℃)处理4 d,后转置正常温度(昼夜温度分别为28 ℃、18 ℃)生长,分别喷施0.01 mg/L EBR(T1)和340 mg/L H2O2(T2)4 d,喷施时间为9:00和14:00,以进行低温处理后喷施蒸馏水的烟苗为低温胁迫对照(CK1),以未经低温处理喷施蒸馏水的烟苗为正常生长对照(CK2)。每个处理重复3次,每次重复种植8株。
1.3 测定项目及方法
1) 至烟苗生长第20天时,称量烟苗的鲜质量;烟苗于105 ℃烘箱杀青40 min,于80 ℃中烘干至恒重后称重,计算根冠比(根干质量/地上部干质量)。
2) 在低温处理4 d、恢复生长后第4、8、12天,选取自上而下第2、3片真叶,依据文献[18],测定烟苗超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性以及丙二醛含量。
3) 在低温处理4 d、恢复生长后第4、8、12 天,选取自上而下第2、3片真叶,依据文献[19],测定烟苗可溶性糖、可溶性蛋白含量。用南京建成生物工程所试剂盒检测游离脯氨酸含量。
4) 在低温处理4 天、恢复生长第4、8 天,称取幼苗根系0.5 g,采用TTC法[19]测定根系活力。
1.4 数据处理
采用SPSS 21.0和Excel 2010进行数据处理和绘图;平均数用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 外源EBR和H2O2对湘烟7号幼苗抗氧化物酶活性及MDA含量的影响
由表1可知,低温处理4 d,各处理中SOD活性与CK2相比无显著差异,说明低温处理对湘烟7 号烟苗SOD活性无显著影响。解除低温处理后喷施EBR、H2O2,恢复生长期间SOD活性显著上升。恢复生长4 d时,T1与T2的SOD活性最高,二者间无显著差异,且都显著高于CK1、CK2,分别比CK1高19.9%、16.7%,分别比CK2高48.99%、44.95%;恢复生长8 d时,T1、T2与CK2之间无显著差异,但都显著高于CK1;恢复生长12 d时,T1、T2与CK2之间无显著差异,且T1显著高于T2,表明喷施EBR、H2O2能显著提高低温处理后烟苗SOD活性,减轻低温对烟苗生长的危害。在恢复生长8、12 d时,T1、T2与CK2相比无明显差异,说明喷施EBR、H2O2能协助烟苗中SOD活性恢复正常。

表1 外源喷施EBR和H2O2经低温处理后的湘烟7号幼苗抗氧化酶活性及MDA含量

处理MDA含量/(μmol·g–1 )CAT活性(U·min–1·g–1) 低温4 d恢复生长4 d恢复生长8 d恢复生长12 d低温4 d恢复生长4 d恢复生长8 d恢复生长12 d T10.032±0.004 5(0.015±0.003 7)b(0.017±0.003 7)b(0.023±0.006 1)c(4.38±1.25)ab(15.41±1.53)a(10.82±0.99)ab(10.15±1.01)b T20.033±0.004 9(0.015±0.003 8)b(0.017±0.003 4)b(0.032±0.006 3)b(6.57±1.12)a(13.70±1.58)b(9.48±0.96)ab(10.96±1.06)ab CK10.031±0.004 6(0.024±0.003 4)a(0.026±0.003 8)a(0.037±0.006 6)a(4.82±1.26)ab(12.59±1.49)bc(9.18±0.89)b(9.20±0.99)b CK20.024±0.004 8(0.020±0.003 7)b(0.014±0.003 6)b(0.024±0.006 8)c(3.05±1.21)b(11.20±1.51)c(11.54±1.93)a(11.95±1.09)a
同列不同小写字母表示处理间的差异有统计学意义(<0.05)。
低温处理4 d,处理间POD活性无显著差异,说明低温对湘烟7号烟苗POD活性影响不大。恢复生长4 d时,T1处理POD活性最高,其次是T2处理,两者差异未达显著水平,但都显著高于CK1、CK2;在恢复生长8 d和12 d时,T2处理POD活性最高,T1处理次之,但两处理间无显著差异,在恢复8 d时,T1、T2处理的POD活性显著高于CK2的;在恢复生长12 d时,T1、T2处理的POD活性虽高于CK2的,但未达显著水平。综合分析表明喷施EBR、H2O2对提高低温胁迫下烟苗POD活性效果显著。
低温处理4 d,3个低温处理与CK2相比,CAT活性显著升高,说明低温胁迫使得湘烟7号CAT活性升高。恢复生长4 d时,CAT活性最高的为T1,其次为T2,都显著高于CK2的,分别高37.5%、22.3%;恢复生长8 d时,CK2的CAT活性最高,但与T1、T2处理之间无显著差异;恢复生长第12天,CK2CAT活性显著高于T1的,但与T2的差异不显著。可以看出喷施EBR及H2O2在恢复生长初期能显著提高CAT活性,后期喷施H2O2处理的效果更好。
低温处理4 d,湘烟7号烟苗MDA含量迅速升高,低温的3个处理均显著高于CK2的,说明湘烟7号烟苗经低温后对MDA含量影响较大。在恢复生长4、8 d时,T1、T2的烟苗MDA含量下降,显著低于CK1的,与CK2的差异不显著;在恢复生长12 d时,T1的MDA含量显著低于CK2的,T2的MDA含量却显著高于CK2的。说明喷施EBR及H2O2能降低烟苗MDA含量,且喷施EBR的效果更优。
2.2 外源EBR和H2O2对湘烟7号幼苗低温处理后恢复生长过程中渗透调节物质的影响
由表2可以看出,低温胁迫显著提高了叶片可溶性糖含量。解除胁迫并喷施外源EBR、H2O2后,可溶性糖含量迅速下降,随恢复时间延长,可溶性糖含量增加。解除低温胁迫4、8 d时,T1的可溶性糖含量与CK2的无显著差异,T2的含量显著低于CK2的;恢复生长12 d,T1、T2的可溶性糖含量略低于CK2的,但无显著差异。恢复生长后,喷施外源物质处理间比较,T1的高于T2和CK1的,说明喷施EBR和H2O2有助于提高可溶性糖含量,且喷施EBR的效果更优。
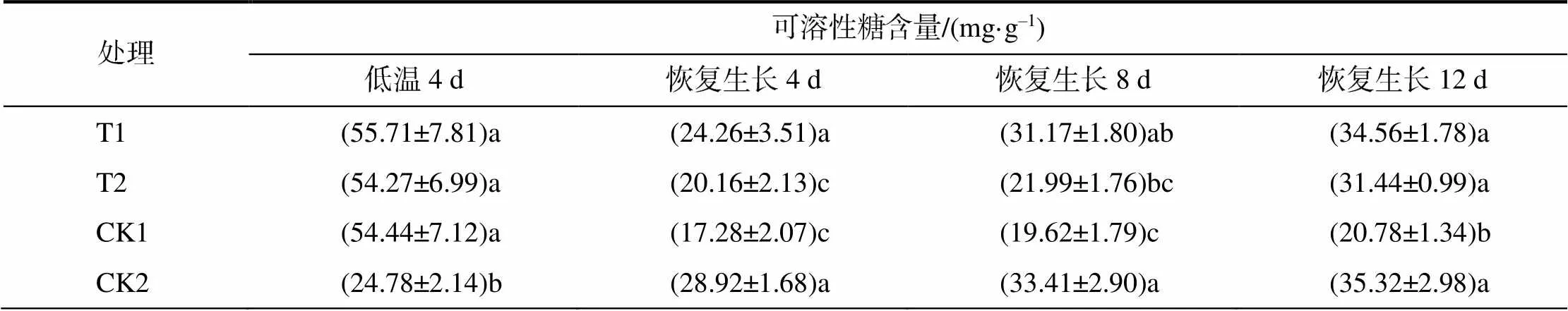
表2 外源喷施EBR和H2O2经低温处理后的湘烟7号幼苗渗透调节物质的含量
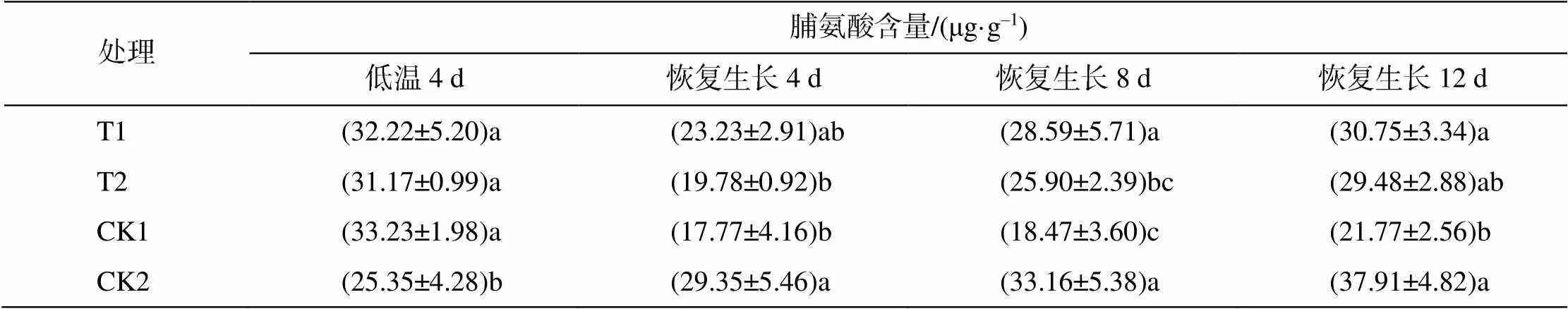
处理脯氨酸含量/(μg·g–1) 低温4 d恢复生长4 d恢复生长8 d恢复生长12 d T1(32.22±5.20)a(23.23±2.91)ab(28.59±5.71)a(30.75±3.34)a T2(31.17±0.99)a(19.78±0.92)b(25.90±2.39)bc(29.48±2.88)ab CK1(33.23±1.98)a(17.77±4.16)b(18.47±3.60)c(21.77±2.56)b CK2(25.35±4.28)b(29.35±5.46)a(33.16±5.38)a(37.91±4.82)a
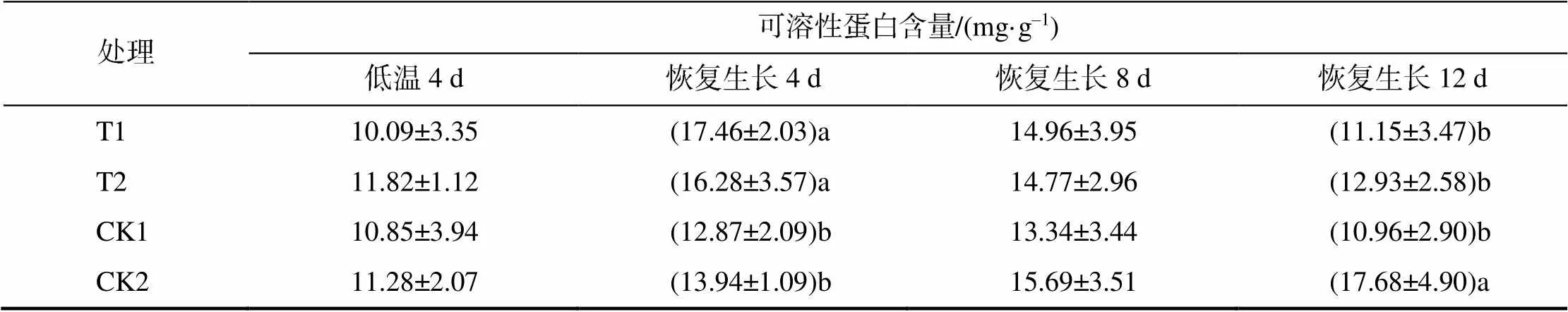
处理可溶性蛋白含量/(mg·g–1) 低温4 d恢复生长4 d恢复生长8 d恢复生长12 d T110.09±3.35(17.46±2.03)a14.96±3.95(11.15±3.47)b T211.82±1.12(16.28±3.57)a14.77±2.96(12.93±2.58)b CK110.85±3.94(12.87±2.09)b13.34±3.44(10.96±2.90)b CK211.28±2.07(13.94±1.09)b15.69±3.51(17.68±4.90)a
同行不同小写字母表示处理间的差异有统计学意义(<0.05)。
低温处理使烟苗体内脯氨酸含量显著上升。解除胁迫并喷施外源EBR、H2O24、8 d时,T1与CK2间无显著差异,T2、CK1均显著低于CK2;恢复生长第12天,T1、T2和CK2间均无显著差异,说明喷施EBR和H2O2可以提高湘烟7号烟苗体内脯氨酸含量,喷施EBR的效果好于H2O2。
可溶性蛋白含量与可溶性糖和脯氨酸含量的变化趋势存在差异。在低温4 d时,湘烟7号烟苗处理间可溶性蛋白含量无显著差异。在恢复生长4 d时,T1的可溶性蛋白含量最高,T2的次之,T1、T2与CK2相比,可溶性蛋白含量分别升高了25.3%、16.8%,均与CK2的差异显著;恢复生长第8天,处理间的差异未达显著水平;恢复生长12 d时,CK2的显著高于其他处理的。
2.3 外源EBR和H2O2对湘烟7号幼苗低温处理后恢复生长过程中根系活力的影响
低温处理抑制烟苗根系生长,降低根系活力;低温解除后,烟苗根系活力逐渐恢复。表3结果表明,在恢复生长期,湘烟7号烟苗在恢复生长4 d时CK2根系活力最高,T1与CK2间无显著差异,但T2、CK1与CK2间的差异达显著水平;在恢复生长8 d时,T1和T2根系活力均显著高于CK1、CK2,T1和T2与CK2相比,根系活力分别增加13.95%、6.44%;与CK1相比,根系活力分别增加20.28%和12.36%。说明恢复生长期喷施外源EBR与H2O2对根系活力的恢复具有促进作用,有利于烟苗对营养物质的吸收,加快湘烟7号幼苗恢复进程。

表3 外源喷施EBR和H2O2经低温处理后的湘烟7号幼苗的根系活力
同列不同小写字母表示处理间的差异有统计学意义(<0.05)。
2.4 外源EBR和H2O2对湘烟7号幼苗低温处理后恢复生长过程中生物量的影响
低温胁迫后湘烟7号幼苗的生物量显著降低(表4)。T1、T2与CK2相比,烟株地上部鲜质量分别降低21.93 %、37.7 %,干质量分别降低24.36%、42.62%;根部鲜质量分别降低19.55%、41.67%,根干质量分别降低37.59%、50%,根冠比分别降低10 %和 15%;与CK2相比,CK1地上部鲜质量、干质量分别降低28.57%、44.26%,根部鲜质量、干质量分别降低42.86%、58.33%,根冠比降低30%。喷施EBR、H2O2虽减小了与CK2间的生物量差距,但不能使烟株恢复正常生长。
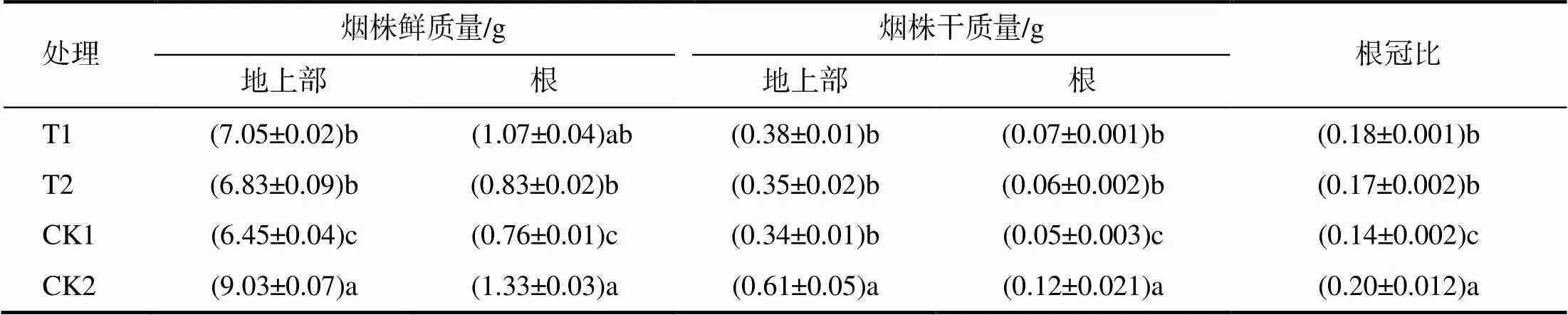
表4 外源喷施EBR和H2O2经低温处理后的湘烟7号幼苗的生物量
同列不同小写字母表示处理间的差异有统计学意义(<0.05)。
3 结论与讨论
烟苗对低温处理的响应主要表现在抗氧化酶活性、生物膜系统、渗透调节物质等方面发生变化。烟草在低温胁迫条件下其生长受到抑制,降低烟草根系活力,影响矿物质和水分等营养元素吸收,抑制烟苗根系生长,进而影响烟株干物质量的积累[20–21]。本试验中,低温处理的湘烟7号烟苗地上和根部的干质量及鲜质量显著低于未经低温处理的正常对照CK2。随着低温处理时间的延长,烟株体内会积累过量的活性氧,导致细胞内物质失衡,加剧膜脂过氧化[22],低温处理对湘烟7号烟苗SOD、POD活性无显著影响,可能是因为湘烟7号含有较高水平的脯氨酸,可以提供大量的还原剂,从而有助于能量的产生,有利于植物从逆境中恢复,减少逆境造成的损害[16,23];也可能与SOD、POD活性同时受NADP+的供给过程有关[24]。本研究中,低温胁迫显著增加了湘烟7号烟苗体内可溶性糖和脯氨酸含量,这与尹航[25]的研究结果一致,但在后期恢复生长过程中渗透调节物质含量却呈先下降后又缓慢上升趋势,可能是低温导致烟苗呼吸作用加强,可溶性糖迅速分解,脯氨酸参与活性氧消除过程,其含量下降;细胞内不饱和脂肪酸和磷脂含量有所增加,细胞膜的流动性增强,抗寒性增强[26–27],渗透调节物质缓慢上升。湘烟7号幼苗经低温胁迫后的MDA含量显著升高,后呈先降低又缓慢上升趋势,这与崔洁冰等[28]的研究结果一致。
本研究结果表明,湘烟7号烟苗经低温胁迫后喷施EBR,其抗氧化酶活性升高,MDA含量降低,生物量增加,这与前人[29]研究结果一致。低浓度的H2O2是植物应答多种逆境响应的信号分子,它能够增强植物对逆境的适应能力[14]。本研究发现,湘烟7号烟苗经低温胁迫后喷施外源H2O2能缓解低温对烟苗的抑制作用,同喷施EBR的一致,均表现为促进作用。恢复生长后期,喷施EBR后CAT活性显著低于未经低温胁迫处理CK2,可能与CAT活性受光照、温度和外界环境影响有关[30]。植物体内可溶性蛋白、脯氨酸及可溶性糖等对提高植物抗性具有重要作用,从脯氨酸和可溶性糖含量中可以看出,喷施EBR处理的效果好于其他处理,可能是烟苗在低温胁迫后恢复期其耐冷性与脯氨酸和可溶性糖的积累有相关性[31]。但在恢复生长后期,喷施EBR、H2O2处理可溶性蛋白含量显著低于未经低温胁迫的处理CK2,这可能是因为低温胁迫造成质膜损伤,细胞结构遭到破坏[4],解除低温胁迫后不能及时修复。
综上所述,低温处理后喷施外源EBR和H2O2能够较好地协助烟苗各项指标趋于正常。从渗透调节物质、抗氧化酶活性及MDA含量看出,喷施0.01 mg/L EBR比喷施340 mg/L H2O2对湘烟7号烟苗低温处理后的恢复效应更好。
[1] 李琦瑶.低温调控烤烟幼苗叶片生长发育的生理机制研究[D].北京:中国农业科学院,2019.
[2] 李琦瑶,王树声,周培禄,等.低温胁迫对烟苗叶形及生理特性的影响[J].中国烟草科学,2018,39(1):17–23.
[3] 李晓靖,崔海军.低温胁迫下植物光合生理研究进展[J].山东林业科技,2018,48(6):90–94.
[4] 李琦瑶,陈爱国,王程栋,等.低温胁迫对烤烟幼苗光合荧光特性及叶片结构的影响[J].中国烟草学报,2018,24(2):30–38.
[5] 黄伟超,范宇博,王泳超.低温胁迫对玉米幼苗抗氧化系统及渗透调节物质的影响[J].中国农学通报,2018,34(24):6–12.
[6] 韩瑶瑶,马燕勤,李典珍,等.拟南芥Pri–miR156a基因对烟草开花时间的影响[J].基因组学与应用生物学,2015,34(2):350–356.
[7] 张静,李园园,黄盈盈,等.低温胁迫下活性氧代谢与烟草花芽分化的研究[J].作物杂志,2015,167(4):74–80.
[8] 张嘉雯,卢绍浩,赵喆,等.外源褪黑素对低温胁迫下烟草幼苗生理指标的影响[J].中国农业科技导报,2020,22(9):78–86.
[9] 顾开元,侯爽,陈锦芬,等.外源甜菜碱对低温胁迫下烟草幼苗生理特性的影响[J].云南农业大学学报(自然科学),2021,36(2):283–290.
[10] 陈芊如,丁蓬勃,胡希好,等.外源壳寡糖对低温胁迫条件下烟草幼苗的保护作用[J].江苏农业科学,2022,50(1):80–85.
[11] 寇江涛.外源2,4–表油菜素内酯对盐胁迫下燕麦种子萌发抑制的缓解效应[J].草业科学,2020,37(5):916–925.
[12] 马令法,何淑玲,李瑛萍,等.外源油菜素内酯对栽培长鞭红景天幼苗耐低温能力的影响[J].北方园艺,2016,373(22):160–165.
[13] IRENEUSZ S,MARTA L,BARBARA K,et al.The role of hydrogen peroxide in regulation of plant metabolism and cellular signalling in response to environmental stresses[J].Acta Biochimica Polonica,2007,54(1):39–50.
[14] NETO ADDA,PRISCO J T,ENÉAS-FILHO J,et al. Hydrogen peroxide pre-treatment induces salt-stress acclimation in maize plants[J].Journal of Plant Physiology,2005,162(10):1114–1122.
[15] 罗维斌,单雪华,黄银章,等.烤烟新品种HN2146的生产应用评价及其适宜施氮量研究[J].安徽农业科学,2019,47(18):27–31.
[16] 李云霞,李思军,刘跃荣,等.烤烟新品系HN2146在湘南烟区的高产栽培技术研究[J].湖南农业科学,2021(6):12–15.
[17] 郭汉华,易建华,孙在军.低温胁迫对烟苗光合作用的后续影响[J].烟草科技,2004(4):31–33.
[18] 邹琦.植物生理生化实验指导[M].北京:中国农业出版社,2004.
[19] 郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社,2007.
[20] 徐晓昀,郁继华,颉建明,等.2,4–表油菜素内酯对亚适温弱光下黄瓜幼苗光合特性和抗氧化系统的影响[J].核农学报,2017,31(5):979–986.
[21] 沈少君,郭学清,郑玉木,等.低温胁迫对烤烟生长和产质量的影响[J].中国烟草科学,2010,31(6):35–37.
[22] 苏亮,朴世领,崔元浩,等.早花发生条件下3种烤烟品种生理生化变化规律研究[J].延边大学农学学报,2013,35(1):37–42.
[23] 梁太波,张景玲,田雷,等.干旱胁迫下外源甜菜碱和脯氨酸对烤烟抗氧化代谢的影响[J].烟草科技,2013(2):68–71.
[24] 何雨沩.低温胁迫下草莓NADPH氧化酶在ROS形成中的作用[D].雅安:四川农业大学,2015.
[25] 尹航.不同烟草品种苗期对低温胁迫的若干生理响应及耐寒性综合评价[D].延吉:延边大学,2018.
[26] CYRIL J,POWELL G L,DUNCAN R R,et al.Changes in membrane polar lipid fatty acids of seashore paspalum in response to low temperature exposure[J].Crop Science,2002,42(6):2031–2037.
[27] 葛体达,隋方功,白莉萍,等.水分胁迫下夏玉米根叶保护酶活性变化及其对膜脂过氧化作用的影响[J].中国农业科学,2005(5):922–928.
[28] 崔洁冰,张萌,张莹婷,等.低温胁迫对柳杉不同无性系的影响及抗寒性评价[J].生物技术通报,2022,38(3):31–40.
[29] 张小贝,祝志欣,南文卓,等.2,4–表油菜素内酯(EBR)对菜用甘薯抗寒生理生化的影响[J].安徽农业大学学报,2017,44(3):525–529.
[30] MCCLUNG C,MCCLUNG C.Regulation of catalases in[J].Free Radical Biology and Medicine,1997,23(3):489–496.
[31] 王以斌,缪锦来,姜英辉,等.脯氨酸和可溶性糖在南极冰藻低温适应机制中的作用[J].生物技术通报,2016,32(2):198–202.
Effects of exogenous epibrassinolide and hydrogen peroxide on physiological characteristics of Xiangyan7 seedlings after low temperature treatment
FAN Min1,XIANG Shipeng2,XU Jinliang1,SHEN Ziqi1,ZHANG Yunping1,XIE Pengfei2,LI Qiang1*
(1.College of Agronomy, Hunan Agricultural University, Changsha, Hunan 410128, China; 2.Changsha Tobacco Company of Hunan Province, Changsha, Hunan 410021, China)
Flue-curedtobacco cultivar Xiangyan7 was used as the test material. Four treatments were set up: T1, treated at 4 ℃ for 4 d, followed by continuously spraying of 0.01 mg/L EBR for 4 d; T2, treated at 4 ℃ for 4 d, followed by continuously spraying of 340 mg/L H2O2for 4 d; CK1, treated with low temperature(4 ℃) for 4 d, followed by continuously spraying distilled water for 4 d; CK2, continuously spraying distilled water for 4 days without low temperature treatment. Biomass, antioxidant enzyme(SOD, POD, CAT) activity, MDA content, osmotic regulatory substances and root activity of tobacco seedlings were measured. The results showed that compared to CK2(normal growth control), root activity and biomass of Xiangyan7 seedlings under 4 ℃ low temperature stress were decreased; while CAT activity, MDA content, soluble sugar and proline content were increased and SOD activity, POD activity and soluble protein content had no significant change. Compared to CK1(low temperature treatment), the root activity, root shoot ratio and protective enzyme activity of tobacco seedlings sprayed with EBR and H2O2after low temperature stress was relieved, were significantly increased; and dry matter quality in T1(with EBR) and T2(with H2O2) increased by 40% and 20% respectively; soluble sugar in T1(with EBR) and T2(with H2O2) increased by 66.3% and 51.3%, respectively; MDA content in T1(with EBR) and T2(with H2O2) decreased by 37.8% and 37.5%, respectively. On the 8th and 12th day after low temperature treatment, SOD, POD, soluble sugar and proline showed no significant difference while soluble protein decreased significantly in EBR and H2O2treatment, compared with normal growth treatment(CK2). Conclusion: after the normal growth temperature was restored, spraying exogenous EBR and H2O2could accelerate the recovery of the physiological indexes of tobacco seedlings to a certain extent, and EBR showed better effect.
Xiangyan7; low temperature stress; epibrassinolide; hydrogen peroxide; seedling physiological characteristics
S572.01
A
1007-1032(2022)04-0401-06
范敏,向世鹏,许金亮,沈子奇,张芸萍,谢鹏飞,李强.外源表油菜素内酯和过氧化氢对低温处理后湘烟7号幼苗生理特性的影响[J].湖南农业大学学报(自然科学版),2022,48(4):401–406.
FAN M,XIANG S P,XU J L,SHEN Z Q,ZHANG Y P,XIE P F,LI Q.Effects of exogenous epibrassinolide and hydrogen peroxide on physiological characteristics of Xiangyan7 seedlings after low temperature treatment[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(4):401–406.
http://xb.hunau.edu.cn

2021–12–19
2022–04–08
湖南省烟草公司长沙市公司项目(20–24A01)
范敏(1997—),女,云南曲靖人,硕士研究生,主要从事烟草栽培生理研究,fanmin9702@163.com;*通信作者,李强,博士,副教授,主要从事烟草科学与工程技术和农业可持续发展研究,zqiangli@126.com
责任编辑:罗慧敏
英文编辑:罗维
