低氮条件下油菜根系伸长与细胞壁组分的变化
2022-09-15田辉宋海星吴秀文张振华
田辉,宋海星,吴秀文,2,张振华*
低氮条件下油菜根系伸长与细胞壁组分的变化
田辉1,宋海星1,吴秀文1,2,张振华1*
(1.湖南农业大学资源环境学院,湖南 长沙 410128;2.青岛农业大学资源与环境学院,山东 青岛 266108)
以甘蓝型油菜‘中双11’为材料,设置低氮LN(0.3 mmol/L NO3–)和高氮HN(6.0 mmol/L NO3–)水平,通过营养液培养试验,探究低氮对油菜根尖细胞伸长分裂过程和细胞壁组分的影响。试验结果表明:低氮处理诱导了油菜根系的伸长,根表面积和根体积的增加, 根冠比和氮生理利用效率均显著高于高氮处理;低氮处理提高了油菜根尖伸长区细胞分裂素含量及成熟区生长素的含量,诱导了伸长区细胞分裂和成熟区细胞伸长;对细胞壁主要组分(果胶、纤维素、半纤维素和木质素)进行定量分析,发现低氮处理显著提高了油菜根系细胞壁中果胶和纤维素的含量,但不同氮水平处理的油菜根细胞壁中半纤维素、木质素含量无显著差异;转录组分析结果表明,果胶含量的增加主要是由于低氮抑制了果胶降解酶相关基因的表达,而纤维素含量的提高主要是因为纤维素合成的增加和降解的减少,同时低氮胁迫下膨胀素相关基因的表达上调也说明低氮促进了细胞壁的松弛,有利于细胞的膨大和分裂。
油菜;低氮;根;细胞壁;转录组学
氮被称为“生命元素”,是植物生长发育所必需的大量营养元素,参与了植物体内许多重要的生理代谢过程,在植物的生命活动中占有重要地位[1]。施用氮肥促进了农业增产,但给环境保护带来了诸多问题。过量施用氮肥极易造成土壤酸化板结和水体富营养化,同时引起作物徒长,加重作物病虫害和倒伏的发生,降低籽粒产量和品质[2]。
油菜是中国重要的油料作物之一,中国油菜种植面积和总产量均居世界前列,而湖南省的油菜种植面积又居国内首位[3]。土壤氮素缺乏是南方水旱轮作区冬油菜生产的重要限制因子[4]。油菜生长过程中对氮肥有较大需求量,但油菜对氮肥的利用效率偏低[5–6]。在氮素胁迫下,植物根系非常敏感,能够通过自身调节作出适应性反应,如根冠比明显升高[7–9]、总根长和根表面积增加等[10]。早在2011年就有学者研究了油菜在不同施氮水平下的根系形态与生理特性差异[11]。夏敏等[12]研究认为,根系的伸长主要取决于根细胞的分裂和伸长,细胞壁的生物合成参与细胞分裂、伸长和分化过程。但目前关于低氮影响油菜根系细胞壁结构和组分的研究尚少,低氮对根细胞壁的影响以及如何调控根细胞的伸长和分裂过程,进而引起根系构型改变的机理还不十分清楚。
本研究以湖南地区广泛种植的甘蓝型油菜为研究对象,探究低氮对根尖细胞伸长和分裂过程的影响,并通过分析细胞壁组分含量,综合转录组学分析结果,探索低氮调控细胞壁结构和组分、诱导根系伸长的内在机理,旨在为选育氮高效油菜品种,实现化肥“零增长”提供理论依据。
1 材料与方法
1.1 试验设计
本试验所用油菜品种为‘中双11’。采用营养液培养方式,在油菜专用光照培养室进行培养(温度22~24 ºC、14 h光照/10 h黑暗、光照度为20 000~30 000 lx、相对湿度为60%~75%)。营养液采用Hoagland和Arnon配方。设置低氮处理(LN),0.3 mmol/L NO3–;高氮处理(HN),6.0 mmol/L NO3–。每个处理设置6个生物学重复,每5 d 更换1次营养液。在正常营养液中培养10 d后,挑选长势一致的油菜植株移栽到遮光培养盘中,用不同氮浓度的营养液处理10 d后取样。
1.2 测定项目及方法
根系参数的测定:利用根系扫描分析系统(WinRHIZO 2009)分析不同氮处理根系参数差异;利用光学显微镜观察根尖伸长区和分生区长度,并利用共聚焦显微镜观察根尖各分区细胞数和长度。
植株干物质量的测定:分别取根和叶片,105 ℃杀青30 min,75 ℃烘干3 d后称取干质量。
植株全氮含量的测定:样品经粉碎混匀后,取0.1 g左右于三角瓶中,加5 mL浓硫酸后置于电热板上进行消煮,待样品消煮至无明显颗粒物时取下,稍冷后加入适量双氧水,待样品消煮至透明无杂质后即转移至50 mL容量瓶,干过滤后用蒸馏水稀释,采用AA3流动分析仪(Autoanalyzer 3,SEAL,德国)测定全氮含量。
根系细胞分裂素和生长素含量的测定:不同分区根系鲜样加80%预冷甲醇,置弱光下冰浴研磨至匀浆,于4 ℃过夜后10 000冷冻离心15 min,取上清液过 Sep–Pak Plus Cl8柱,真空干燥后溶解,采用酶联免疫(ELISA)法测定根系细胞分裂素和生长素的含量。
细胞壁各组分含量的测定:提取根细胞壁,分离细胞壁主要化学组分(果胶、纤维素、半纤维素和木质素)[13],用对应的试剂盒测定果胶、纤维素、半纤维素和木质素含量。
转录组测序:取低氮和高氮处理油菜距根尖 5 cm的根系,运用 Illumina Hiseq4000 测序平台进行 mRNA 测序,基于转录组测序获得的基因表达量结果,重点研究与细胞壁结构和物质合成分解相关的基因。
1.3 数据分析
采用SAS 9.1.3进行统计分析;采用基于Tukey法的ANOVA分析测定2个不同氮处理根分生区和成熟区内源激素间的差异显著性;采用–检验分析2个不同氮处理其他指标间的差异显著性。
2 结果与分析
2.1 低氮处理油菜根系的形态及各参数变化
低氮和高氮处理10 d后,利用根系扫描仪观察油菜根系形态。结果(图1)表明,低氮处理显著诱导了油菜根系伸长(图1–A、图1–B),根表面积和根体积也均显著高于高氮处理(图1–C、图1–D)。低氮处理油菜的总根长、根表面积和根体积分别是高氮处理油菜的2.06、1.72和1.13倍。
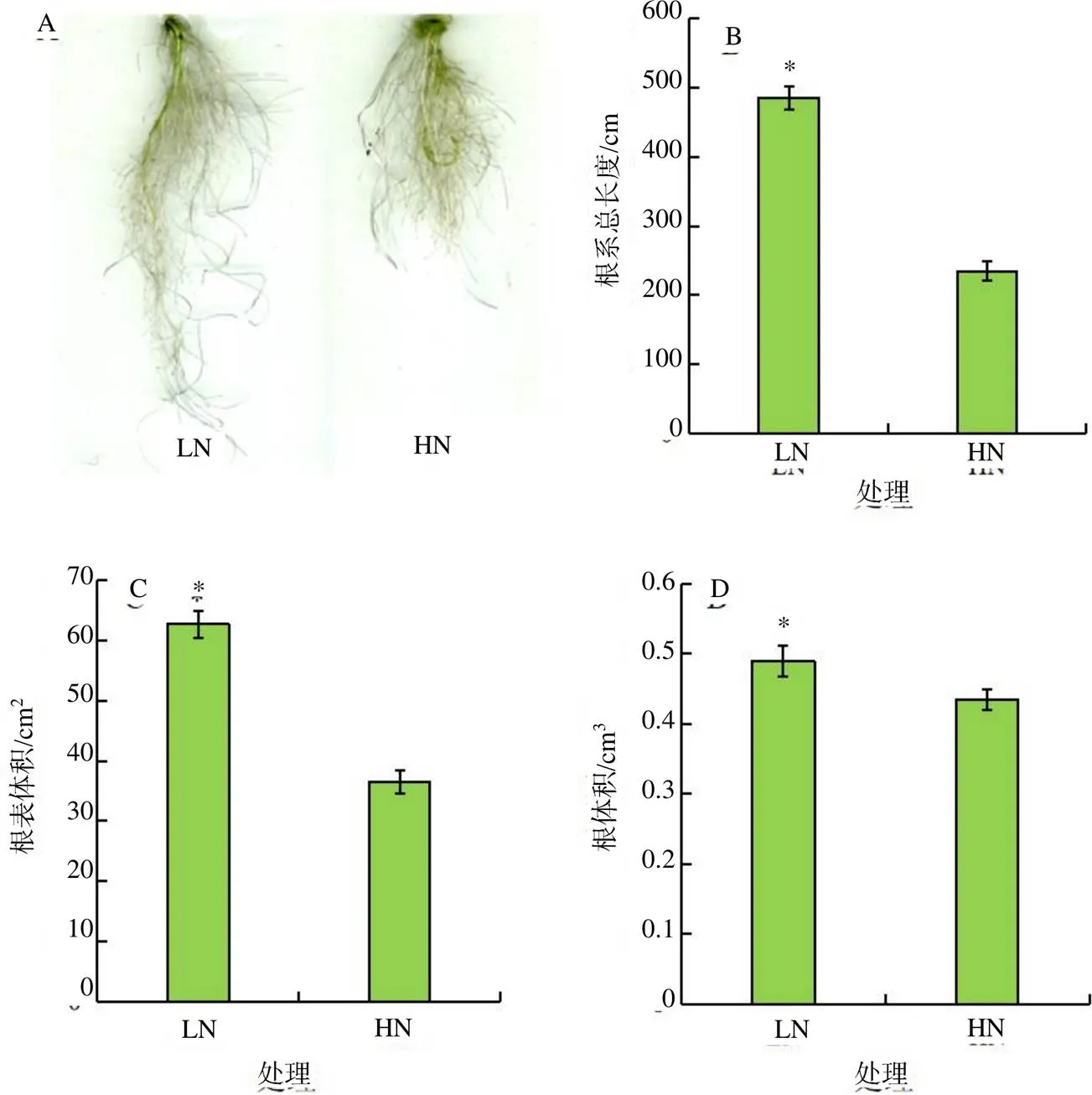
“*”示处理间的差异有统计学意义(P<0.05)。
2.2 低氮处理对油菜干物质质量、氮含量、根冠比及氮生理效率的影响
从表1可以看出,低氮胁迫显著抑制了油菜生长,减少了油菜叶片和根系的干物质积累量,尤其是对叶片干物质量的影响达到了极显著水平。根冠比可以用来表征光合产物在植株体内的分配特性。在低氮胁迫条件下,油菜的根冠比明显高于高氮处理,表明油菜将更多的光合产物分配到根中,促进低氮水平下根系的优先生长。从表1还可以看出,低氮明显降低了油菜叶片和根系的全氮含量及积累量,但显著提高了氮的生理利用效率。氮生理利用效率是反映植物对氮素利用率的指标。低氮处理的油菜有较高的氮生理利用效率,说明低氮条件下油菜能以较少的氮积累量产生较多的干物质量,这也是植物作出的一种低氮适应性反应。
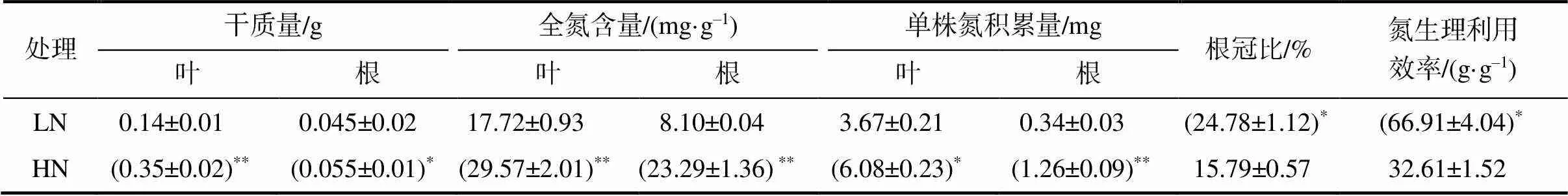
表1 不同氮处理油菜干物质积累量、氮含量、根冠比及氮生理效率
“*” “**”分别表示处理间的差异在0.05、0.01水平有统计学意义。
2.3 低氮处理对油菜根尖不同分区细胞长度及内源激素含量的影响
从图 2–A可以看出,低氮处理的植株主根根毛距根尖的距离明显长于高氮处理的,表明低氮诱导了油菜根系伸长区长度的增加。图2–B、图2–C表明,供氮水平对根尖伸长区细胞长度无显著影响,但低氮处理促进了根成熟区细胞的伸长。对根尖伸长区和成熟区细胞分裂素和生长素含量的测定结果(图2–D、图2–E)表明,无论低氮还是高氮处理的油菜,根尖伸长区2种激素的含量均显著高于成熟区的;与高氮处理相比,低氮处理增加了根尖伸长区细胞分裂素含量和根尖成熟区生长素含量。这说明低氮是通过影响油菜根尖伸长区和成熟区细胞分裂素和生长素含量来促进伸长区细胞分裂和成熟区细胞伸长,进而使根系伸长。

LN–S、HN–S分别示伸长区LN、HN处理;LN–C、HN–C分别示成熟区LN、HN处理。“*”示处理间的差异有统计学意义(P<0.05);不同小写字母示处理间的差异有统计学意义(n=6,P <0.05)。
2.4 低氮处理对油菜根系细胞壁主要组分含量的影响
植物细胞壁是一种高度动态变化的复杂网络结构,参与各种细胞的代谢活动,其生物合成也参与细胞分裂、伸长和分化过程。对低氮和高氮处理油菜根系细胞壁进行提取,并且对细胞壁主要组分(果胶、纤维素、半纤维素和木质素)进行分离测定。试验结果(图3–A、图3–B)表明,低氮处理明显提高了油菜根细胞壁中果胶含量和纤维素含量,与高氮处理相比,分别提高了63.43%和22.58%。但是低氮胁迫对油菜根系细胞壁中半纤维素和木质素含量的影响并未达到显著水平(图3–C、图3–D)。
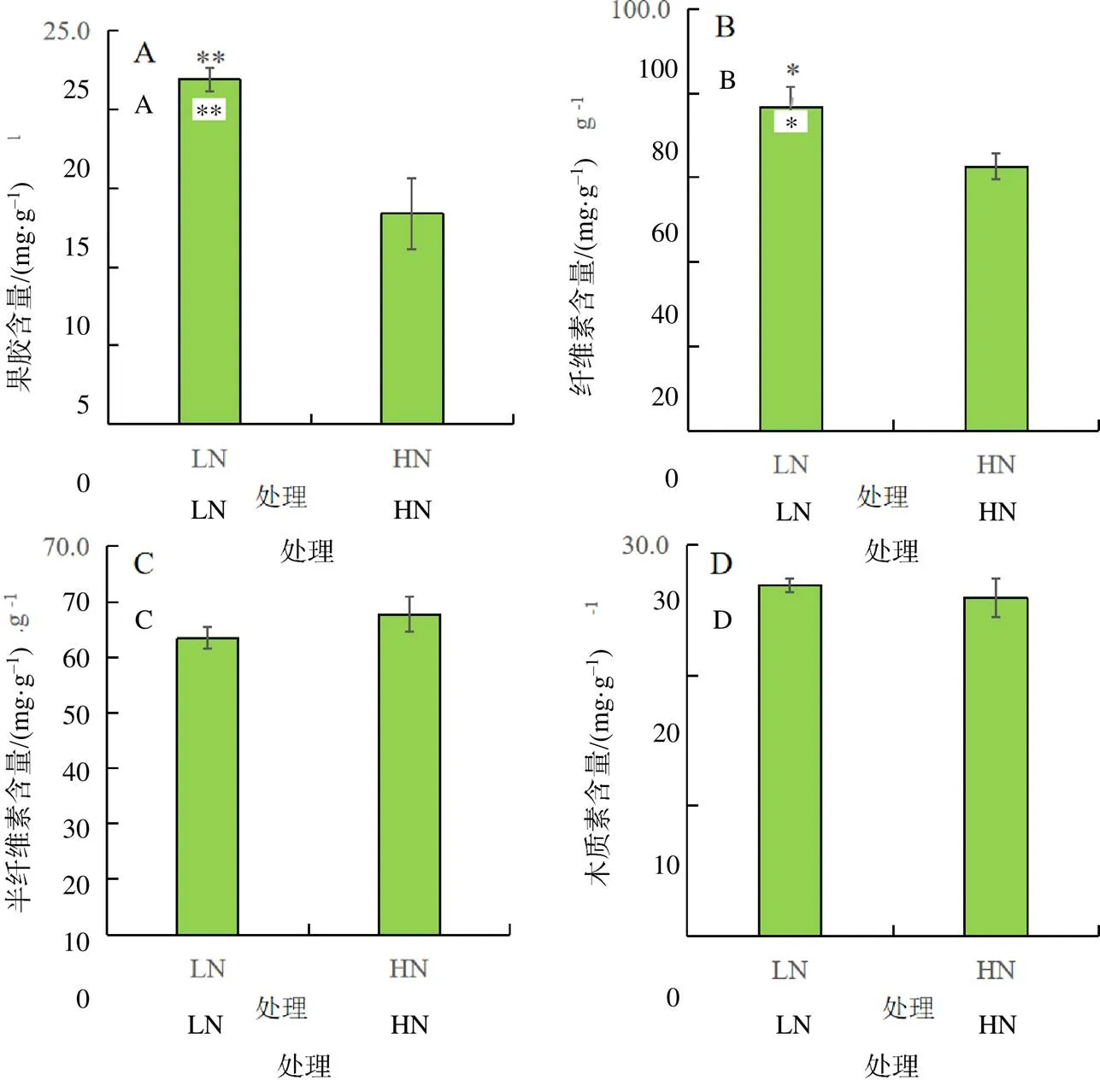
“*”“**”分别表示处理间的差异在0.05、0.01水平具有统计学意义。
2.5 不同氮处理油菜根系的转录组学分析
利用转录组学手段探索不同氮水平下油菜根系细胞壁中果胶、纤维素、半纤维素、木质素和膨胀蛋白相关基因的差异。在油菜根系细胞壁中检测到60个与果胶相关的基因,其中40个与果胶裂解酶相关,4个与果胶多聚半乳糖醛酸酶相关,9个与β–半乳糖苷酶相关,7个与果胶甲基酯酶相关(图4–A)。通过分析发现,与高氮处理相比,低氮处理根系中与果胶降解相关的酶的基因转录水平降低(40个果胶裂解酶基因中有25个下调、4个果胶多聚半乳糖醛酸酶基因有3个下调、9个β–半乳糖苷酶基因均下调),表明低氮下油菜根系细胞壁中果胶的降解减缓。从果胶甲基酯化酶和果胶甲基酯化抑制蛋白基因家族的转录水平来看,低氮处理根系中与果胶甲基酯化相关的基因表达量降低,与果胶甲基酯化抑制蛋白相关的基因表达量升高(图4–A),表明低氮时油菜根系通过抑制果胶甲基酯化抑制蛋白活性来促进果胶甲基酯酶的活性,从而促进果胶的去甲基化过程,改变果胶结构。在6个与纤维素合成过程相关的基因中,有5个基因的转录水平受低氮的诱导而升高;6个与纤维素降解过程相关的基因(包括纤维素酶和β–葡萄糖苷酶)中,有4个基因的转录水平降低(图4–B)。由此可见,低氮条件下油菜根细胞壁中纤维素含量的升高是低氮诱导纤维素合成和抑制纤维素降解的综合结果。虽然低氮对油菜根细胞壁中半纤维素和木质素含量无显著影响,但通过分析与之相关的基因的转录水平的改变情况(图4–C、图4–D)来看,与木葡聚糖内糖基转移酶/水解酶相关的基因变化较大,低氮处理中该类基因转录水平普遍下调,有利于木葡聚糖与纤维素微纤丝的交互连接,稳定细胞壁结构,但对半纤维素含量的影响并不清楚。低氮对木质素合成过程无显著影响,故木质素含量并未因氮含量差异而改变。作为植物细胞壁松弛因子,细胞壁膨胀蛋白可以有效提高细胞壁的可塑性,促进细胞伸长。细胞壁膨胀蛋白基因转录水平受低氮诱导普遍升高(27个中有24个显著上调、图4–E),这可能是低氮诱导了油菜根系细胞壁膨胀蛋白的表达,进而促进根系伸长。

PEL、PG、BGAL、PME和PMEI分别代表果胶裂解酶、果胶多聚半乳糖醛酸酶、β–半乳糖苷酶、胶甲基酯化酶和果胶甲基酯化抑制蛋白相关基因;CS、CEL和BGL分别代表纤维素合酶、纤维素酶和β–葡萄糖苷酶相关基因;XTH和XYL分别代表木葡聚糖内糖基转移酶/水解酶和木聚糖酶相关基因;LS、OMT和LAC分别代表木质素合成酶、O–甲基转移酶和漆酶相关基因;EXP代表膨胀素相关基因。图例所示颜色红色至绿色的变化表示基因转录水平从高到低。
3 结论与讨论
根系是植物体从土壤中获取养分的重要器官,在外界低氮胁迫条件下,植物根系能够通过自身调节作出形态、结构和生理上的适应性反应,如根冠比明显升高[9,14]、根系伸长[15–16]、玉米根质量和总根长增加[10]。QIN等[17]利用三维原位定量分析系统研究发现,缺氮不仅刺激了油菜主根和侧根伸长,也增加了根尖数。本研究中,利用根系扫描仪对油菜根系形态进行了分析,结果表明低氮胁迫增加了总根长度、根系表面积和总体积,有利于根系与土壤中氮素接触,在氮素有限的环境中提高吸收效率。根系形态发生受细胞分裂和扩张的调控[18]。植物激素特别是生长素和细胞分裂素都参与调节细胞的分裂和伸长[19–20]。据报道[21–22],生长素在氮素调控根系发育中起关键作用,细胞分裂素的含量及细胞分裂素基因表达量均会随氮水平的改变而改变[23]。本研究中,低氮处理促进了油菜根尖成熟区生长素和伸长区细胞分裂素含量的增加,刺激了成熟区细胞的伸长和伸长区细胞的分裂,从而表现为低氮处理油菜幼苗根系长度的增加。
细胞壁影响细胞大小和形状,从而决定植物组织形态。细胞壁结构和细胞壁代谢经常受到各种非生物胁迫,如干旱、淹水、极端温度、盐渍化、重金属等的影响[24]。前人[17]研究发现,缺氮条件下油菜根系中几种细胞壁相关的蛋白质含量增加,而这几种蛋白参与了缺氮胁迫下根系的适应性伸长。ALLISON等[25]研究发现,氮对细胞壁的组成有显著影响。本研究结果表明,低氮胁迫改变了油菜根系细胞壁的组成,提高了细胞壁中的果胶含量和纤维素含量,但对半纤维素和木质素含量无显著影响。果胶是植物细胞壁的重要组成成分,在植物体内具有多种不同的功能,如促进细胞间的粘附、提供结构支撑、影响次生细胞壁的形成等[26–27]。根系转录组分析也发现,低氮下油菜根系中果胶含量的升高与果胶降解相关酶(果胶裂解酶、多聚半乳糖醛酸酶、β–半乳糖苷酶、果胶甲基酯酶)的基因转录水平整体降低有关。植物细胞壁纤维素的生物合成依赖纤维素合酶基因[28],β–葡萄糖苷酶是一种纤维素酶,在纤维素的糖化作用中将纤维素二糖和纤维素寡糖水解成葡萄糖[29]。低氮胁迫下,油菜根系中纤维素合酶基因转录水平的显著上调和β–葡萄糖苷酶和纤维素酶基因的显著下调使细胞壁中纤维素含量表现为受低氮诱导明显增加。
木葡聚糖是半纤维素中重要的组分,木葡聚糖内糖基转移酶/水解酶能催化木葡聚糖分子裂解和聚合[30–32],对植物细胞壁的松弛与重构[33–34]、细胞伸长生长[35]有重要作用。本研究中,12个木葡聚糖内糖基转移酶/水解酶家族差异基因中,低氮处理诱导该类基因转录水平普遍下调,有利于木葡聚糖与纤维素微纤丝的交互连接,保持细胞壁结构稳定性。但低氮并未因降低木葡聚糖内糖基转移酶/水解酶活性而显著影响细胞壁中半纤维素含量,可能是低氮激活了半纤维素的合成引起的,具体机制还需进一步探究。
膨胀素作为一种细胞壁松弛因子,能够引起植物细胞壁结构变化,使细胞壁松弛,有利于细胞的生长[36]。本研究还发现在27种膨胀素差异表达基因中,有24种受低氮诱导显著上调,这可能也是低氮促进细胞伸长、根系增长的原因。
[1] CORUZZI G,BUSH D R.Nitrogen and carbon nutrient and metabolite signaling in plants[J].Plant Physiology,2001,125(1):61–64.
[2] ZHU Q C,VRIES W D,LIU X J,et al.Enhanced acidification in Chinese croplands as derived from element budgets in the period 1980-2010[J].Science of the Total Environment,2018,618:1497–1505.
[3] 王璐.中国油菜产业安全研究[D].武汉:华中农业大学,2014.
[4] 官春云,黄璜,黄国勤,等.中国南方稻田多熟种植存在的问题及对策[J].作物杂志,2016(2):1–7.
[5] MALAGOLI P,LAINE P,ROSSATO L,et al.Dynamics of nitrogen uptake and mobilization in field-grown winter oilseed rape() from stem extension to harvest II.an 15N-labelling-based simulation model of N partitioning between vegetative and reproductive tissues[J].Annals of Botany,2005,95(7):1187–1198.
[6] SYLVESTER-BRADLEY R,KINDRED D R.Analysing nitrogen responses of cereals to prioritize routes to the improvement of nitrogen use efficiency[J].Journal of Experimental Botany,2009,60(7):1939–1951.
[7] EGHBALL B,MARANVILLE J W.Root development and nitrogen influx of corn genotypes grown under combined drought and nitrogen stresses[J].Agronomy Journal,1993,85(1):147–152.
[8] FEIL B,THIRAPORN R,GEISLER G,et al.Root traits of maize seedlings:indicators of nitrogen efficiency? [J].Plant and Soil,1990,123(2):155–159.
[9] VAMERALI T,SACCOMANI M,BONA S,et al.A comparison of root characteristics in relation to nutrient and water stress in two maize hybrids[J].Plant and Soil,2003,255(1):157–167.
[10] CHUN L,MI G H,LI J S,et al.Genetic analysis of maize root characteristics in response to low nitrogen stress[J]. Plant and Soil,2005,276(1/2):369–382.
[11] 王小娟,宋海星,陈历儒,等.不同供氮水平下油菜根系的反应差异[J].湖南农业大学学报(自然科学版),2011,37(6):592–597.
[12] 夏敏,陈阿丽,于芬.厚竹高生长期茎秆节部对基本组织细胞壁发育形成的影响[J].江西农业大学学报,2018,40(6):1178–1184.
[13] BROWN P H.Localization of boron in cell walls of squash and tobacco and its association with pectin (evidence for a structural role of boron in the cell wall)[J].Plant Physiology,1994,105(2):681–689.
[14] 刘秋霞,任涛,廖世鹏,等.不同氮素供应对油菜苗期生长及碳氮分配的影响[J].中国油料作物学报,2019,41(1):92–100.
[15] WANG Y,MI G H,CHEN F J,et al.Response of root morphology to nitrate supply and its contribution to nitrogen accumulation in maize[J].Journal of Plant Nutrition,2005,27(12):2189–2202.
[16] RASMUSSEN I S,DRESBØLL D B,THORUP- KRISTENSEN K.Winter wheat cultivars and nitrogen(N) fertilization:effects on root growth,N uptake efficiency and N use efficiency[J].European Journal of Agronomy,2015,68:38–49.
[17] QIN L,WALK T C,HAN P P,et al.Adaption of roots to nitrogen deficiency revealed by 3D quantification and proteomic analysis[J].Plant Physiology,2018,179(1):329–347.
[18] STRADER L C,CHEN G L,BARTEL B.Ethylene directs auxin to control root cell expansion[J].The Plant Journal,2010,64(5):874–884.
[19] GRIENEISEN V A,XU J,MARÉE A F M,et al.Auxin transport is sufficient to generate a maximum and gradient guiding root growth[J].Nature,2007,449:1008–1013.
[20] WERNER T,NEHNEVAJOVA E,KÖLLMER I,et al. Root-specific reduction of cytokinin causes enhanced root growth,drought tolerance,and leaf mineral enrichment inand tobacco[J].The Plant Cell,2010,22(12):3905–3920.
[21] 牛田田.生长素与硝态氮信号互作参与拟南芥根系的生长发育[D].济南:山东大学,2014.
[22] 张德健,夏仁学,曹秀.矿质养分和激素对根毛生长发育的影响及作用机制[J].植物营养与肥料学报,2016,22(3):802–810.
[23] 马丹.水稻幼苗对氮素响应的激素生理机制[D].南京:南京农业大学,2012.
[24] LE GALL H,PHILIPPE F,DOMON J M,et al.Cell wall metabolism in response to abiotic stress[J].Plants,2015,4(1):112–166.
[25] ALLISON G G,MORRIS C,LISTER S J,et al.Effect of nitrogen fertiliser application on cell wall composition in switchgrass and reed canary grass[J].Biomass and Bioenergy,2012,40:19–26.
[26] ATMODJO M A,HAO Z Y,MOHNEN D.Evolving views of pectin biosynthesis[J].Annual Review of Plant Biology,2013,64:747–779.
[27] 郁有健,沈秀萍,曹家树.植物细胞壁同聚半乳糖醛酸的代谢与功能[J].中国细胞生物学学报,2014,36(1):93–98.
[28] 高艳,陈光辉,陈秀娟,等.植物细胞壁纤维素生物合成的调控[J].生物技术通报,2014(1):1–7.
[29] 李远华.β–葡萄糖苷酶的研究进展[J].安徽农业大学学报,2002,29(4):421–425.
[30] EDELMANN H G,FRY S C.Effect of cellulose synthesis inhibition on growth and the integration of xyloglucan into pea internode cell walls[J].Plant Physiology,1992,100(2):993–997.
[31] HAYASHI T,KAIDA R.Functions of xyloglucan in plant cells[J].Molecular Plant,2011,4(1):17–24.
[32] MUÑOZ-BERTOMEU J,MIEDES E,LORENCES E P. Expression of xyloglucan endotransglucosylase/hydrolase (XTH) genes and XET activity in ethylene treated apple and tomato fruits[J].Journal of Plant Physiology,2013,170(13):1194–1201.
[33] CAVALIER D M,LEROUXEL O,NEUMETZLER L,et al.Disrupting twoxylosyltransferase genes results in plants deficient in xyloglucan,a major primary cell wall component[J].The Plant Cell,2008,20(6):1519–1537.
[34] MIEDES E,SUSLOV D,VANDENBUSSCHE F,et al. Xyloglucan endotransglucosylase/hydrolase(XTH) over- expression affects growth and cell wall mechanics in etiolatedhypocotyls[J].Journal of Experi- mental Botany,2013,64(8):2481–2497.
[35] VISSENBERG K,FRY S C,PAULY M,et al.XTH acts at the microfibril-matrix interface during cell elongation[J]. Journal of Experimental Botany,2005,56(412):673– 683.
[36] 刘慧娟.甘蓝型油菜和基因克隆及表达分析[D].南京:南京农业大学,2014.
The root elongation and the changes of cell wall components of rapeseed root under low nitrogen conditions
TIAN Hui1,SONG Haixing1,WU Xiuwen1,2,ZHANG Zhenhua1*
(1.College of Resources and Environment, Hunan Agricultural University, Changsha, Hunan 410128, China; 2.School of Resources and Environment, Qingdao Agricultural University, Qingdao, Shandong 266108, China)
As an important oil crop in China, rapeseed(L.) has a high demand for nitrogen(N) and the N deficiency in soil is an important limiting factor for rapeseed production. TakingL. as the experimental material, low N(LN, 0.3 mmol/L NO3–) and high N(HN, 6.0 mmol/L NO3–) treatments were set up in this study. The results showed that the low N promoted root elongation of rapeseed, and induced higher root/shoot ratio and N physiological efficiency. In the meantime, low N increased cytokinin content in the elongation zone and auxin content in the mature zone of rapeseed root tip, thereby promoted cell division in the elongation zone and cell elongation in the mature zone. Low N treatment decreased pectin and hemicellulose content in cell walls of rapeseed roots, while had no significantly effects on hemicellulose and lignin. Transcriptome results showed that the increase of pectin content was mainly due to the inhibition on expression of pectin degrading enzyme related genes by low N, and the effect on cellulose content was attributed to the increase of cellulose synthesis and the decrease of cellulose degradation. At the same time, the up-regulated expression of genes related to expansin also showed that low N promoted the relaxation of cell walls and was conducive to cell expansion and division in roots. Conclusively, the study revealed the mechanism underlying root elongation affected by alterations on cell wall structure and components under N deficiency.
rapeseed; low N; root; cell wall; transcriptome
S565.401
A
1007-1032(2022)04-0386-08
田辉,宋海星,吴秀文,张振华.低氮条件下油菜根系伸长与细胞壁组分的变化[J].湖南农业大学学报(自然科学版),2022,48(4):386–393.
TIAN H,SONG H X,WU X W,ZHANG Z H.The root elongation and the changes of cell wall components of rapeseed root under low nitrogen conditions[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(4):386–393.
http://xb.hunau.edu.cn

2021–11–27
2022–07–18
国家自然科学基金项目(32072664);湖南省自然科学基金项目(2020JJ5242、2021JJ0004)
田辉(1988—),男,山东菏泽人,硕士研究生,主要从事油菜低氮适应性机制研究,tianhui1715@163.com;*通信作者,张振华,博士,教授,主要从事稻油轮作系统提质增效机制研究,zhzh1468@163.com
责任编辑:毛友纯
英文编辑:柳正
