血清CD47水平与幽门螺杆菌感染及慢性萎缩性胃炎进展的关系
2022-09-14黄婷婷谢桂丹蔡潇阳
黄婷婷 谢桂丹 蔡潇阳
幽门螺杆菌(Hp)是一种革兰阴性菌,属于微需氧菌,主要感染胃和十二指肠球部[1]。Hp感染是引起胃癌及其癌前病变的重要的危险因素,其机制与宿主的基因易感性、环境及Hp毒力[如细胞毒素相关蛋白A(CagA)、空泡细胞毒素A(VacA)等]密切相关[2]。慢性萎缩性胃炎(CAG)是由不良的饮食习惯、吸烟、饮酒或Hp感染引起一种慢性炎性疾病,以胃酸分泌减少或消失为主要特征,多伴有幽门腺化生和肠上皮化生,其被视为重要的胃癌前病变[3]。胃泌素-17(G-17)和胃蛋白酶原(PG)的血清学检测可以帮助评估机体的CAG发生风险[4]。研究表明CD47与胃癌发生有关,CD47+细胞具有肿瘤干细胞特性[5]。此外,Hp亦被证明可促进胃癌发生和进展[6]。因此,推测血清CD47水平与Hp感染之间可能存在联系。本研究探讨了血清CD47水平与Hp感染及CAG进展的关系,以期为临床上Hp根除治疗提供参考,并为揭示Hp在CAG发生、发展中的作用机制提供理论依据。
1 资料与方法
1.1 研究对象
选择2018年10月至2021年2月在儋州市人民医院消化内科就诊的273例CAG患者,其中男性55例,女性218例,年龄18~79岁,平均年龄为(54.62±9.30)岁。所有CAG患者均经胃镜及活体组织病理检查确诊,符合《中国慢性胃炎共识意见(2017 年,上海)》[7]和《慢性萎缩性胃炎中西医结合诊疗共识意见(2017年)》[8]中相关疾病诊断标准。排除标准:(1)恶性肿瘤、妊娠、肾脏疾病、肝衰竭、肝硬化、心脏衰竭或活动性感染者;(2)入组前3个月内接受过抗生素、胃黏膜保护剂、抑酸剂等药物治疗者;(3)14C-尿素呼气试验(14C-UBT)与抗Hp抗体检测结果不一致者。根据14C-UBT和抗Hp抗体检测结果,将CAG患者分为Hp阳性组和Hp阴性组。所有患者均签署知情同意书,本研究获得医院医学伦理委员会的批准。
1.2 检测方法
1.2.114C-UBT 患者清晨空腹服用14C尿素胶囊(0.75 µCi),静坐25 min,然后向气体收集瓶吹气直至粉色液体指示剂变为无色。向气体收集瓶中加入4.5 mL闪烁液,倒置3次,置于HUBT-01A型Hp测试仪(深圳市中核海得威生物科技有限公司)中,检测时间设定为1 min,检测值≥100 dpm为Hp阳性,<100 dpm为Hp阴性。
1.2.2 实验室检测 患者于检测前8~12 h起禁食、禁水,清晨抽取患者空腹静脉血5 mL,3 000 r/min离心10 min,取血清保存于-80 ℃冰箱。采用ELISA法检测血清CD47水平(试剂盒购自上海江莱生物科技有限公司)和血清G-17、PGⅠ、PGⅡ水平(试剂盒购自广州市格瑞林生物科技有限公司)。采用胶体金法检测IgG类抗Hp抗体水平(试剂盒购自美国Biohit Healthcare公司),按照说明书在微量平板上对血清样本进行分批测试。使用Multiskan GO全波长酶标仪(购自美国Thermo公司)检测各样本在450 nm处的光密度(OD)值。为了测定G-17、PGⅠ、PGⅡ水平,采用标准浓度-OD值二阶拟合曲线计算未知样品浓度。IgG类抗Hp抗体以酶免疫单位(EIU)定量,抗Hp抗体≥30 EIU为Hp阳性。采用蛋白质印迹法进行抗Hp抗体分型检测(试剂盒购自深圳市伯劳特生物制品有限公司),将Hp分为Ⅰ型[CagA和(或)VacA阳性]和Ⅱ型[尿素酶A和(或)尿素酶B阳性,CagA和VacA阴性]。
1.2.3 胃镜检查与病理学诊断 根据《中国慢性胃炎共识意见精简版(2017年,上海)》[9]中标准,胃镜下采集了5块胃黏膜活体组织(2块胃窦组织,2块胃体组织和1块胃角组织)。根据Sydney系统[10]进行组织病理学评估。分别将慢性炎性反应的严重程度和活动度按照无(0级)、轻度(1级)、中度(2级)和重度(3级)标准进行评级。采用慢性胃炎OLGA评估系统对CAG患者进行病变分期评估(分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期)。
1.3 统计学处理
使用SPSS 26.0软件进行统计学分析,正态分布的连续变量以均数±标准差(x±s)表示,采用t检验。二分类变量以例(%)表示,采用卡方检验。偏态分布的数据以中位数(四分位数间距)表示,并使用Kruskal-Wallis检验和事后Mann-Whitney U分析。血清CD47与血清G-17、PGⅠ、PGⅡ的相关性采用Spearman相关系数分析。所有检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Hp阴性组与Hp阳性组的血清CD47、G-17、PGⅠ、PGⅡ水平比较
根据14C-UBT检测结果,将273例CAG患者分为Hp阴性组(n=140例)和Hp阳性组(n=133例)。2组的年龄、性别构成、BMI相比较,差异均无统计学意义(P均>0.05)。Hp阳性组的血清CD47、G-17、PGⅠ、PGⅡ水平均较Hp阴性组明显升高,差异均有统计学意义(P均<0.001)。见表1。

表1 Hp阴性组与Hp阳性组的血清CD47、G-17、PGⅠ、PGⅡ水平比较
2.2 HpⅠ型组与HpⅡ型组的血清CD47、G-17、PGⅠ、PGⅡ水平比较
根据抗Hp抗体分型检测结果,将Hp阳性患者分为HpⅠ型组(n=74)和HpⅡ型组(n=59)。如表2所示,HpⅠ型组的血清CD47、G-17、PGⅠ、PGⅡ水平均较HpⅡ型组明显升高,差异均有统计学意义(P均<0.001)。
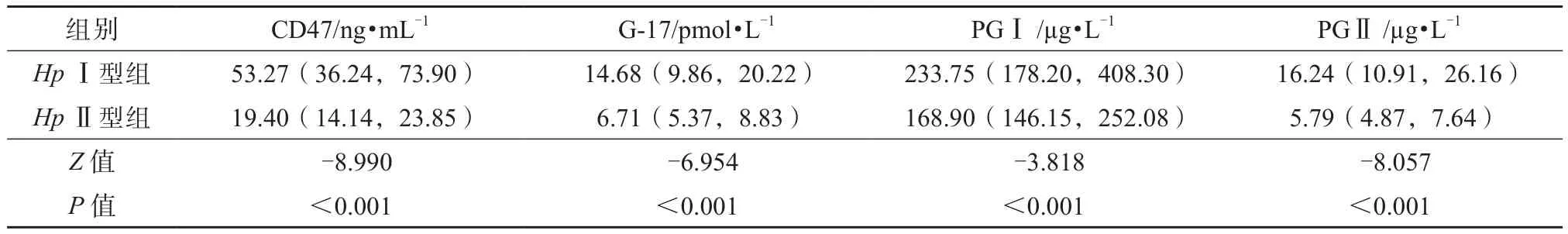
表2 HpⅠ型组与HpⅡ型组的血清CD47、G-17、PGⅠ、PGⅡ水平比较
2.3 血清CD47、G-17、PGⅠ、PGⅡ水平及Hp分型与慢性炎性反应的严重程度及活动度的关系
如表3所示,在慢性炎性反应严重程度为2级或3级的患者中,HpⅠ型感染患者占比均明显高于HpⅡ型患者,且其血清CD47、G-17、PGⅡ水平亦高于0级患者(P<0.05);尤其是3级患者,血清CD47、G-17、PGⅡ水平升高较1级和2级患者更明显(P<0.05)。

表3 血清CD47、G-17、PGⅠ、PGⅡ水平及Hp分型与慢性炎性反应严重程度的关系
如表4所示,在炎性反应活动度为1级、2级或3级的患者中,HpⅠ型感染患者占比均明显高于HpⅡ型患者,且炎性反应活动度≥2级的患者的血清CD47、G-17、PGⅡ水平亦高于0级患者(P<0.05);尤其是3级患者,血清CD47、G-17、PGⅡ水平升高较1级和2级患者更明显(P<0.05)。
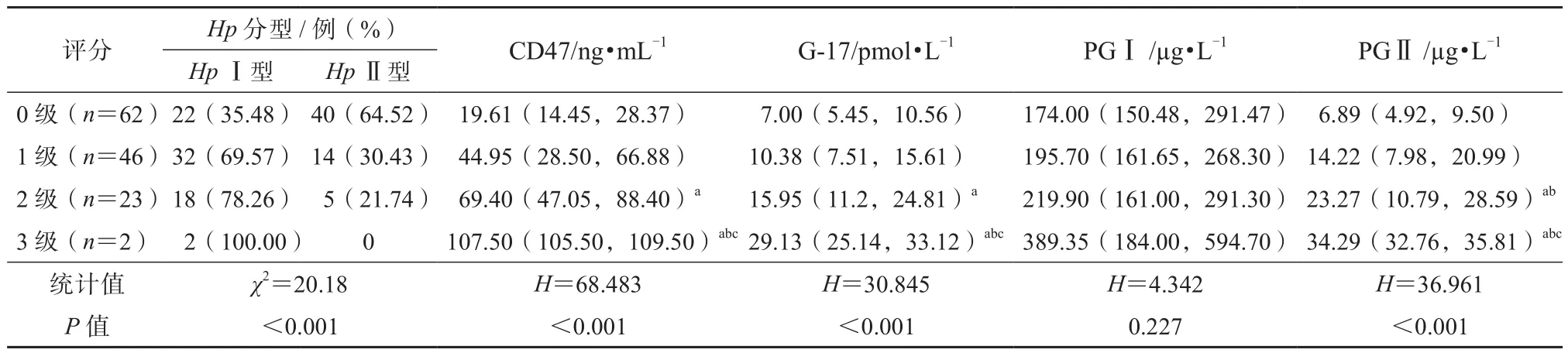
表4 血清CD47、G-17、PGⅠ、PGⅡ水平及Hp分型与炎性反应活动度的关系
2.4 血清CD47、G-17、PGⅠ、PGⅡ水平及Hp分型与OLGA分期的关系
如表5所示,OLGA分期≥Ⅲ期患者的血清CD47、G-17、PGⅡ水平高于Ⅰ期患者(P<0.05);尤其是Ⅳ期患者,血清CD47、G-17、PGⅡ水平升高较Ⅱ期和Ⅲ期患者更明显(P<0.05)。
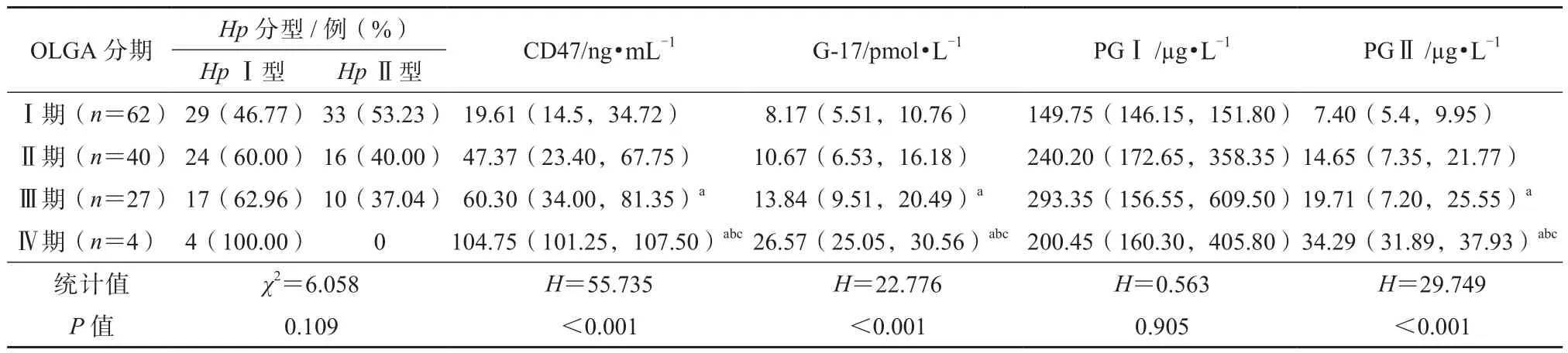
表5 血清CD47、G-17、PGⅠ、PGⅡ水平及Hp分型与OLGA分期的关系
2.5 血清CD47与血清G-17、PGⅠ、PGⅡ的相关性分析
Spearman相关系数分析结果显示,血清CD47与血清G-17、PGⅠ、PGⅡ均呈正相关性(r=0.723,r=0.213,r=0.820,P均<0.001)。见图1。
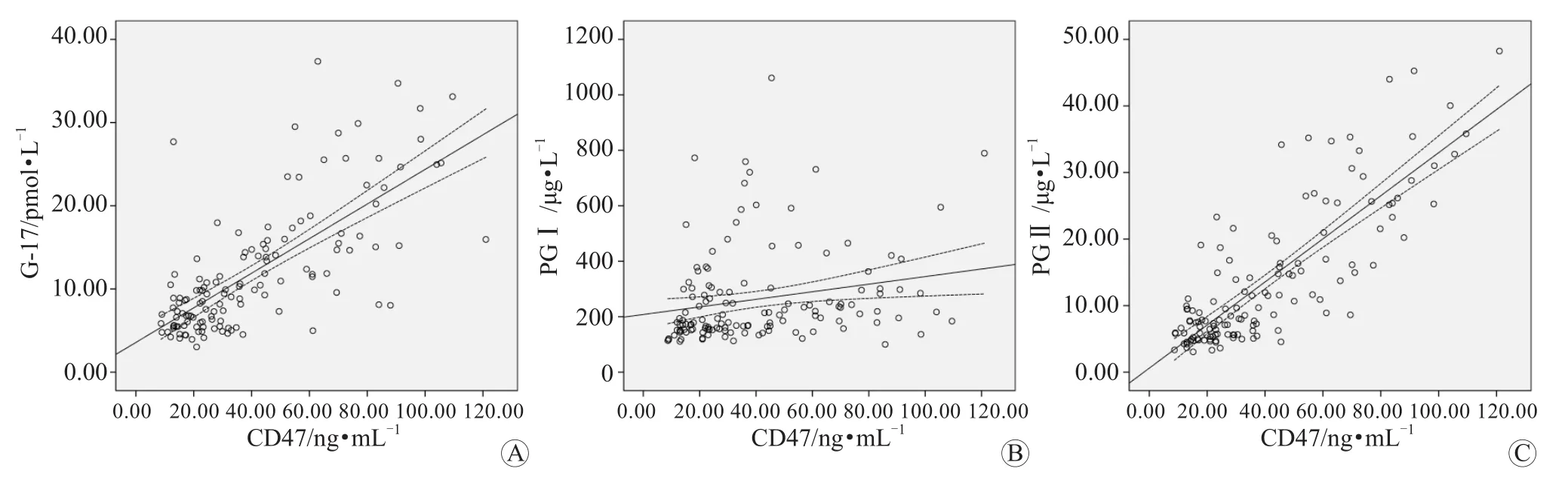
图1 血清CD47与血清G-17、PGⅠ、PGⅡ的相关性分析 A 血清CD47与血清G-17 B 血清CD47与血清PGⅠ C 血清CD47与血清PGⅡ
3 讨论
CAG的病理改变包括腺体萎缩和肠上皮化生,其被视为癌前病变[11]。CAG通常由Hp感染所致,经过胃黏膜肠上皮化生、胃黏膜发育不良等过程演变为胃癌[1]。因此,寻找有效的早期诊断生物标志物对于预防胃癌的发生非常重要。CD47是一种糖蛋白,其广泛表达于所有造血细胞膜和大多数其他种类的细胞膜上,通过与信号调节蛋白α结合成为抗巨噬细胞分子[3]。有研究显示,CD47高表达与胃癌患者总体生存率较差显著相关,CD47也与Hp感染相关[5]。本研究比较了Hp阳性和Hp阴性的CAG患者的血清CD47及胃功能3项指标(血清G-17、PGⅠ和PGⅡ)水平,并探讨了血清CD47与Hp感染之间的潜在联系,结果显示Hp阳性的CAG患者的血清CD47、G-17、PGⅠ和PGⅡ水平均高于Hp阴性的CAG患者,并且HpⅠ型感染患者的上述指标水平均较HpⅡ型感染患者高。
Hp被认为是许多疾病的主要病因,如消化性溃疡、CAG、胃癌、麦芽淋巴瘤等[12]。CAG被视为Hp感染的主要结局之一,且与胃癌的高风险有关[13]。有研究显示,Hp根除治疗后2年内,患者的胃肠道菌群无明显变化,根除治疗10年后胃肠道菌群有明显改善[2,14]。Hp感染患者中约有20%会发生胃癌的癌前病变,但仅有2%会进展至胃癌,这与宿主基因易感性、环境和Hp毒力密切相关[14]。不同类型的Hp的毒力存在差异,其致病机制可能与多种因素有关,包括CagA、VacA、十二指肠溃疡诱导因子A等[15]。CagA、VacA是Hp毒力的重要决定因素,其会导致胃黏膜损伤和慢性炎性反应,最终可能导致胃癌发生。根据血清毒力蛋白的表达,感染的Hp类型可通过IgG抗体的分型判断。Hp感染有多种诊断方法,较常用的非侵入性检测方法是14C-UBT和血清抗Hp抗体分型。有荟萃分析总结了33项研究结果,结果显示Hp的CagA基因型与胃癌及其癌前病变的发病风险增高有关[16]。Hp阳性可抑制胃黏膜自噬,引起炎性因子增多,从而增高胃炎严重程度。例如,Liu等[17]对不同类型的Hp感染患者的组织病理学特征等进行分析,发现HpⅠ型感染引起的炎性反应的严重程度和活动度,以及OLGA分期均明显高于HpⅡ型感染患者,这与本研究结果相符,说明Hp感染及其致病性与特异性基因及蛋白的表达密切相关,HpⅠ型表达CagA或VacA毒力蛋白,从而增高了胃癌的发生风险。既往研究显示,血清G-17、PGⅠ、PGⅡ检测对于评估胃癌发生风险具有一定的价值[18]。本研究发现HpⅠ型感染患者的血清CD47、G-17、PGⅠ、PGⅡ水平均显著高于HpⅡ型感染患者,说明HpⅠ型感染患者的血清CD47水平较高,这可能与更高的炎性反应严重程度及活动度有关。
目前关于Hp毒力因子的研究表明,CagA或VacA基因阳性样本与CAG及胃癌有显著的相关性,可有效预测疾病的发生和进展。另有研究发现,Hp的侵袭能力与VacA基因的m区多态性有关[19]。该结论果表明,不同类型的Hp的侵袭能力存在差异。根据胃内分泌PGⅠ、PGⅡ部位的不同,推测HpⅠ型感染可使整个胃和十二指肠的PG分泌增加。此外,HpⅠ型感染亦可能通过其特有的炎性反应机制加速CAG的进展,从而促进对胃黏膜的侵袭和血清胃功能指标发生变化。CD47在胃癌的发展中起着重要作用。CD47-红细胞可通过巨噬细胞吞噬作用被迅速从血液循环系统中清除,而CD47+肿瘤细胞可避免被巨噬细胞清除。在包括胃癌在内的实体肿瘤中,CD47+细胞被认为具有肿瘤干细胞特性。研究表明CD47在多种恶性肿瘤中过度表达,其与巨噬细胞上的信号调节蛋白α相互作用,可防止肿瘤细胞的吞噬作用[20]。另有研究表明,与CD47低表达的胃癌患者相比,CD47高表达的胃癌患者的预后较差[21]。本研究结果发现,HpⅠ型感染患者的血清CD47水平高于HpⅡ型感染患者,而且随着疾病进展,HpⅠ型感染患者的占比升高,血清CD47水平亦逐渐升高。上述结果表明,Hp感染尤其是HpⅠ型感染可能通过上调CD47的表达,进而参与CAG的进展。
综上所述,本研究通过组织病理学表现和血清胃功能指标分析,发现Hp(尤其是HpⅠ型)感染可能导致血清CD47表达水平升高,进而在CAG进展中发挥了关键作用,这提示CD47有望成为CAG患者临床诊断和预后预测的重要生物标志物。本研究的样本量较小,今后有待更多大样本、多中心的临床研究来进一步验证本研究结果。
