TRPM7在胃癌组织中的表达及其对胃癌细胞凋亡和自噬的影响
2022-09-14张肖玲崔立娟
张肖玲 朱 伟 崔立娟
胃癌是一种在中国发病率较高的消化道恶性肿瘤,居男性恶性肿瘤发病率的第2位,女性恶性肿瘤发病率的第3位[1-2]。由于早期胃癌的病理特征不明显,临床症状的特异度不高,多数患者在确诊时已经处于中晚期。目前随着放射治疗、化学治疗技术的不断发展,患者的生存率逐年升高,但肿瘤的复发、转移、耐药等问题仍影响着胃癌治疗方案的效果[3-4]。胃癌的发病机制复杂且受多种因素的影响,因此探究与胃癌发生、发展相关的基因并寻找新的治疗靶点,对于胃癌的治疗至关重要。瞬时受体电位(TRP)通道家族是非选择性阳离子通道,几乎存在于所有组织和细胞内[5]。研究表明,TRP通道可通过调控钙离子信号通路干扰肿瘤细胞信号转导,进而调控肿瘤细胞的增殖、凋亡、基因转录等病理过程[6-7]。消化系统肿瘤相关的TRP通道主要包括TRPC1、TRPC5、TRPM6、TRPM7和TRPM8等[8],其中TRPM7已被报道可通过调控磷脂酰肌醇-3-激酶/蛋白激酶B(PI3K/Akt)信号通路促进卵巢癌的上皮-间充质转化[9];亦有研究表明,TRPM7具有成为肿瘤标志物和治疗靶点的潜力[10]。本文检测了TRPM7在胃癌组织及胃癌细胞株中的表达水平,并探究了其对胃癌细胞凋亡和自噬的影响,以期为临床诊断和治疗胃癌提供依据。
1 资料与方法
1.1 研究对象
收集2018年1月至2021年6月在张家港市中医医院进行手术治疗的46例胃癌患者的肿瘤组织和癌旁组织(距离肿瘤组织边缘>5 cm,经病理证实无肿瘤细胞)标本,其中男性33 例,女性13例,年龄40~75 岁,平均年龄为(60.23±5.04)岁。纳入标准:(1)符合《中国临床肿瘤学会(CSCO)原发性胃癌诊疗指南(2017.V1)》的诊断标准[11];(2)临床资料完整;(3)为首次治疗,均行组织切除手术。排除标准:(1)接受过除切除手术之外的其他抗肿瘤治疗;(2)合并其他恶性肿瘤;(3)肿瘤发生远处器官转移;(4)合并严重的心、肾、肝等脏器功能障碍。标本的采集均取得患者及家属的知情同意并签字。本研究经医院医学伦理委员会批准实施(批件号20180108)。胃黏膜上皮细胞株GES-1和胃癌细胞株MGC-803、SGC-7901、HGC-27、MKN-45均购自中国科学院(上海)细胞库。
1.2 TRPM7表达水平检测
采用实时荧光定量PCR法检测TRPM7在胃癌组织、癌旁组织、GES-1细胞及各胃癌细胞株中的表达水平。使用TRIzol试剂提取各组织和细胞中的总RNA,经核酸定量后,将核酸的质量浓度稀释至1 g/L后进行反转录合成cDNA,然后使用SYBR Green PCR Master Mix试剂盒(购自北京索莱宝科技有限公司)进行PCR反应,反应条件为:95 ℃预变性10 min;之后95 ℃变性10 s,60 ℃退火1 min,共40个循环。以GAPDH作为内参,采用 2−ΔΔCt法计算TRPM7 mRNA 的相对表达量。引物序列见表1。

表1 引物序列
1.3 细胞培养
GES-1、MGC-803、SGC-7901、HGC-27 和MKN-45细胞均培养于含10%胎牛血清的DMEM高糖培养基中。细胞从液氮中取出后迅速融化,重悬于培养基中,然后将其置于37 ℃、5% CO2的培养箱中,培养至细胞融合度达80%时进行传代,取对数生长期的细胞进行转染。
1.4 细胞转染和分组
将TRPM7小干扰RNA(TRPM7-siRNA,设为si-TRPM7组)和阴性对照(siRNA-NC,设为si-NC组)转染至MGC-803细胞,将空白质粒(设为Vector组)和TRPM7过表达质粒(设为TRPM7组)转染至MKN-45细胞。将对数生长期的MGC-803细胞和MKN-45细胞接种至6孔板中,每孔1×105个细胞,细胞贴壁后使用LipofectaminTM2000试剂盒(购自美国Invitrogen公司),按照上述分组进行转染。
1.5 各组细胞凋亡率检测
采用流式细胞术检测各组细胞的凋亡率。取各组细胞(1×105个)于流式管中,用预冷的无菌PBS清洗2次后,按照细胞凋亡检测试剂盒(购自美国BD公司)说明书操作,每组细胞中加入5 μL AnnexinV-FITC和5 μL PI染料,避光孵育1 h后,用PBS清洗2次,使用FACSCalibur流式细胞仪(购自美国BD公司)检测各组细胞的凋亡率。
1.6 LC3-Ⅱ和p62表达水平及 PI3K、Akt、mTOR磷酸化水平检测
采用蛋白质印迹法检测各组细胞的LC3-Ⅱ和p62表达水平,以及PI3K、Akt、mTOR磷酸化水平。收集各组细胞(1×106个)于离心管中,每管加入500 μL RIPA蛋白裂解液,经蛋白定量,将上样缓冲液与蛋白样品混合后煮沸5 min,取各组蛋白10 μg进行SDS聚丙烯酰胺凝胶电泳,蛋白转移至PVDF膜,封闭后,将PVDF膜与抗LC3-Ⅱ抗体、抗p62抗体、抗p-PI3K/PI3K抗体、抗p-Akt/Akt抗体、抗p-mTOR/ mTOR抗体、抗GAPDH抗体(均购自美国Cell Signaling Technology公司)置于4 ℃孵育过夜,清洗后,与山羊抗兔IgG抗体共孵育1.5 h后曝光并显影,应用ImageJ软件进行定量分析。
1.7 统计学分析
应用GraphPad Prism 7.0软件进行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 TRPM7在各种组织和细胞中的表达水平比较
实时荧光定量PCR检测结果显示,与癌旁组织比较,TRPM7 mRNA在胃癌组织中的表达水平较高,差异有统计学意义(P<0.001);与GES-1细胞比较,TRPM7 mRNA 在 MGC-803、SGC-7901、HGC-27和MKN-45细胞中的表达水平较高,差异均有统计学意义(P均<0.001)。该结果提示TRPM7在胃癌组织和胃癌细胞中呈高表达。见图1和图2。
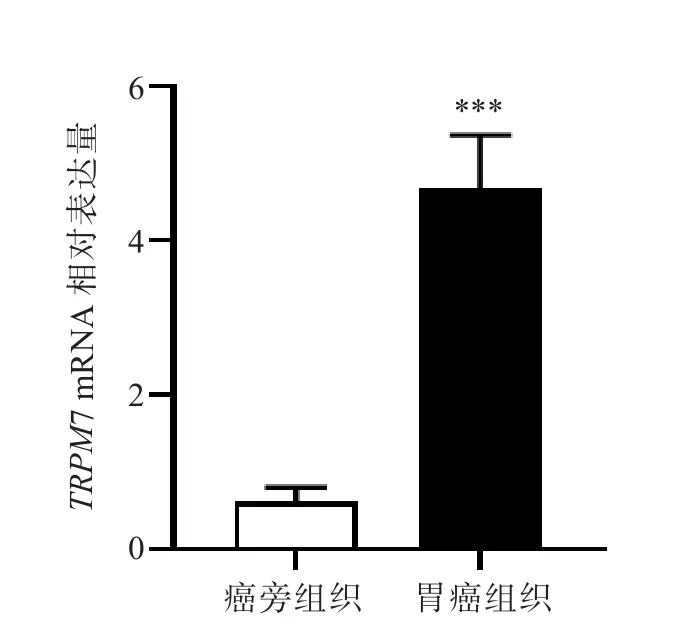
图1 胃癌组织与癌旁组织中TRPM7 mRNA的表达水平比较

图2 GES-1细胞与各胃癌细胞株中TRPM7 mRNA的表达水平比较
2.2 胃癌组织中TRPM7 mRNA的表达水平与患者临床病理特征的关系
如表2所示,与T1~T2期患者比较,T3~T4期患者胃癌组织的TRPM7 mRNA表达水平较高;与Ⅰ~Ⅱ期患者比较,Ⅲ~Ⅳ期患者胃癌组织的TRPM7 mRNA表达水平较高;与无淋巴结转移患者比较,有淋巴结转移的患者胃癌组织的TRPM7mRNA表达水平较高,以上差异均有统计学意义(P均<0.05)。此外,TRPM7 mRNA在不同年龄、性别的患者中的表达水平差异均无统计学意义(P均>0.05)。结果提示胃癌组织的TRPM7 mRNA表达水平与病理分期、TNM分期及淋巴结转移有关。
2.3 构建差异表达TRPM7的胃癌细胞株
结果显示,与si-NC组比较,si-TRPM7组MGC-803细胞中TRPM7 mRNA的表达水平降低,差异有统计学意义(P<0.001);与Vector组比较,TRPM7组MKN-45细胞中TRPM7 mRNA的表达水平升高,差异有统计学意义(P<0.001)。见图3和图4。

图3 si-NC组与si-TRPM7组的TRPM7 mRNA表达水平比较
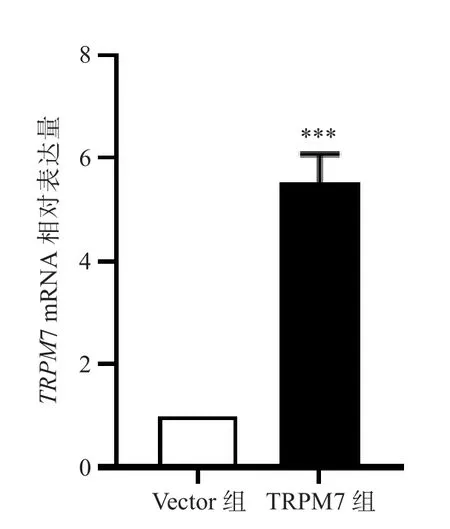
图4 Vector组与TRPM7组的TRPM7 mRNA表达水平比较
2.4 各组胃癌细胞凋亡率比较
流式细胞术检测结果显示,与si-NC组比较,si-TRPM7组的MGC-803细胞凋亡率升高,差异有统计学意义(P<0.001);与Vector组比较,TRPM7组的MKN-45细胞凋亡率降低,差异有统计学意义(P<0.001)。结果提示TRPM7可调控胃癌细胞的凋亡水平。见图5。
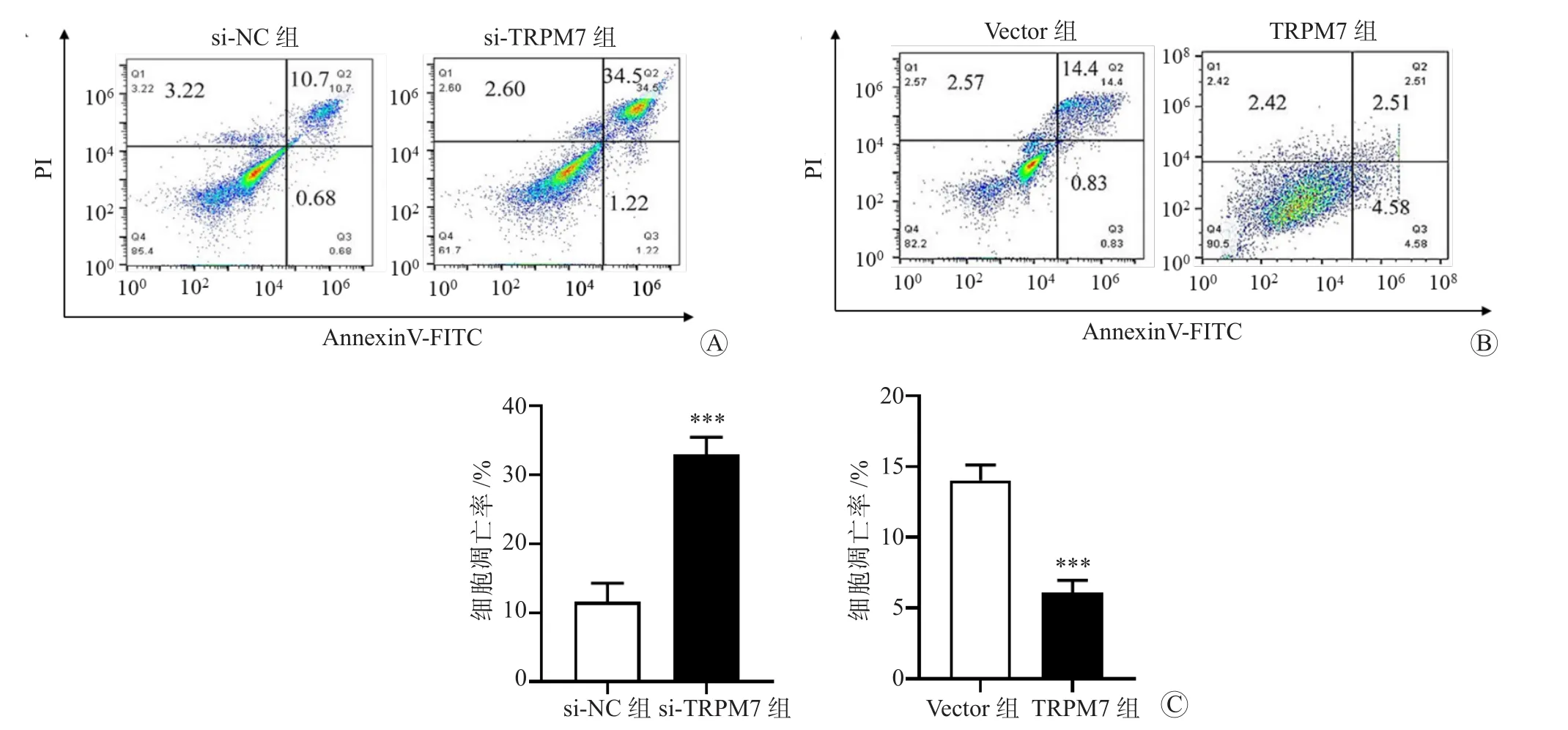
图5 流式细胞术检测各组细胞凋亡率 A si-NC组和si-TRPM7组MGC-803细胞 B Vector组和TRPM7组MKN-45细胞 C 各组细胞凋亡率柱形图
2.5 各组的自噬相关蛋白LC3-Ⅱ和p62表达水平比较
蛋白质印迹法结果显示,与si-NC组比较,si-TRPM7组MGC-803细胞中LC3-Ⅱ的表达水平降低,p62的表达水平升高,组间比较差异均有统计学意义(P均<0.001);与Vector组比较,TRPM7组MKN-45细胞中LC3-Ⅱ的表达水平升高,p62的表达水平降低,组间比较差异均有统计学意义(P均<0.001)。结果提示TRPM7可抑制胃癌细胞的自噬。见图6。
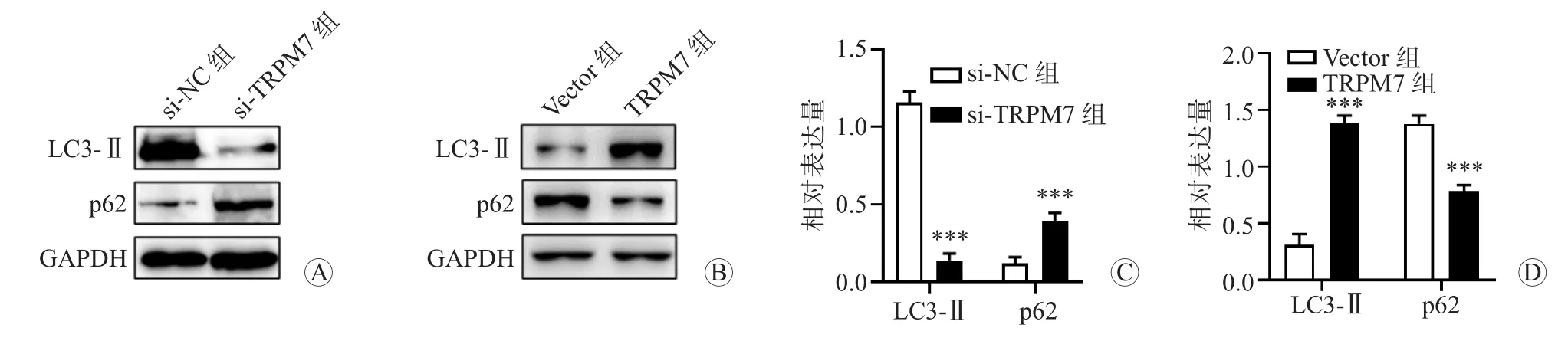
图6 蛋白质印迹法检测转染后各组细胞中自噬相关蛋白LC3-Ⅱ和p62的表达水平 A si-NC组和si-TRPM7组MGC-803细胞中LC3-Ⅱ和p62表达的蛋白电泳图 B Vector组和TRPM7组MKN-45细胞中LC3-Ⅱ和p62表达的蛋白电泳图 C si-NC组和si-TRPM7组MGC-803细胞中LC3-Ⅱ和p62表达的柱形图 D Vector组和TRPM7组MKN-45细胞中LC3-Ⅱ和p62表达的柱形图
2.6 各组PI3K、Akt和mTOR磷酸化水平比较
如图7所示,蛋白质印迹法结果显示,与si-NC组比较,si-TRPM7组MGC-803细胞中PI3K、Akt、mTOR磷酸化水平降低,组间比较差异均有统计学意义(P均<0.001),这提示沉默TRPM7可抑制PI3K/Akt/mTOR信号通路激活。如图8所示,与Vector组比较,TRPM7组MKN-45细胞中PI3K、Akt、mTOR磷酸化水平升高,组间比较差异均有统计学意义(P均<0.001),这提示TRPM7过表达可激活PI3K/Akt/mTOR信号通路。
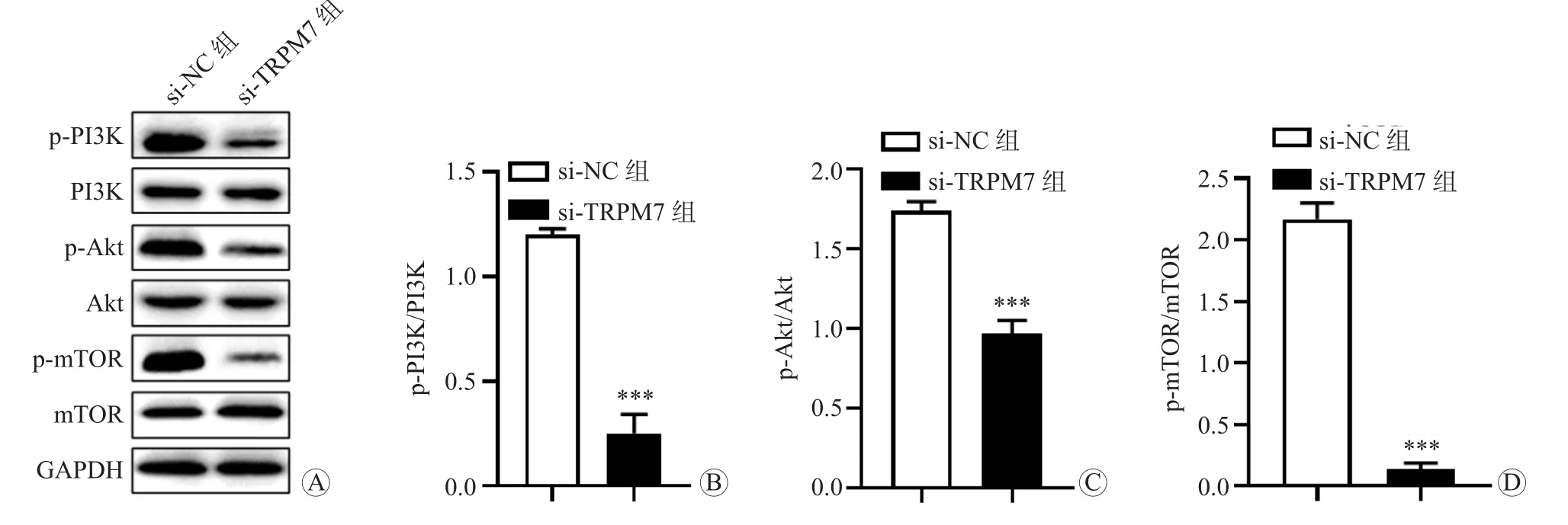
图7 蛋白质印迹法检测si-NC组和si-TRPM7组MGC-803细胞中PI3K、Akt和mTOR磷酸化水平 A 蛋白电泳图 B PI3K C Akt D mTOR

图8 蛋白质印迹法检测Vector组和TRPM7组MKN-45细胞中PI3K、Akt和mTOR磷酸化水平 A 蛋白电泳图 B PI3K C Akt D mTOR
3 讨论
TRPM7同时具有离子通道和蛋白激酶,其离子通道可调控Mg2+与Ca2+的平衡,还可调控细胞的增殖、凋亡和分化等,是细胞发育的关键调控因子[12]。近年来,TRPM7被报道在多种肿瘤的发生和发展中起着调控作用。Qin等[13]和Chen等[14]的研究表明,TRPM7在鼻咽鳞癌细胞中呈高表达,其可促进鼻咽鳞癌细胞的增殖并抑制细胞凋亡,并与患者的预后密切相关。韩晟等[15]的研究表明,TRPM7在口腔鳞癌细胞中高表达,并可通过调控PI3K/Akt信号通路和MAPK/细胞外信号调节激酶(ERK)信号通路增强口腔鳞癌细胞的增殖和迁移能力。吴鹏飞等[16]的研究表明,沉默TRPM7可通过调控PI3K/Akt/ERK信号通路而影响胶质瘤细胞的上皮-间充质转化。本研究结果显示,TRPM7在胃癌组织和胃癌细胞株中均呈高表达,且其在T3~T4期、Ⅲ~Ⅳ期、有淋巴结转移患者胃癌组织中的表达水平分别高于T1~T2期、Ⅰ~Ⅱ期、无淋巴结转移患者,这提示TRPM7可能与胃癌患者的病理进程相关。
TRPM7可以调控多种肿瘤细胞的凋亡。Song等[17]的研究表明,抑制TRPM7的表达可促进三阴性乳腺癌细胞凋亡。另有研究结果显示,干扰TRPM7表达可通过抑制PI3K/Akt信号通路的激活而发挥抑制人脑血管外膜成纤维细胞增殖并诱导其凋亡的作用[18]。本研究结果显示,在MGC-803细胞中抑制TRPM7表达后细胞凋亡率显著升高,在MKN-45细胞中过表达TRPM7后细胞凋亡率显著降低,这提示TRPM7可调控胃癌细胞的凋亡。
细胞自噬为肿瘤细胞提供了丰富的营养,从而促进肿瘤生长[19]。Oh等[20]的研究表明,TRPM7信号通路的激活可促进细胞自噬。Zhou等[21]的研究表明,TRPM7可影响PI3K/Akt/自噬通路的激活而促进内皮祖细胞血管生成。本研究结果显示,在MGC-803细胞中抑制TRPM7表达后细胞自噬相关蛋白水平显著降低,在MKN-45细胞中过表达TRPM7后细胞自噬相关蛋白水平显著升高,这提示TRPM7可调控胃癌细胞的自噬。
Nadolni等[22]的研究表明,TRPM7可调节Akt/mTOR信号通路。另有研究结果显示,PI3K/Akt/mTOR信号通路可影响胃癌细胞的生长、转移、自噬及表观遗传等多种病理过程[23]。本研究结果显示,在MGC-803细胞中抑制TRPM7表达后细胞中PI3K/Akt/mTOR信号通路被显著抑制,在MKN-45细胞中过表达TRPM7后细胞中PI3K/Akt/mTOR信号通路被激活。以上结果提示TRPM7可能通过调节PI3K/Akt/mTOR信号通路而影响胃癌细胞的凋亡和自噬。
综上所述,TRPM7在胃癌组织和胃癌细胞中呈高表达,可能通过调控PI3K/Akt/mTOR信号通路抑制胃癌细胞的凋亡和自噬。本研究存在一定不足,如未使用透射电镜观察自噬小体,今后需进一步探究并验证TRPM7是否能成为胃癌治疗的新靶点。
