基于exoRBase 数据库胰腺癌患者血液外泌体竞争性内源RNA 网络的构建*
2022-09-14朱康乐许李俊王崇宇王庆庆
朱康乐,许李俊,王崇宇,王庆庆**
(1 南通大学杏林学院医学部,南通 226007;2 南通大学附属医院普外科)
胰腺癌(pancreatic adenocarcinoma,PAAD)是消化系统常见的恶性肿瘤之一,恶性程度高,预后差。5年的存活率通常<5%[1]。早期发现和治疗是患者获得根治性治疗的唯一机会。然而,由于缺乏典型临床表现及特异性肿瘤标志物,PAAD 的早期筛查十分困难,约90%的PAAD 患者确诊时已处于晚期。因此,探索PAAD 诊断和治疗的潜在新靶点具有重要意义。
外泌体是一种直径为40~100 nm 的胞外盘状囊泡,由多种活性细胞特异性分泌,分布在唾液、乳汁和血浆等体液中,其内含有蛋白质、脂质及核酸等生物活性物质[2-3]。外泌体将生物活性物质转移到受体细胞或激活靶细胞中的信号传导途径来发挥细胞间通讯的关键功能,具有较高的临床治疗和诊断价值[4]。近年来研究者[5]发现非编码RNA 在生理功能调控中发挥着重要的作用。竞争性内源RNA(competing endogenous RNA,ceRNA)假说的提出,以及对包括微小RNA(microRNA,miRNA)和长链非编码RNA(long non-coding RNA,lncRNA)在内的多种ceRNAs在PAAD 中作用的研究,均为肿瘤的发生发展机制提供了重要线索及新的研究方向。
本研究对exoRBase 数据库中PAAD 患者和正常对照者的血液外泌体测序数据进行重新分析,发现mRNA、lncRNA 及环状RNA(circular RNA,circRNA)差异表达谱,并构建ceRNA 网络,为探索PAAD诊断和治疗的新靶点提供理论依据。
1 材料与方法
1.1 数据下载及筛选差异表达的mRNA、lncRNA、circRNA 从exoRBase 数据库(http://www.exorbase.org/)下载PAAD 患者和正常对照者的血液外泌体测序数据,同时下载相应的基因注释文件。整合出相应基因表达谱矩阵,采用基因注释文件对circRNA进行注释。分别对PAAD 患者和正常对照者外泌体中的mRNA、lncRNA 及circRNA 的表达谱进行差异表达分析,差异表达的筛选条件为|log2FC|>0,校正后的筛选条件为P<0.05。
1.2 相互作用miRNA 的预测及ceRNA 网络的构建采用TargetScan(http://www.targetscan.org/vert_71/)和miRanda(http://www.microrna.org/)数据库共同预测与差异表达mRNA 结合的miRNA。采用miRcode(http://www.mircode.org/)数据库预测与差异表达lncRNA 结合的miRNA,采用starBase(http://starbase.sysu.edu.cn/)数据库预测与差异表达circRNA 结合的miRNA。最后将相关的mRNA、circRNA、lncRNA 和其相对应的miRNA 预测数据导入Cytoscape(版本3.8.2)软件中对ceRNA 网络进行可视化。
1.3 差异表达mRNA 的功能富集分析 使用R 语言“org.Hs.eg.db”将差异表达mRNA 由Gene Symbol转换成entrez ID,然后使用R 语言“clusterProfiler”、“org.Hs.eg.db”、“enrichplot”和“ggplot2”对差异表达mRNA 进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析并进行可视化,以探索差异表达mRNA 可能起到的潜在作用或影响的潜在通路。
1.4 Hub 基因筛选 将得到的网络信息导入Cytoscape 软件,采用CytoHubba 插件计算每个蛋白节点的连接度得分,得分排名前10 个基因被确定为Hub 基因。
1.5 Hub 基因的表达和生存分析 采用表达谱交互分析数据库GEPIA(http://gepia.cancer-pku.cn)分析PAAD 和正常样本的基因测序表达数据。比较PAAD 患者和正常对照者中前10 个Hub 基因表达,并绘制对应Hub 基因的生存曲线。
1.6 统计学方法 使用Perl(版本strawberry-perl-5.32.)编程语言整理数据,使用RStudio(版本4.1.0)进行绘图及数据分析。计量资料以表示,采用t 检验或方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 数据下载及差异分析 从exoRBase 数据库中分别下载正常人群(n=32)和PAAD 患者(n=14)的测序数据。整合出mRNA 表达谱、lncRNA 表达谱和circRNA 表达谱矩阵,使用R 语言分别对mRNA、lncRNA 和circRNA 进行差异分析,筛选出差异表达mRNA(n=120)、差异表达lncRNA(n=48)、差异表达circRNA(n=23)(图1)。

图1 RNA 差异表达热图
2.2 miRNA 相关ceRNA 调控网络构建 采用TargetScan 和miRanda 数据库共同预测到与差异表达mRNA 相结合的miRNA(n=234),采用miRcode 数据库预测到与差异表达lncRNA 相结合的miRNA(n=623),采用starBase 数据库预测到与差异表达circRNA 相结合的miRNA(n=38)。Cytoscape 软件构建了ceRNA 网络,共19 个mRNA 节点、12 个lncRNA节点、3 个circRNA 节点、31 个miRNA 节点(图1)。
2.3 GO 和KEGG 通路富集分析 GO 注释富集分析显示,mRNA 主要富集在富含ficolin-1 颗粒腔(ficolin-1-rich-granule)和组蛋白脱乙酰酶结合(histone deacetylase binding);KEGG 富集分析显示调控网络中差异表达的mRNA 主要富集在黏附连接通路(adherens junction pathway)、结直肠癌通路(colorectal cancer pathway)和神经营养信号通路(neurotrophin signaling pathway)(图2)。
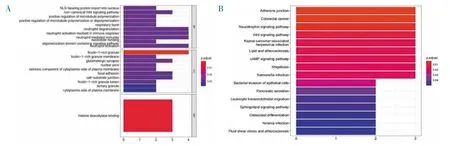
图2 GO 和KEGG 富集分析图
2.4 Hub 基因筛选 Cytoscape 软件分析共出10 个Hub 基因,2 个lncRNA:磷脂酰肌醇4-激酶α 假基因2(phosphatidylinositol 4-kinase alpha pseudogene 2,PI4KAP2)和通用转录因子Ⅱi 假基因1(general transcription factor Ⅱi pseudogene 1,GTF2IP1);1 个mRNA:RAC1;6 个miRNA:hsa-miR-23b-3p、hsa-miR-1297、hsa-miR-17-5p、hsa-miR-135a-5p、hsa-miR-20b-5p 和hsa-miR-129-5p;1 个circRNA:hsa_circ_0001360(图3)。
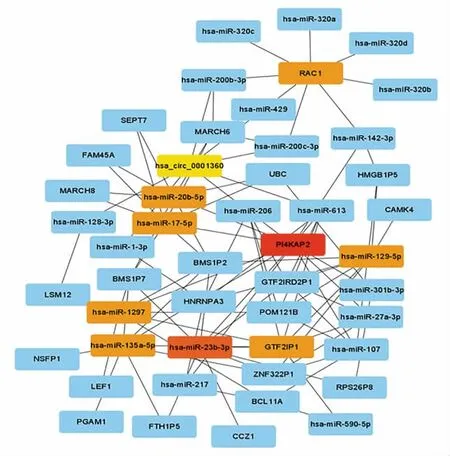
图3 ceRNA 网络中的Hub 基因
2.5 Hub 基因表达量和生存分析 采用GEPIA 进一步分析PI4KAP2、GTF2IP1 和RAC1 基因,结果显示:与正常对照者相比,PAAD 患者表达RAC1 基因水平明显升高,PI4KAP2、GTF2IP1 差异无统计学意义(图4)。生存分析结果显示:PI4KAP2 高表达组PAAD 患者的生存率明显高于PI4KAP2 低表达组,RAC1 低表达组PAAD 患者的生存率显著高于RAC1 高表达组(图5)。
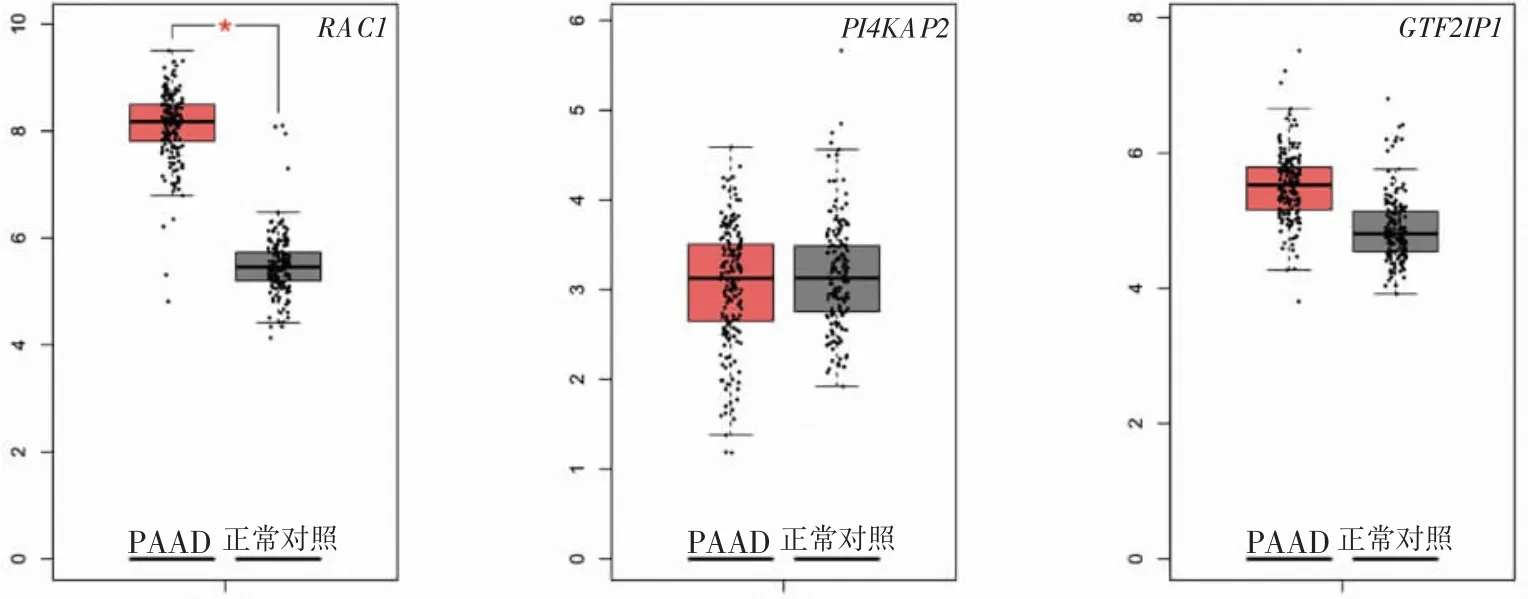
图4 PAAD 患者(n=179)与正常对照者(n=171)差异表达的基因

图5 Hub 基因PI4KAP2 和RAC1 的预后分析
3 讨论
PAAD 是消化道常见的恶性肿瘤之一,其发展迅速,早期发现率低,预后差,生存率极低[6-7]。因此,寻找PAAD 诊断与治疗的新靶点已成为亟待解决的问题。外泌体中含有丰富的生物活性分子,包括DNA、mRNA、miRNA 和蛋白质等,已成为近年来研究的热点。外泌体通过调控蛋白质表达和多种信号通路,在肿瘤发生发展等方面发挥生物学作用,具有重大的研究价值[8]。研究[9-10]表明PAAD 患者和健康成年人外周血中外泌体所含miRNA 表达存在显著差异,PAAD 患者血浆外泌体miRNA 水平的变化对早期临床诊断具有重要意义。而近年来,ceRNA 假说成为一种解释RNA 间相互作用的热门机制,非编码RNA 也成为多种疾病的研究热点[11]。作为转录后调控的一个重要因素,miRNA 的活性可通过“海绵”吸附的方式被lncRNA 调控。lncRNA 或circRNA 竞争性地与miRNA 结合,从而影响miRNA 导致的基因沉默,进而调节编码基因的蛋白质水平,参与靶基因的表达调控[12]。ceRNA 调控网络对PAAD 的发生和发展起着至关重要的作用[13]。但在PAAD 患者外周血中外泌体的ceRNA 调控机制仍有待进一步探究。
本研究确定了PAAD 发生相关的外泌体RNA,筛选出差异表达的mRNA、lncRNA 和circRNA 基因,同时构建相应的ceRNA 网络。已发现miR-217[14]、miR-429[15]可能成为PAAD 早期诊断、预后的新型标志物;miR-200b-3p 通过靶向下调血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)表达,进而抑制PAAD 细胞增殖、侵袭和迁移,并促进细胞凋亡[16];miR-17-5p 表达水平可用于早期诊断消化系统肿瘤,并可评价患者预后[17]。ceRNA 网络的构建成功确定了PAAD 发生发展的重要Hub 基因RAC1,RAC1 是Rho 三磷酸鸟苷(guanosine triphosphate,GTP)酶家族的成员,具有GTP 酶活性,是多种细胞信号转导过程中的“分子开关”,可参与肿瘤细胞迁移、黏附、增殖及凋亡等过程[18]。RAC1 在肿瘤细胞生理活动中发挥着重要作用,致瘤因素通过直接或间接途径上调RAC1 活性或表达,促进肿瘤的发生、发展,而下调RAC1 活性或表达则可减弱肿瘤的恶性行为[19]。田锐等[20]研究揭示RAC1 通过wntβ-Catenin 信号通路促进PAAD 细胞的增殖。李军辉等[21]研究也发现RAC1 在PAAD 组织中高表达,并与肿瘤的分期明显相关。RAC1 在PAAD 细胞株中呈现普遍表达,可增强癌细胞的增殖及侵袭能力。本研究采用GEPIA 分析发现PAAD 患者RAC1 基因表达水平明显升高,生存分析也发现RAC1 低表达组PAAD 患者的生存率显著高于高表达组。上述基础实验研究[20-21]也验证了RAC1 在PAAD 组织中高表达,促进PAAD 细胞的增殖,为后续研究PAAD 转移和治疗提供了确切的靶点。
但本研究存在收集的外泌体数据库中的样本量较少,未与GEO 和TCGA 等数据库进行联合分析,缺乏进一步的基础研究等局限性。因此,需要进一步的大样本临床试验验证和基础研究探索其具体作用机制。
