胃癌患者肿瘤血液免疫指标与术后并发症的关系分析
2022-09-14李晓辉
周 岳,李晓辉
1.西安大兴医院普外科,陕西西安 710000;2.陕西省渭南市蒲城县医院急诊科,陕西渭南 715599
胃癌是常见的消化系统恶性肿瘤,在全球发病率和病死率均较高[1],目前外科手术仍是其首选的治疗方法。胃癌术后并发症的高发生率仍然是困扰外科医生的难题,既往研究报道的并发症发生率在13.6%~46.0%[2-3]。术后若不能及时诊断及治疗并发症,可能导致患者术后恢复不良,病情恶化甚至死亡[4]。因此预防和减少术后并发症的发生是改善手术预后、提高胃癌患者术后生存率的重要环节。近年来,胃癌患者的肿瘤血液免疫指标与术后并发症之间的关系得到了较多的关注。因此,通过研究和明确血液免疫指标与肿瘤并发症之间的关系,期望能发现诊断的新指标及治疗的新靶点。现对西安大兴医院220例行胃癌根治术患者的肿瘤血液免疫指标与术后并发症进行回顾性分析,探讨二者之间的关系,以期提供临床参考依据,指导临床医生进行个性化的多模式治疗。
1 资料与方法
1.1一般资料 收集2017年7月至2020年3月在西安大兴医院普外科接受胃癌根治术的220例患者的临床资料,其中男122例,女98例,平均年龄(53.1±12.5)岁。根据术后有无并发症分为并发症组与无并发症组。收集所有患者的美国麻醉医师协会(ASA)分级、肿瘤最大径、手术方式、手术时间、术中出血量、淋巴结转移、肿瘤部位、病理分型、TNM分期、吻合方式等一般资料。
纳入标准:符合《胃癌诊疗规范(2018年版)》[5]的诊断标准;经胃镜及病理组织学检查确诊为胃癌;ASA分级Ⅲ级;年龄>18周岁;无严重心、肺、肝、肾等并发症。排除标准:接受姑息性胃切除术患者;发生远处转移或侵及周边器官和血管者;合并其他恶性肿瘤患者;严重的心肾功能异常患者或代谢系统疾病患者;严重出血或自身免疫系统疾病患者。
1.2方法 所有患者禁食水12 h后采其静脉血,采用全自动五分类血液分析仪(美国贝克曼库尔特公司)测得外周血白细胞计数、中性粒细胞计数、淋巴细胞计数和血小板计数,分别计算出血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)。采用免疫散射比浊法检测血清中C-反应蛋白(CRP)水平,相关试剂盒均购自武汉博士德生物有限公司。采用流式细胞仪(美国BD公司)检测外周血调节性T淋巴细胞(Treg)、辅助性T淋巴细胞17(Th17),并计算Th17/Treg及外周血T淋巴细胞亚群CD3+T细胞、CD4+T细胞、CD8+T细胞的比例,并且计算CD4+/CD8+。
1.3观察指标 观察并记录术后1个月内出现的并发症,包括肺部感染及胸腔积液、腹腔感染、腹腔出血、吻合口瘘、胃瘫、切口感染、十二指肠残端瘘等;比较两组患者围术期指标及手术相关情况(手术时间、术中出血量、ASA分级、手术方式及吻合方式),临床病理特征(肿瘤最大径、TNM分期、淋巴结转移、肿瘤部位及病理分型),血液免疫指标[术前1 d的血红蛋白(HGB)、清蛋白(ALB)、PLR、NLR、Th17/Treg、CRP、CD3+T细胞及CD4+/CD8+]等。

2 结 果
2.1术后并发症情况 220例患者中45例(20.5%)术后出现并发症,分为并发症组,其中腹腔感染6例,腹腔出血4例,吻合口瘘4例,胃瘫10例,切口感染5例,十二指肠残端瘘1例,肺部感染15例;其余175例(79.5%)未出现并发症,分为无并发症组。
2.2两组围术期指标及手术相关情况比较 两组患者在手术时间、术中出血量、ASA分级中比较,差异无统计学意义(P>0.05);手术方式及吻合方式比较差异有统计学意义(P<0.05),见表1。

表1 两组围术期指标及手术相关情况比较
2.3两组临床病理特征比较 两组患者肿瘤最大径、TNM分期比较差异均有统计学意义(P<0.05);淋巴结转移、肿瘤部位及病理分型比较,差异均无统计学意义(P>0.05),见表2。

表2 两组临床病理特征比较
2.4两组血液免疫指标比较 两组患者术前1 d的HGB、ALB、PLR、NLR指标比较差异均有统计学意义(P<0.05),见表3;两组患者术前1 d的Th17/Treg、CRP、CD3+T细胞及CD4+/CD8+比较差异均有统计学意义(P<0.05),见表4。
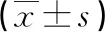
表3 两组术前1 d血液指标比较
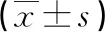
表4 术前1 d免疫指标比较
2.5术后并发症的多因素Logistic回归分析 以有无并发症作为因变量(Y),纳入上述差异有统计学意义的指标作为自变量(X)进行赋值,见表5。多因素Logistic回归分析结果显示:术前1 d的PLR≥165.9(OR=2.105,95%CI1.579~4.706),NLR≥2.7(OR=2.117,95%CI1.480~5.018),CRP≥9.4 g/L(OR=1.207,95%CI1.053~1.384)和Th17/Treg<28.1(OR=4.465,95%CI1.850~7.934),CD4+/CD8+<1.2(OR=2.403,95%CI1.658~5.103)是胃癌患者术后并发症的独立危险因素(P<0.05),见表6。

表5 研究变量及赋值

续表5 研究变量及赋值

表6 术后并发症的多因素Logistic回归分析
3 讨 论
胃癌是全球范围内最常见的恶性肿瘤之一,手术治疗仍是临床治疗胃癌的主要手段[6]。术后并发症是影响胃癌患者预后的重要危险因素,如肺部感染可引起患者发热、肺功能受损,是导致胃癌患者术后死亡的重要原因,十二指肠残端瘘可导致胆汁、胰液等十二指肠内容物大量丢失,引起持续发热、腹腔感染、休克,严重威胁患者的生命安全[7-8]。由此可见,术后并发症会严重影响胃癌患者的预后,因此尽早诊断、及时治疗具有重要的临床意义。近年来肿瘤与机体免疫、炎症状态的关系越来越受到重视[9]。肿瘤及周围组织慢性炎症反应诱导的淋巴细胞浸润,有助于肿瘤的发生[10]。有研究证实,恶性肿瘤细胞的侵袭与肿瘤细胞的特异性有关,尤其依赖于各种炎症因子相互作用的免疫微环境[11]。免疫细胞分泌的某些介质和细胞因子刺激机体产生一系列应激反应,从而导致免疫细胞、炎症细胞过度聚集,加重氧化损伤和其他负面生物效应,此机制促进正常细胞转化成肿瘤细胞,并增强了肿瘤的侵袭和转移能力[12]。PLR、NLR是全身炎症反应的标志物,可用来评估并监测机体抗肿瘤与促肿瘤免疫之间的动态平衡[13]。NLR和PLR与多种恶性肿瘤的术后并发症及预后相关。本研究中,PLR、NLR作为胃癌患者术后并发症的影响因素,其值越高,术后并发症发生率就越高。PLR、NLR升高是较好地反映炎症状态的指标,反映了机体对恶性肿瘤防御能力的减弱和细胞屏障的破坏,肿瘤的增殖与转移能力增强。Th17细胞为CD4+T细胞亚群,在Treg细胞分化中起负调节作用。Th17和Treg细胞之间的平衡控制了免疫应答,是辅助性T淋巴细胞作用于自身免疫疾病的重要调节因素[14-15]。有研究表明,Th17/Treg失衡可能在胃癌的发生和进展中发挥重要作用[16]。本研究结果显示,Th17/Treg失衡时越容易导致胃癌患者术后并发症的发生。CRP是在机体受到感染或组织损伤时血浆中一些急剧上升的蛋白质,可激活补体和加强吞噬细胞的吞噬,从而起调节作用,可清除入侵机体的病原微生物和损伤、坏死、凋亡的组织细胞[17]。目前临床多用CRP来判断患者术后全身炎症反应程度,并在一定程度上可预测患者预后情况。本研究结果显示,CRP水平越高,术后并发症发生率就越高。免疫系统是人体最重要的抗感染防御系统,T淋巴细胞亚群可反映机体免疫功能状况,机体的免疫功能降低,则发生感染的概率必然增大[18]。本研究结果显示,CD4+/CD8+越低,术后发生并发症的发生率越高。有研究显示,CD4+/CD8+过低是胃癌患者术后发生医院感染的独立危险因素,这也验证了胃癌患者的免疫功能与术后感染密切相关[19]。但本研究仍存在一定局限,仅分析了术后短期并发症,其具体预测机制仍待进一步研究。
综上所述,胃癌患者外周血PLR、NLR、CRP及Th17/Treg、CD4+/CD8+变化是术后并发症的影响因素,术前检测以上指标,可用于评估胃癌患者术后短期并发症的发生情况,从而指导个体化治疗。
