利用新型抗冻蛋白-内含肽标签高效纯化重组蛋白
2022-09-14郑延蓉,王从纲,孙佳明,李宪臻
郑 延 蓉, 王 从 纲, 孙 佳 明, 李 宪 臻
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
抗冻蛋白(AFPs)是一类最初在极地海洋鱼类中发现,能够特异性结合到冰晶表面抑制冰晶的进一步生长,降低水溶液的冰点而对熔点影响较小从而产生热滞效应的蛋白质[1-2]。其中,来源于南极鱼(Lycodichthyusdearborni)的AFP是一种分子质量为7 ku的球蛋白,不仅能特异性结合冰晶,而且具有优良的温度和pH稳定性[3]。研究发现,AFP与冰的结合是一种涉及分子间氢键、疏水相互作用、范德华力共同参与的特异性受体-配体相互作用[4]。利用AFP的冰结合特性,建立了以冰为吸附介质纯化AFP的方法,如使用带有温控系统的“手指”插入细胞破碎上清液中,或将细胞破碎上清液加入预先形成冰壳的圆底烧瓶中进行吸附从而纯化AFP[5-6]。
内含肽是未成熟前体蛋白中的一段肽段,通过一系列重排、转酯、环化等自催化过程将自身切除并将两端的多肽链通过肽键连接,将内含肽的N/C端关键氨基酸残基进行突变能够将原有剪接反应改造成特定末端的断裂反应[7-8]。由于内含肽的自催化剪接/断裂反应条件温和并且反应过程不需要其他蛋白或酶的辅助,因此在合成生物学、酶工程、蛋白分离纯化等领域中被广泛应用[9-10]。
本研究利用AFP的冰结合特性和Mxe GyrA内含肽的可控自切割特性,构建一种以冰为吸附介质,能够可控自切割的纯化标签MxeGyrA-linker-AFP,以谷胱甘肽硫转移酶(Glutathione S-transferase,GST)为模式蛋白考察纯化效果,以期为高效分离纯化重组蛋白提供新方法。
1 材料与方法
1.1 材 料
带有GST基因的质粒pGEX-4T-1和带有MxeGyrA基因的质粒pTWIN1,大连工业大学微生物资源与生物催化实验室保藏;大肠杆菌EscherichiacoliBL21(DE3),获赠于中科院大连化学物理研究所赵宗保研究员课题组;带有源于南极鱼Lycodichthyusdearborni的AFP基因和连接肽linker(PTPPTTPTPPTTPTPTP)基因的表达载体pET 24a-linker-AFP由苏州泓迅生物科技股份有限公司合成;GL 5000 bp DNA Marker,广州瑞真生物技术有限公司;低分子质量蛋白Marker、250 bp DNA Marker、限制性核酸内切酶QuickCutTMNdeⅠ和QuickCutTMHind Ⅲ、T4 DNA连接酶,宝生物工程(大连)有限公司;质粒小量抽提试剂盒、DNA胶回收试剂盒、IPTG、卡那霉素、胰蛋白胨、酵母粉,生工生物工程(上海)股份有限公司。
LB液体培养基:胰蛋白胨10.0 g/L,酵母粉5.0 g/L,氯化钠10.0 g/L;LB固体培养基:琼脂粉15.0 g/L,其余同LB液体培养基。
TB培养基:溶液1:胰蛋白胨12.0 g,酵母粉24.0 g,甘油4.0 mL,用去离子水定容至900 mL;溶液2:KH2PO42.31 g,K2HPO4·3H2O 16.4 g溶于100 mL去离子水;溶液1和溶液2以体积比9∶1混合。
1.2 方 法
1.2.1 引物设计
融合基因GST-MxeGyrA和表达载体的构建及鉴定所用引物由生工生物工程(上海)股份有限公司合成,使用的引物序列如表1所示。

表1 引物序列
1.2.2 重叠延伸PCR扩增融合基因GST-MxeGyrA
以质粒pGEX-4T-1为模板扩增GST基因。反应体系:模板4 ng,上下游引物P1/P2 10 μmoL/L各4 μL,5×PrimeSTAR Buffer (Mg2+Plus) 20 μL,d NTP Mixture (2.5 mmol/L) 8 μL, PrimeSTAR HS DNA Polymerase (2.5 U/μL) 1 μL, 加无菌水至总体积100 μL。第一轮重叠延伸PCR反应条件:95 ℃ 5 min,94 ℃ 30 s,55 ℃ 45 s,72 ℃ 60 s,30个循环,72 ℃ 5 min。以质粒pTWIN1为模板,利用上下游引物P3/P4扩增MxeGyrA基因,反应体系同GST基因的扩增,反应条件:95 ℃ 5 min,94 ℃ 30 s,65 ℃ 30 s,72 ℃ 60 s,15个循环;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,20个循环;72 ℃ 5 min。对目的基因进行回收,以回收的GST和MxeGyrA基因片段为模板进行第二轮重叠延伸PCR。GST25 ng,MxeGyrA25 ng,5×PrimeSTAR Buffer(Mg2+Plus) 20 μL,dNTP 2.5 mmol/L 8 μL,PrimeSTAR HS DNA聚合酶(2.5 U/μL) 1 μL,加无菌水至总体积92 μL。反应条件:95 ℃ 5 min,94 ℃ 30 s,58 ℃ 45 s,72 ℃ 90 s,10个循环;72 ℃ 5 min,反应结束后迅速加入上游引物P1和下游引物P4各4 μL,继续反应,反应条件:95 ℃ 5 min,94 ℃ 30 s,68 ℃ 45 s,72 ℃ 90 s,30个循环;72 ℃ 5 min。
1.2.3 pET24a-GST-MxeGyrA-linker-AFP表达载体的构建
将pET24a-linker-AFP和GST-MxeGyrA分别用限制性内切酶QuickCutTMNdeⅠ和QuickCutTMHind Ⅲ进行双酶切试剂盒回收目的基因和线性载体片段,用T4 DNA连接酶进行连接,之后转化至E.coliDH10B感受态细胞,涂布于含有50 μg/mL卡那霉素的LB固体平板。挑取单菌落利用引物P5/P6进行菌落PCR验证,将鉴定正确的菌落进行摇瓶培养并提取质粒,送吉林库美生物科技有限公司进行测序。
1.2.4GST-MxeGyrA-linker-AFP的异源表达
将pET24a-GST-MxeGyrAlinker-AFP转化至E.coliBL21(DE3),挑取阳性克隆于5 mL含50 μg/mL卡那霉素的LB液体培养基,37 ℃、200 r/min培养12 h得到种子液。将种子液按体积比1∶50转入含50 μg/mL卡那霉素的TB培养基,37 ℃、200 r/min培养至OD600为0.6~0.8时,加入终浓度0.5 mmol/L的IPTG,继续在16 ℃、200 r/min下培养20 h进行诱导表达。8 000 r/min、4 ℃离心收集菌体,用50 mmol/L pH 8.5的Tris-HCl缓冲液重悬后超声破碎,10 000 r/min、4 ℃离心得到上清和沉淀样品。
1.2.5 冰亲和纯化
1.2.5.1 冰壳制备
-40.0 ℃冷冻液的制备:100 g CaCl2·6H2O、 20 mL去离子水、50 g冰混合[11]。制冷液(-1.0~-1.5 ℃):将20 g CaCl2·6H2O、30 mL去离子水、68 g冰混合[6]。将冷冻液倒入泡沫盒中,用精密数字温度计实时监测温度。量取100 mL预冷去离子水倒入500 mL圆底烧瓶中,将圆底烧瓶浸没在冷冻液中,快速旋转1 min使圆底烧瓶中部分去离子水形成冰壳继续在冷冻液中旋转2 min,至冰壳出现分布均匀的裂缝。
1.2.5.2 冰亲和纯化融合蛋白
将细胞破碎上清液稀释为1 mg/mL,用冰水混合物进行预冷处理,之后缓慢滴加于圆底烧瓶中的冰壳表面,圆底烧瓶浸于制冷液中。利用旋转蒸发仪连接圆底烧瓶并控制其缓慢旋转,待吸附30 min后将未被吸附的样品溶液倒出。将1 mg/mL 的预冷细胞破碎上清液缓慢滴加于冰壳表面进行吸附,取吸附不同时间的剩余上清液样品进行SDS-PAGE检测。
1.2.6 内含肽断裂反应
断裂反应缓冲液:40 mmol/L DTT,1 mmol/L EDTA,pH 8.5的50 mmol/L Tris-HCl缓冲液,配制成5倍浓缩液。将利用冰亲和纯化得到的含目的融合蛋白溶液与5×断裂反应浓缩液以体积比4∶1混合,在25 ℃下孵育。
2 结果与讨论
2.1 重组质粒和菌株的构建及验证
以质粒pGEX-4T-1和pTWIN1为模板,采用重叠延伸PCR技术获得融合基因GST-MxeGyrA,同时在5′和3′端分别引入NdeⅠ和Hind Ⅲ酶切位点,并且在GST和MxeGyrA间引入3个氨基酸残基(MRM)以促进内含肽的断裂反应[11]。第一轮PCR结果如图1(a)所示,分别在500~750 bp扩增出单一条带,与含目的基因GST(694 bp)和MxeGyrA(644 bp)片段大小一致。试剂盒回收PCR扩增产物,作为第二轮PCR的模板。如图1(b)所示,第二轮PCR扩增产物在1 000~1 500 bp处出现条带,与1 283 bp的融合基因GST-MxeGyrA大小一致。
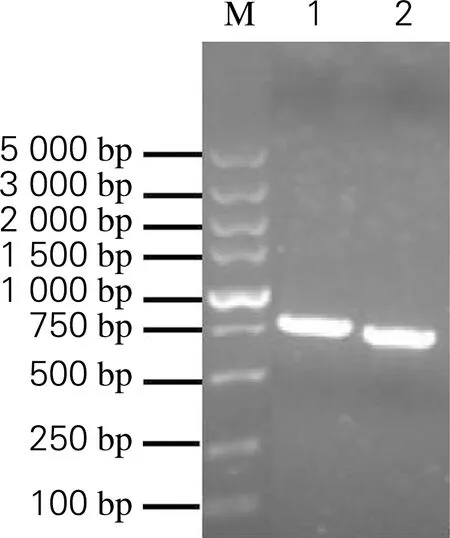
(a) 第一轮PCR
将融合基因和表达载体pET 24a-linker-AFP利用NdeⅠ和Hind Ⅲ进行双酶切和连接反应,并转化至E.coliDH10B中,利用含有卡那霉素的平板进行筛选。菌落PCR鉴定结果如图2所示。2~5号菌落经PCR扩增在1 500~2 000 bp处出现单一条带,与预期条带1 698 bp大小相符。将鉴定正确的菌落进行摇瓶培养并提取质粒后测序验证,结果表明成功构建重组质粒pET 24a-GST-MxeGyrA-linker-AFP。
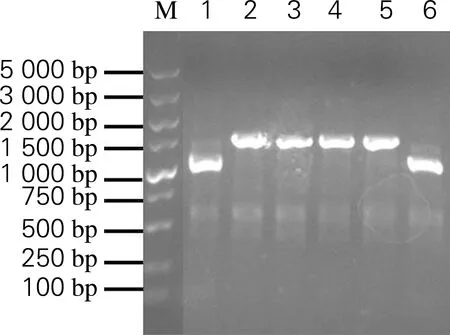
M,DNA Marker;1~6,重组质粒
2.2 融合蛋白的异源表达和冰亲和纯化
将重组质粒pET 24a-GST-MxeGyrA-linker-AFP转入E.coliBL21(DE3)中,利用IPTG进行诱导表达,菌体细胞超声破碎后低温离心分离上清液和不溶性沉淀,利用SDS-PAGE电泳进行检测,结果如图3所示,融合蛋白GST-Mxe GyrA-linker-AFP在理论分子质量56.12 ku处有条带,主要以可溶性形式存在于上清液中。

M,Protein Marker;1~4,分别为诱导前、诱导后、上清液、沉淀样品
利用冰对上清液中的目的蛋白进行吸附。结果如图4所示,利用冰亲和纯化能够有效富集目的蛋白。考察不同吸附时间下冰壳对融合蛋白的吸附效果,结果如图5所示。随着吸附时间延长,上清液中目的蛋白含量逐渐下降,30 min时上清液中目的蛋白含量已经明显下降。

(a) 冰壳
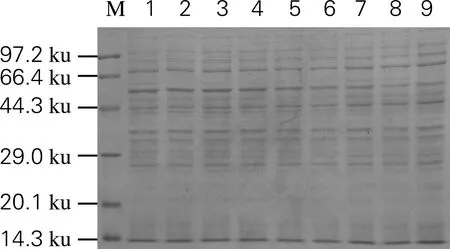
M,Protein Marker;1~9,吸附0、5、10、20、25、30、40、50、60 min后上清液
2.3 融合蛋白的断裂反应条件优化及目的蛋白的纯化结果
向融合蛋白GST-Mxe GyrA-linker-AFP样品加入断裂反应缓冲液,利用缓冲液中的DTT诱导Mxe GyrA内含肽的N端发生断裂反应从而得到目的蛋白GST(26.05 ku)和融合标签Mxe GyrA-linker-AFP(30.08 ku)混合物,考察断裂反应时间的影响,结果如图6所示。融合蛋白的断裂反应程度随着时间延长而增加,在25 ℃下反应6 h断裂反应已基本完成。

M,Protein Marker;1~9,分别为反应0、1/6、1/2、1、3、6、8、12、24 h样品
以冰为吸附介质处理断裂后的蛋白样品,将融合标签Mxe GyrA-linker-AFP通过冰吸附去除,最终得到含有目的蛋白GST的上清液,利用SDS-PAGE进行检测,结果如图7所示,通过冰吸附有效去除了融合标签,得到了高纯度目的蛋白GST,表明本研究构建的抗冻蛋白-内含肽标签能够用于重组蛋白的分离纯化。
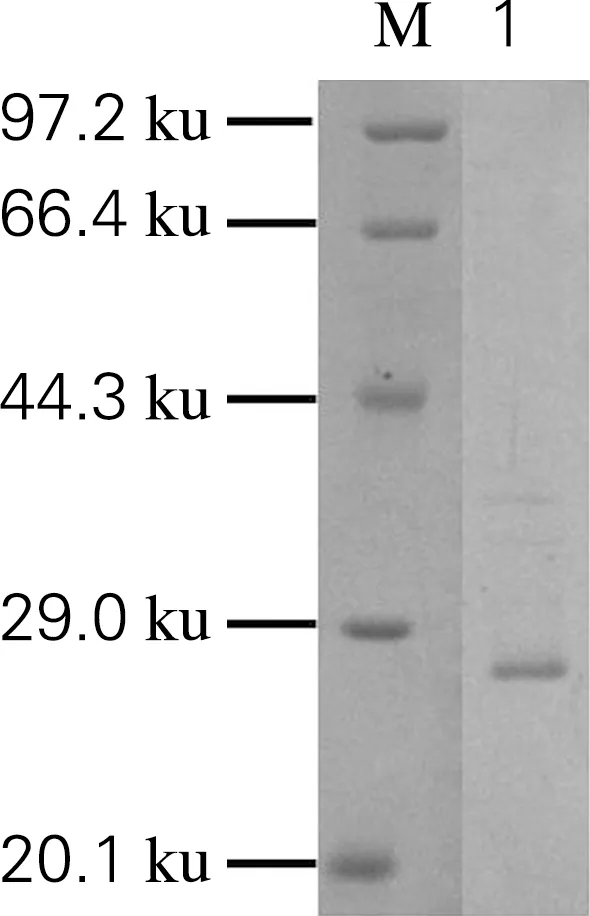
M,Protein Marker;1,去除标签后的样品
3 结 论
本研究以GST为模式蛋白,构建出表达载体pET 24a-GST-MxeGyrA-linker-AFP,在大肠杆菌BL21(DE3)中成功将该融合蛋白进行了可溶性表达。利用冰为吸附介质从细胞破碎上清液中一步纯化得到融合蛋白GST-Mxe GyrA-linker-AFP,利用内含肽的可控自切割反应和再次冰吸附除去纯化标签Mxe GyrA-linker-AFP从而得到高纯度目的蛋白,表明构建的新型抗冻蛋白-内含肽纯化标签能够有效集成AFP的冰结合特性和Mxe GyrA内含肽的可控自断裂特性,实现了低成本获得高纯度、切除标签的重组蛋白。
