环状RNA 在哺乳动物生殖发育中的功能研究进展
2022-09-14张翔栋汪薪许腾腾汝振远张梦雅刘秋晨闫业联张运海曹祖兵
张翔栋,汪薪,许腾腾,汝振远,张梦雅,刘秋晨,闫业联,张运海,曹祖兵
(安徽农业大学动物科技学院,地方畜禽遗传资源保护与生物育种安徽省重点实验室,安徽合肥 230036)
在细胞总RNA 中只有2%~5% 的信使RNA(mRNA)具有编码蛋白质的功能,被称为编码RNA,其余的RNA 被称为非编码RNA(non-coding RNA,ncRNA)。随着近年来研究者们对于ncRNA 探索研究的深入,ncRNA 中的一个亚类——环状RNA(circRNA)慢慢走进了科学家们的视线中,并成为了目前研究前沿的热点之一。circRNA 是一类以共价闭合的环状形式存在的特殊非编码RNA。1971 年,Diener 等在马铃薯纺锤块茎病中发现一些具有单链闭合RNA 结构的类病毒能够造成植株死亡。1976 年,Sanger 等首次报道某些高等植物类病毒以共价闭合的环形分子形式存在。1979 年,Hsu 等使用电子显微镜观察猴肾CV-1 细胞胞质,第1 次在真核细胞胞质中发现了circRNA。1991年,Nigro 等首次证实了人类细胞中存在内源性的、由外显子形成的circRNA,此后circRNA 开始逐渐被人们所重视。
近几年,随着测序技术的进步,在人类基因组中已经发现了约100 000 个circRNAs。有研究者在胎盘和胚胎中鉴定了circRNA 的存在,并表明circRNA可能在繁殖领域发挥重要作用。然而,研究内容主要集中在circRNA 的筛选和表达模式上,缺乏对circRNA功能的深入探索。为进一步挖掘circRNA 的功能和调控机制,本文对circRNA 的特征、形成机制、可能存在的生物学功能以及在哺乳动物生殖方面的研究进展进行综述,以期揭示circRNAs 的潜在作用及其与哺乳动物生殖发育的关系。
1 circRNA 的特征
与传统的线性RNA(Linear RNA)相比,circRNA 是通过反向剪接形成的闭合环状RNA 分子,不存在5'和3'端(图1)。大部分circRNAs 由外显子环化形成,其主要存在于细胞质中;少数circRNAs则是由内含子环化或者外显子和内含子共同环化形成,主要存在于细胞核中。由于circRNA 结构的特殊性,其对RNA 核酸外切酶(RNase R)具有高度抗性,所以circRNA 比线性RNA 更加稳定。circRNA 是古老的、高度保守的RNA 异构体,几乎在所有的生命体中都能够鉴定到circRNA 的存在。此外,circRNA 还普遍存在于各类组织和细胞中,并且具有细胞、组织以及发育阶段特异性的表达模式。随着身体发育阶段的改变或疾病的出现,circRNA 的丰度也会随之发生变化,这表明它们在生理和病理过程中可能具有重要的生物学功能。
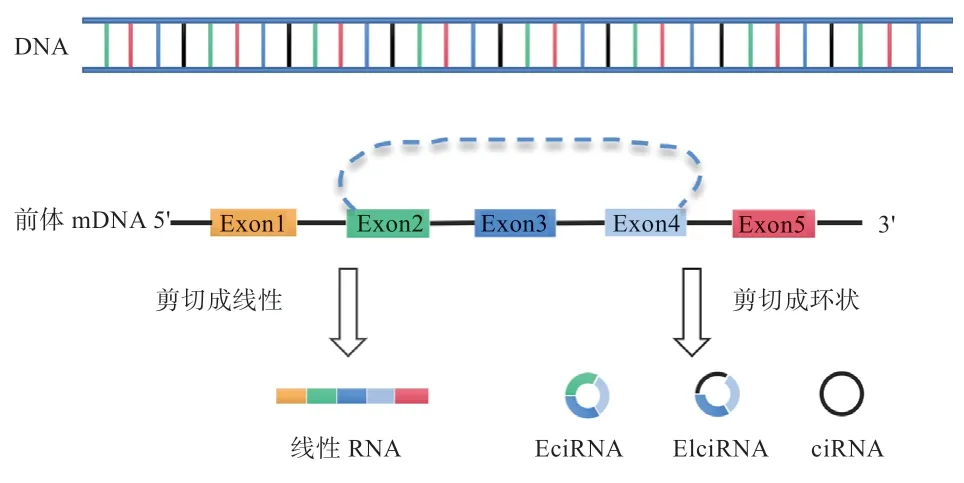
图1 前体mRNA 剪接形成线性RNA 和circRNA
2 circRNA 的分类及形成机制
circRNA 根据其序列来源主要可以分为3 类:仅含有外显子的circRNA(Exonic Circular RNA,EciRNA)、仅含有内含子的circRNA(Intronic Circular RNA,ciRNA)、外显子和内含子均含有的circRNA(Exonintron Circular RNA,EIciRNA)。circRNA 的形成主要是通过2 个存在于侧翼内含子中的假定剪接位点相结合,反向剪接所产生。有研究表明,在侧翼内含子中有超过30 nt 的互补重复序列就能够对环化产生促进作用,很多circRNA 的形成与互补重复序列呈现正相关。目前,涉及到反向剪接的机制主要有套索驱动环化、内含子配对驱动环化和RNA 结合蛋白配对驱动环化。
2.1 套索驱动环化 套索驱动环化主要分为外显子跳读(图2-A)和内含子套索驱动环化(图2-B)2 种类型。当前体mRNA 进行可变剪接时,可能会发生跳过外显子的剪接方式,影响mRNA 的形成。在外显子跳读过程中,先形成1 个包含外显子的套索中间体,然后移除其中的内含子,形成EciRNA;少数情况下内含子会被保留,形成EIciRNA。内含子套索驱动环化是目前普遍认可的ciRNA 形成机制。套索内含子的形成依赖于一个共有基序,该基序包含位于5' 端剪接位点附近的7 nt 富GU 基序和位于分支点附近的11 nt 富C 基序,共有基序能够帮助套索内含子逃避脱支酶诱导的脱支作用,使得内含子3' 端到分支位点的多余序列被核酸外切酶降解,从而形成ciRNA。
2.2 内含子配对驱动环化 在进行内含子配对驱动环化过程时,首先由环化外显子的侧翼内含子序列互补配对,形成稳定的碱基对,使剪接位点相互接近触发反向剪接事件。由于这种机制是下游外显子的5'端剪接位点直接与上游外显子的3'端剪接位点结合,所以又被称为直接反向剪接。目前认为内含子配对驱动环化(图2-C)是EciRNA 形成的主要机制,其需要顺式作用元件或反式作用因子才能使外显子剪接位点结合在一起,如反向ALU 重复元件(IARE)可以促进外显子环化。
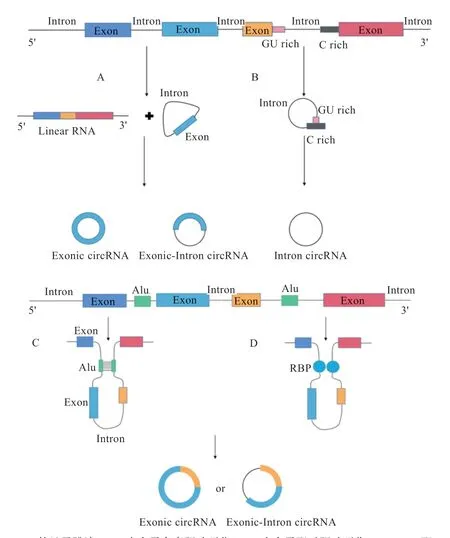
图2 circRNA 的生成过程
2.3 RNA 结合蛋白配对驱动环化 有研究发现,RNA结合蛋白(RNA Binding Protein,RBP)能够驱动环化产生circRNA,尤其对特异性circRNA 的产生具有重要作用。因为RBP 只能与含有特异性RBP 结合位点的侧翼内含子相结合,从而促进环化,所以只有在特异的结合位点存在的情况下,它们才可能发挥调控circRNA 形成的功能。此外,有研究发现盲肌蛋白MBL 可以促进circRNA 的形成;RNA 编辑酶ADAR1 能够抑制circRNA 的形成;RNA 结合蛋白Quaking(QKI)能够促进外显子环化。因此,RBP既可以通过桥接互补序列来促进环化,也可以通过抑制典型剪接来抑制环化。
3 circRNA 的分子调控机制
3.1 转录调控 circRNA 能够通过与特定的RNA 互作参与调控基因转录从而影响基因表达。ciRNA 和EIciRNA 主要定位于细胞核,它们能够与RNA 聚合酶II 相互作用共同调控亲本基因的转录(图3-A)。Zhang 等首次在人类细胞中发现了ciRNA,并证实ciANKRD52、ciMCM5 和ciSIRT7 能够在细胞核中与RNA 聚合酶II 结合,从而促进自身编码基因的转录。EIciRNA 能够在亲本基因的启动子区域与U1snRNP 形成复合物,后与RNA 聚合酶II 相互作用,从而增强其亲本基因的转录效率。EciRNA 主要定位于细胞质,有研究证明,EciRNA 的产生与外显子跳读呈正相关,而外显子跳读是前体mRNA 中最常见的选择性剪接方式,因此EciRNA 的产生可能会与线性mRNA 相互竞争(图3-B),当大多数外显子环化时,线性mRNA的表达量通常会下降,从而影响亲本基因的表达。
3.2 海绵功能 microRNA(miRNA)是一类由发夹前体衍生的含有20~24 个核苷酸的非编码RNA,它能够与3'端非翻译区(Untranslated Region,UTR)的部分碱基互补配对,从而调控哺乳动物中含有miRNA 反应元件(MicroRNA Response Elements,MRE)的靶向mRNA 的转录后抑制。网络数据库分析结果显示,哺乳动物中含有数千个circRNAs 携带预测的miRNA结合位点,提示了其作为竞争性内源RNA(ceRNA)的潜在作用(图3-C)。Memczak 等证明了circRNA CDR1as(ciRS-7)具有强大的miRNA 海绵作用,其能够靶向结合miR-7,从而提高miR-7 靶基因的表达水平。因此,circRNA 可以作为miRNA 海绵参与转录后调控。
circRNA 还可以作为RNA 结合蛋白(RNA Binding Proteins,RBP)的海绵(图3-D),通过与不同的RBP 结合形成RNA-蛋白质复合物,从而影响相关蛋白的表达。Ashwal 等研究发现由苍蝇和人类的盲肌(Muscleblind,MBL)衍生而来的circMBL 含有多个盲肌蛋白结合位点,其能够直接与盲肌蛋白结合,并且盲肌蛋白可以反过来调节circMBL 的形成。
综上所述,circRNA 能够通过吸附miRNA 从而发挥功能,但是考虑到circRNA 存在的miRNA 靶点数量问题,也有人认为大多数报道的circRNA 很可能不是标准的miRNA 海绵,而是在一个更大的转录后调控网络系统中发挥作用。
3.3 翻译功能 5'端的7-甲基鸟苷“帽子”(m7G)和3'端的ploy(A)尾结构对于线性mRNA 翻译至关重要,而circRNA 作为一种非编码RNA 并不具备这种结构,所以一直以来circRNA 被认为不具有翻译功能。后来有研究证实circRNA 也可以产生功能蛋白(图3-E),这打破了人们以往的认知。目前circRNA 的翻译机制主要分为2 种,即内部核糖体进入位点(Internal Ribosome Entry Site,IRES)介导的翻译模式(图3-F)、m6A修饰的翻译模式(图3-G)。翻译起始元件和开放阅读框 架(Open Reading Frame,ORF)是circRNA翻译蛋白质的2 个基本元件,由研究者设计的具有IRES 的circRNA 能够在体外翻译成蛋白质。后来发现一些内源性的circRNA 也具有IRES,并且可以进行翻译。例如,能够调控肌肉生成的circZNF609 可以翻译成多肽。2017 年Yang 等首次发现RNA 最丰富的碱基修饰——N6-甲基腺苷(m6A)也可以促进人类细胞中circRNA 的翻译启动,并且能够影响翻译效率。在人类转录组中发现的很多由m6A 修饰的circRNA 具有编码蛋白质的潜力。m6A 修饰和依赖IRES 的模式都是circRNA 翻译的潜在机制,Legnini 等研究发现在IRES 介导进而促进翻译的circZNF609 中能够检测到较高的m6A 甲基化水平,提示2 条途径之间可能存在一些关联。
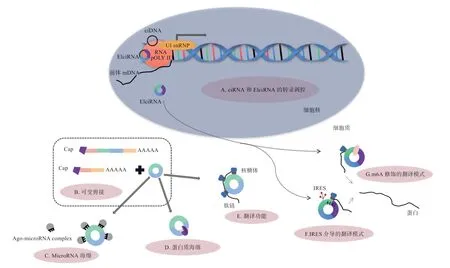
图3 circRNA 的分子调控机制
4 circRNA 在哺乳动物生殖发育中的功能
4.1 circRNA 调控下丘脑-垂体-性腺生殖轴激素的合成 下丘脑和垂体通过调节生殖激素的合成与分泌从而在生殖方面发挥重要作用。在下丘脑-垂体-卵巢(HPO)轴中,下丘脑产生的GnRH 到达并作用于垂体,促进垂体释放FSH 和LH 作用于卵巢,从而促进卵泡发育和排卵。Zhang 等对热应激母猪和正常母猪的脑垂体进行测序,在垂体中共鉴定出12 035 个circRNA,与正常母猪垂体相比,热应激母猪垂体中有59 个circRNA 的表达存在显著差异,其中42 个表达上调,17 个表达下调。通过预测circRNA-miRNAmRNA 调节网络发现一些circRNA 可能结合miRNA 共同调节垂体特异性基因和热休克蛋白家族成员,这表明circRNA 可能在垂体激素分泌和热应激反应中发挥作用。Chen 等对青春期及前后3 个阶段的长白和约克杂交母猪的垂体进行circRNA 测序,共鉴定出5 148个circRNA,其中有158 个circRNA 为首次发现,假设其为垂体特异性circRNA,对这些circRNA 的宿主基因进行KEGG 分析,结果显示这些宿主基因主要富集于催乳素信号通路、多巴胺能突触信号通路和神经活性配体-受体相互作用信号通路中。Li 等对发情期和乏情期绵羊的垂体前叶进行circRNA 测序,共鉴定出12 468 个circRNA,其中有9 231 个差异表达的circRNA,通过对这些差异表达的circRNA 进行KEGG分析,发现其主要与雌激素信号通路、促性腺激素释放激素信号通路相关,提示circRNA 在绵羊发情中参与垂体调节的潜在作用。Zhang 等在绵羊下丘脑中鉴定出41 863 个circRNA,在多胎和单胎绵羊的卵泡期有333 个circRNA 差异表达(162 个上调,171 个下调),黄体期有340 个circRNA 差异表达(163 个上调,177个下调),对这些差异表达的circRNA 进行功能分析,发现其中大多数circRNA 参与调控GnRH 的活性或关键基因的表达进而调控绵羊生殖。La 等对多胎和单胎绵羊的子宫进行circRNA 测序,在卵泡期和黄体期分别鉴定出147 个和364 个circRNA 呈现差异性表达,通过GO 和KEGG 分析发现这些circRNA 主要富集于促性腺激素释放激素信号通路,这与Zhang 等的研究结果存在一定的相关性。
4.2 circRNA 在精子发生中的作用 Chioccarelli 等通过circRNA 测序在人类精子细胞中鉴定出10 726 个circRNA,其中84.6%来源于外显子区域;通过对比高活力和低活力精子circRNA 的表达数据,分析出148个具有显著差异表达的circRNA,对这些circRNA 的宿主基因进行KEGG 通路分析,结果显示其主要与DNA 复制、RNA 运输和降解、细胞周期以及类固醇生物合成等信号通路高度相关,提示这些circRNA 可能在胚胎发育的起始阶段发挥作用。此外,Gòdia 等在猪精子中鉴定出1 598 个circRNA,其中82.1%来源于外显子区域,通过与已发现的人、鼠、猪circRNA数据进行对比,发现在猪精子中具有高度特异表达的circRNA,对这些circRNA 的宿主基因进行GO 分析,结果显示宿主基因主要参与表观遗传修饰、精子发生以及纤毛组装等过程,并提示一些circRNA 如ssc_circ_1458 和 ssc_circ_1321 与精子运动特性存在着显著相关性。Dong 等研究显示,circRNA 在各类精细胞中大量表达,如在圆形精母细胞中有7 220 个,细线期精母细胞中有6 689 个,在粗线期精母细胞中有4 467个,提示circRNA 在精子分化中具有差异化的潜在调控作用。Tang 等进一步研究发现,在粗线期精母细胞发育成精子的过程中,circRNA 的数量和丰度都显著升高,而对应的线性RNA 的水平显著降低,提示精子中circRNA 水平的上升可能是一些重要转录本提高自身稳定性的机制,以确保精子形成晚期一些关键蛋白的持续产生,GO 分析结果显示这些宿主基因可能参与了精子发生过程中的关键事件,主要在表观遗传调控(DNA 甲基化、组蛋白修饰和核小体组织)和精子运动(纤毛运动、轴丝组装和微管束形成)等方面发挥作用。睾丸组织作为雄性生殖系统的重要组成部分,不仅为精子生成提供重要的场所,还为保障精子的正常发育起到至关重要的作用。Zhang 等在仔猪睾丸和性成熟猪睾丸中发现了大量的差异表达circRNA,GO 分析表明其可能参与精子发生和激素合成,为评估猪睾丸发育情况提供潜在的生物标记物。综上所述,睾丸和精子来源的circRNA 主要来源于基因的外显子区域,根据宿主基因的位置,它们广泛分布在包括线粒体基因组在内的所有染色体上。GO 分析表明,这些circRNA 主要参与生殖细胞进程、减数分裂事件、表观遗传修饰、精子活力和受精等过程,从而在雄性生殖方面发挥关键作用。
4.3 circRNA 在卵泡发育和卵母细胞成熟中的作用 Hu等对麻城黑山羊和波尔山羊的排卵前卵泡进行了circRNA 测序,在山羊排卵前卵泡中共鉴定出13 950个circRNA,其中有13 527 个circRNA 来源于827 个宿主基因;对这些宿主基因进行GO 和KEGG 富集分析,发现大多数宿主基因参与细胞发育过程,如转移酶活性、新陈代谢等;还有一些宿主基因与重要的信号通路如促性腺激素释放激素(GnRH)信号通路、促性腺激素调节的卵母细胞成熟等也存在相关性,研究人员还分析出37 个差异表达的circRNA,并证实chi_circ_0008219 能够结合卵泡发育相关的miRNA。这些结果表明circRNA 在山羊卵泡发育中具有的潜在作用。Xie 等对梅山猪和杜洛克猪中等大小的M2 期卵泡进行circRNA 测序,鉴定出15 866 个circRNA,其中有244 个circRNA 的表达存在差异,对这些差异表达circRNA 的宿主基因进行GO 和KEGG 分析,结果显示它们可能参与卵泡发育信号通路。Fu 等利用BMP15、GDF9 和BMP15+GDF9 对牛卵丘细胞进行体外处理,并对各组卵丘细胞进行circRNA 测序,预测出1 706 个circRNA,分析各处理组与对照组之间circRNA 的差异表达,发现BMP15 和GDF9 可能通过circRNA 海绵吸附miRNA 来调控靶基因,从而调节牛卵丘细胞的形态发生,影响卵泡发育。CircRNAs在卵母细胞成熟中的作用尚未得到广泛研究。2019 年Shen 等报道circRNA 能够作为miRNA 海绵调节多种生殖途径,如卵母细胞减数分裂,GnRH 信号和孕酮介导的卵母细胞成熟。同年,Cao 等以猪为模型,在猪卵丘细胞和卵母细胞中分别鉴定出7 067 个和637个circRNAs,发现敲低circARMC4 会导致减数分裂期间染色体排列和第一极体运动异常,进一步影响了猪早期胚胎发育。Cheng 等分析发现,与30 岁体外受精患者相比,38 岁体外受精患者颗粒细胞中有46个circRNA 表达上调,11 个circRNA 表达下调,其中circ_103827 和circ_104816 的表达与优质胚数呈负相关;GO 分析显示这2 个circRNA 可能在葡萄糖代谢和有丝分裂细胞周期中发挥作用,提示circ_103827 和circ_104816 可能作为卵泡微环境受损的潜在指标,用于预测辅助生殖结果。上述研究也提示了一些特异性的circRNA 或许能够作为疾病诊断的标志物,为相关生殖疾病的诊断和治疗提供依据。
4.4 circRNA 与胚胎着床前发育紧密关联 早期胚胎发育是生殖领域中的重要环节。哺乳动物胚胎发育起始于受精卵,受精卵在输卵管向子宫移行过程中伴随着胚胎细胞分裂增殖、桑椹胚致密化和囊胚形成等形态学变化,在分子水平上也发生着一系列精细的改变,如卵母细胞库RNA 降解和胚胎基因组转录激活等事件。circRNA广泛存在于组织和细胞中,其丰度通常随着发育阶段而发生变化,探索circRNA 在各类生殖细胞中的表达模式对于后续揭示circRNA 在生殖领域的功能尤为重要。
Dang 等利用单细胞测序技术对人类植入前胚胎进行circRNA 测序,结果显示鉴定的10 032 个circRNA 来源于2 974 个宿主基因,这些circRNA 的表达呈现发育阶段特异性特征。通过对2 974 个宿主基因进行GO 分析,发现这些circRNA 可能参与细胞器组织、染色体组织和染色质修饰过程。Fan 等对小鼠早期胚胎进行circRNA 测序,共预测了2 891 个circRNA,来源于1 316 个宿主基因,大多数circRNA 的长度在0~2 kb,对1 316 个宿主基因进行GO 分析,结果显示这些circRNA 可能参与染色体组织和染色质修饰过程。Dang 等将人和小鼠早期胚胎的测序结果进行比较分析,发现小鼠植入前胚胎中鉴定出的circRNA 和宿主基因的数量远低于在人类植入前胚胎,主要原因可能是物种之间的差异性以及进化程度的不同,在人和小鼠早期胚胎中鉴定到的circRNA 宿主基因中,相同的宿主基因有835 个,表明circRNA 的形成在人和鼠之间是保守的。这些相同的宿主基因参与了早期胚胎形成中的一些关键事件,提示了它们可能在早期胚胎形成过程中具有不可替代的重要功能。目前已有研究发现一些circRNA 在滋养层细胞增殖、迁移和侵袭方面发挥着重要的功能,对胚胎的正常着床也有重要影响。鉴于circRNA 的保守性,可以假设其他物种的早期胚胎中也含有这些保守的宿主基因,进而通过多物种对比的方式筛选出最保守的宿主基因,为研究早期胚胎发育过程中发挥重要功能的circRNA 提供方向。
4.5 circRNA 调节干细胞的多能性状态 胚胎干细胞(Embryonic Stem Cell,ESCs)是从早期囊胚的内细胞团或原始性腺中分离出来的一类细胞,其具有体外培养无限增殖、自我更新和多向分化的特性,探索调控ESCs 多能性的维持和自我更新的机制对了解哺乳动物早期胚胎发育和细胞组织分化过程十分重要。近年来,随着诱导多能干细胞(Induced Pluripotent Stem Cells,iPSC)技术的逐渐成熟,其主要在疾病建模、药物发现以及再生医学等领域具有广阔的应用前景,但有关circRNA 在胚胎干细胞中的功能性研究仍有待探索。
Yu 等在人类胚胎干细胞中证明了circBIRC6和circCORO1C 在功能上与多能性状态相关,其中circBIRC6 能够通过吸附miR-34a 和miR-145,影响靶基因mRNA 的表达,从而维持多能性状态。Barilani 等通过高通量测序分析构建出人胎儿来源型诱导多能干细胞circRNA 表达谱,提示circRNA 可能参与调控多能干细胞的未分化状态,从而在胚胎发育过程中发挥重要功能。Cherubini 等首次描述了circRNA 在控制人类间充质干细胞(MSC)特征和分化中的作用,通过对来源于人骨髓与脐带血的原代间充质干细胞和人皮肤成纤维细胞进行circRNA 测序,证明了circFOXP1 是未分化MSC 的标志物,其与miR-17-3p/miR-127-5p 相互作用,从而影响干性和分化相关信号通路以维持MSC 的增殖和自我更新。在ESCs 中,Oct4、Sox2 和Nanog是组成多能性调控网络的核心转录因子。Li 等通过对雄性和雌性小鼠生殖干细胞进行circRNA 测序,构建了circRNA 差异表达谱,揭示了circRNA 可能与生殖干细胞的性别特异性分化有关。Zhang 等在人源胚胎干细胞中发现了上千条circRNA,并揭示了内含子互补序列配对所介导的circRNA 形成机制。综上所述,circRNA 在干细胞多能性维持和促进体细胞重编程效率方面均有明显的作用。
5 展 望
circRNA 作为一种新型的非编码RNA,其拥有广泛性、稳定性和特异性等生物学特性且具有调控基因表达的重要功能。近年来,随着生物信息技术和高通量测序方法的逐渐发展,哺乳动物生殖领域中有越来越多的circRNA 被鉴定出来。circRNA 的发现为筛选诊断和治疗生殖疾病的标志物提供了方向,为深入剖析生殖细胞和胚胎发育过程中的调控机制增加了一层新的调控网络,也为研究哺乳动物生殖发育开拓了新视角。高通量测序研究结果丰富了circRNAs 在配子、胚胎和干细胞等组织中的转录组学数据,为进一步探索其在配子发生、胚胎发育和干细胞多能性调节等方面的机制奠定了基础。同时,尚不清楚新出现的circRNA 与RNA、蛋白质之间存在的复杂调控网络是否会打破过去所认知的调控机制。目前对circRNA 在哺乳动物生殖领域中的研究仍处于起步阶段,其在生殖领域中发挥的重要生物学功能仍需深入探索。相信随着研究者们对circRNA 的努力挖掘,有关circRNA 在生殖领域的研究会取得更大进展。
