H2O2对吸胀冷害下花生种子萌发的影响
2022-09-13崔亚男张朋磊臧秀旺
崔亚男 张 曼 张朋磊 刘 兵 郝 西 臧秀旺
(河南省农业科学院经济作物研究所,450002,河南郑州)
花生(Arachis hypogaea L.)是我国重要的经济和油料作物,也是我国食用蛋白和食用植物油的重要来源[1-2]。花生是一种喜温作物,在我国黄淮海流域早春播种的花生遇到低温天气时易出现出苗不齐和苗弱小的现象。种子在发芽过程中,根据吸水速率、发芽时间及后期生长可分为3个阶段,分别为吸胀阶段、吸水变慢并达到顶峰时期以及发芽后期,其中吸胀阶段对低温胁迫最为敏感[3-4]。喜温农作物种子若在吸胀期遇到0℃~12℃低温,常发生吸胀冷害[5],此时的种子活力降低,出苗率和成苗率下降。种子吸胀冷害在多种农作物上发生,已成为全球农业生产中亟待解决的重要问题之一[6]。因此,研究花生种子萌芽期抗寒的调控技术和耐寒生理机制,对指导花生及其他农作物的生产具有深远意义。
过氧化氢(H2O2)是植物体内各种生理代谢的副产品,当植物受到非生物和生物胁迫时,它的含量迅速升高,过量H2O2会对细胞产生毒害作用,而适宜浓度的H2O2可作为信号物质调控植物体内一系列的生理生化反应以及减轻逆境带来的伤害[7-8]。朱利君等[9]研究发现,用0.3% H2O2对黄瓜浸种可介导抗氧化酶系统,调控脱落酸(ABA)和赤霉素(GA)的含量来缓解盐胁迫对种子萌发的抑制作用。张曼等[10]研究发现,利用0.05% H2O2浸种能诱导油菜种子抗寒基因的表达和提高酶活性,达到促进种子萌发的作用。耶兴元等[11]研究表明,H2O2通过调控抗氧化酶系统增强草莓苗的抗冷性。张美华[12]研究表明,H2O2通过调控玉米的渗透调节物质可减弱低温对玉米萌发的影响。然而H2O2浸种对花生的萌芽及调控萌芽期的生理机制的影响研究仍不完善。
本研究以当前河南省主推花生品种豫花9326和豫花37为材料,研究H2O2浸种对吸胀冷害下花生品种的露白率、发芽势和发芽率等发芽相关指标和膜脂过氧化产物、渗透调节物质及内源激素含量的影响,探究H2O2浸种对吸胀冷害下花生种子萌发的影响和促进种子萌发的生理机制,为研发花生萌芽期耐寒性的调控技术提供理论依据。
1 材料与方法
1.1 试验材料
试验以高油花生品种豫花9326和高油酸花生品种豫花37为材料,材料均由河南省农业科学院经济作物研究所提供。豫花9326的基本性状为普通大果型、直立疏枝、连续开花、籽仁含油量56.67%、油酸含量36.6%;豫花37的基本性状为珍珠豆型、直立疏枝、连续开花、籽仁含油量55.96%、油酸含量77.0%。
1.2 试验设计
采用智能人工气候箱(宁波莱福科技有限公司,型号:FPG3型)进行萌发试验。根据前期预试验结果(未发表),H2O2浸种浓度选用50mmol/L,低温(5℃)浸种48h是参照唐月异等[13]的试验方法略加改动。试验设置2个处理,分别为低温(5℃)灭菌水浸种(CK)和低温50mmol/L H2O2浸种(A1),每个处理重复3次。
1.2.1 种子消毒与浸种 每个重复挑选大小一致、饱满的种子30粒,称重记录,种子用0.5%次氯酸钠消毒5min,期间不断搅拌,消毒后的种子用无菌水冲洗3遍。在5℃黑暗条件下,将消毒后的种子分别在灭菌水和50mmol/L H2O2中浸泡48h。
1.2.2 种子萌发 浸种结束后,将种子放入铺有2层无菌水浸湿滤纸的培养皿中,25℃黑暗条件下培养6d,期间每天调查萌发和发芽数,计算第4天的发芽势和第6天的发芽率,并注意观察补充灭菌水。
1.3 测定指标及方法
1.3.1 种子浸出液电导率 浸种结束后,用电导率仪[梅特勒-拖利多仪器(上海)有限公司,型号:S230]测定各处理种子浸出液电导率。电导率的计算公式如下:电导率[μS/(cm·g)]=(处理液测定值-空白对照测定值)/种子干重。
1.3.2 种子发芽相关指标 将胚根突破种皮视为露白,胚根≥2mm视为发芽。计算各处理的露白率、发芽势、发芽率以及发芽指数。相关公式如下:露白率(%)=(露白种子数/种子总数)×100,发芽势(%)=(第4天的发芽数/种子总数)×100,发芽率(%)=(第6天的发芽数/种子总数)×100,发芽指数=∑(Gt/Dt),其中Gt为第t天种子的发芽数,Dt为发芽天数。
1.3.3 生理指标及激素含量 为进一步探究H2O2浸种促进吸胀冷害下花生种子萌发的生理机制,在萌发的第0、4、6天测定了豫花9326种子的丙二醛(MDA)、可溶性糖、可溶性蛋白及内源激素含量。在发芽的第0、4、6天,挑选各处理长势均匀的种子分别放入液氮中快速冷冻,然后放-80℃超低温冰箱保存,采用苏州科铭生物技术有限公司试剂盒(微量法)测定MDA、可溶性糖、可溶性蛋白、ABA及GA含量。
1.4 数据处理
利用Microsoft Excel 2007和SPSS 25.0进行数据统计、分析和作图。利用最小显著差异法(LSD)进行差异显著性分析。
2 结果与分析
2.1 H2O2浸种对种子电导率的影响
由图1可知,与CK处理相比,A1处理降低了2个花生品种的电导率,豫花9326降低幅度更大。豫花9326和豫花37处理组的电导率分别为2.67和4.57μS/(cm·g),较对照组分别降低了47.67%和23.67%,差异均达到了显著水平(P<0.05)。
2.2 H2O2浸种对花生种子露白率的影响
由表1可知,萌发第3天CK处理下豫花9326和豫花37的露白率分别为75.76%和66.67%,A1处理分别为96.97%和85.71%,比CK处理分别提高了28.00%和28.56%,差异均达到了显著水平(P<0.05)。萌发第6天豫花9326的CK和A1处理露白率分别为89.39%和96.97%,A1处理比CK处理提高了8.48%,豫花37的CK和A1处理露白率均为92.06%。由此可知,H2O2浸种能提高吸胀冷害下2个花生品种的露白率。
2.3 H2O2浸种对花生种子发芽特性的影响
由表2可知,与CK处理相比,A1处理的发芽势、发芽率和发芽指数均有所提高。其中豫花9326的发芽势、发芽率和发芽指数分别提高了31.25%、18.52%和50.53%。与CK处理相比,A1处理下豫花37的发芽势、发芽率和发芽指数分别增加了14.58%、3.64%和36.13%。经方差分析,豫花9326的对照组和处理组,发芽势和发芽指数的差异均达到了极显著水平(P<0.01),发芽率的差异达到了显著水平(P<0.05);豫花37发芽势和发芽率差异均不显著(P>0.05),发芽指数差异达到了显著水平(P<0.05)。综上可知,H2O2浸种处理可提高吸胀冷害下豫花9326和豫花37的发芽势、发芽率和发芽指数。

表2 H2O2浸种对花生种子发芽特性的影响Table 2 Effects of H2O2soaking treatments on the germination characteristics of peanut seed
根据电导率值、萌发率、发芽势、发芽率及发芽指数可以得出,在吸胀冷害下,H2O2浸种处理能提高种子的发芽能力,其中豫花9326更能响应H2O2这种促进发芽作用。
2.4 H2O2浸种对花生种子MDA含量的影响
由图2可知,随萌发时间延长,CK处理的MDA含量不断增加,与第0天相比,第4和6天的MDA含量均显著提高,其中第6天的MDA含量增加了44.27%。A1处理下MDA含量呈先增加后降低的趋势,与CK处理相比,A1处理第0、4、6天MDA的含量分别降低了0.22%(P>0.05)、7.05%(P<0.05)和32.55%(P<0.05)。根据以上试验结果可知,在萌发的过程中,A1处理的MDA含量均低于CK处理。

图2 H2O2浸种对花生种子MDA含量的影响Fig.2 Effects of H2O2soaking treatments on MDA content of peanut seed
2.5 H2O2浸种对花生种子渗透调节物质含量的影响
如图3a所示,在种子萌发第0天,即低温浸种结束时,A1处理的可溶性糖含量显著高于CK处理(P<0.05)。随着萌发时间的延长,CK处理和A1处理可溶性糖含量均有所增加,但A1处理均高于CK处理。在萌发的第0、4、6天,与CK处理相比,A1处理可溶性糖含量分别提高了48.27%、53.42%和52.29%,差异均达到显著水平(P<0.05)。
在种子萌发期间,豫花9326种子A1处理的可溶性蛋白含量高于CK处理(图3b)。在萌发的第0、4、6天,与CK处理相比,A1处理种子的可溶性蛋白分别提高了59.66%、13.04%和43.76%,差异均达到了显著水平(P<0.05)。

图3 H2O2浸种对花生种子渗透调节物质含量的影响Fig.3 Effects of H2O2soaking treatments on osmotic regulating substances content of peanut seed
2.6 H2O2浸种对花生种子内源激素含量的影响
如图4a所示,在萌发的第0、4、6天,CK处理ABA含量呈增加的趋势,A1处理ABA含量表现出先降低后增加的趋势。低温浸种结束,即萌发第0天时,A1处理的ABA含量比CK处理提高了42.75%,显著高于对照(P<0.05)。在萌发的第4、6天,与对照组相比,处理组的ABA含量分别降低了38.61%和16.32%,差异均达到了显著水平(P<0.05)。
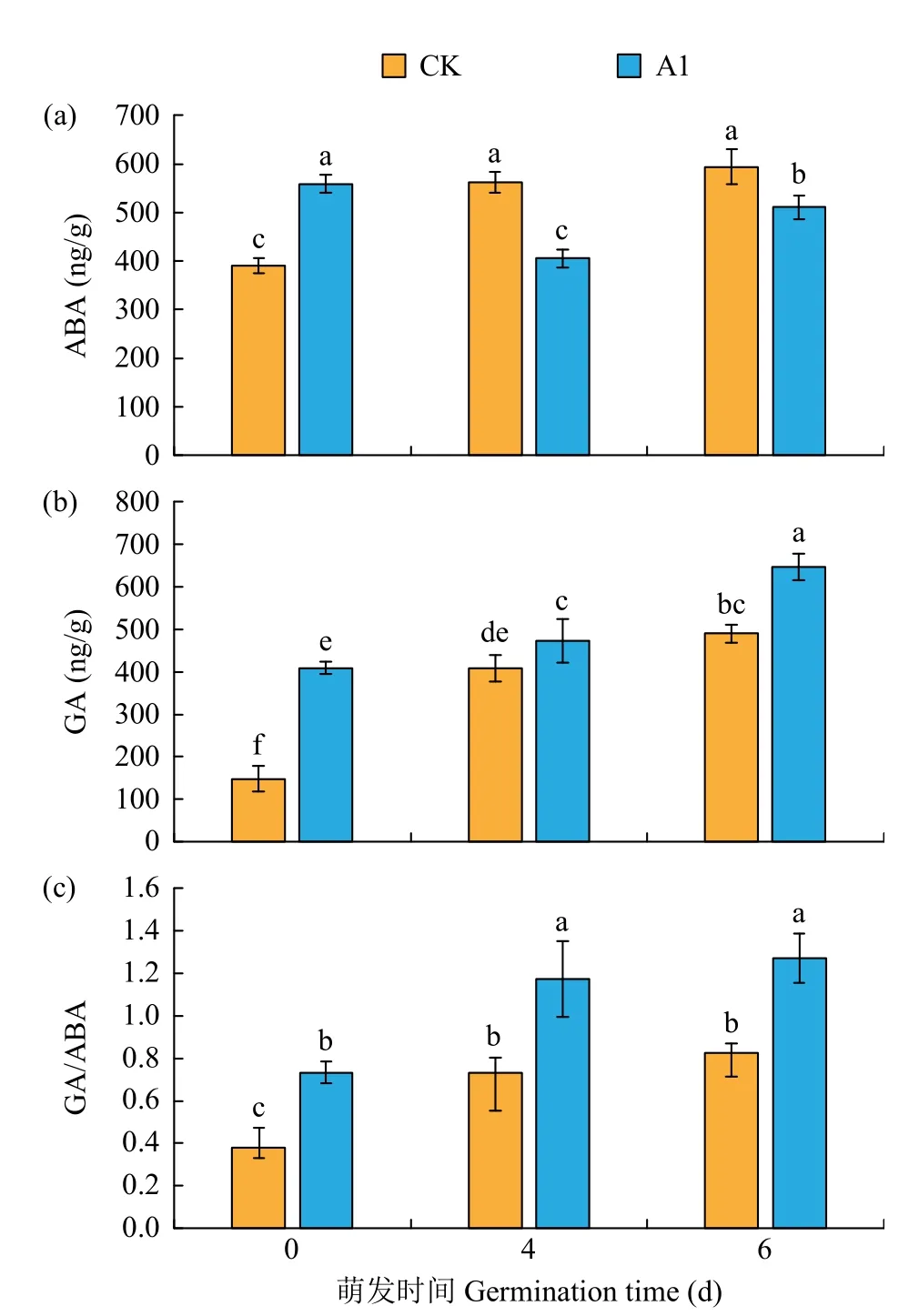
图4 H2O2浸种对花生种子内源激素含量的影响Fig.4 Effects of H2O2soaking treatments on endogenous hormones content of peanut seed
如图4b所示,随萌发时间延长,CK和A1处理的GA含量均呈现出增加的趋势,但CK均低于A1处理。在萌发的第0、4、6天,相比CK,A1处理GA含量分别提高了176.09%、15.55%和32.02%,差异均达到了显著水平(P<0.05)。
如图4c所示,在种子萌发过程中,CK和A1处理下GA/ABA均呈现逐渐增长的趋势。与CK处理相比,在萌发的第0、4、6天,A1处理的GA/ABA分别提高了92.44%、60.57%和53.76%,差异均达到了显著水平(P<0.05)。
3 讨论
低温胁迫是影响花生发芽及出苗的关键因素,因此研究花生品种耐低温发芽的调控技术显得尤为重要。一些研究[14-15]表明,H2O2能提高低温胁迫下花生的萌发能力。本研究选用高油酸品种豫花37和高油品种豫花9326为试验材料,发现H2O2可以提高2个花生品种在低温胁迫下的发芽水平,然而H2O2缓解豫花9326吸胀冷害的效果比豫花37更显著,可能是由于豫花37在种子萌芽阶段对H2O2的敏感性较低。
当种子在萌发过程的吸胀阶段受到低温胁迫时,首先会破坏细胞膜的结构和机能。低温使膜的形态发生了变化,膜脂发生凝固,膜从柔软的液晶态变为凝胶态,质膜出现裂缝,细胞透性增大,离子渗漏,破坏了原来正常的离子平衡[16]。在许多生理生化指标中,相对电导率最能直接反映膜系统的损伤程度[17],通常相对电导率越高,表明细胞膜透性越强,受伤害程度越大,植物抗寒能力越小[18]。在本研究中,当低温浸种结束时,H2O2浸种处理的豫花9326和豫花37电导率分别比对照降低了47.67%和23.67%。Yu等[19]利用200mmol/L H2O2处理预冷的绿豆幼苗,相对电导率从86%降低到21%,与本试验结果类似,但是所选H2O2浓度不同,这可能与所选作物不同或是种子和幼苗对H2O2敏感度不同有关。由此可知,H2O2预处理能降低电导率,减轻低温对细胞膜的破坏。此外,在低温胁迫下种子会产生过剩的自由基,引发或加剧膜脂过氧化作用。而膜脂过氧化的最终产物MDA会严重损伤生物膜。因此在植物抗寒生理研究中,MDA是鉴定细胞膜是否被破坏的标志物质[14,18]。在本研究中,低温浸种结束后的萌发过程中,无菌水浸种处理的MDA含量逐渐升高,而H2O2浸种处理的MDA含量逐渐降低。余燕等[15]研究表明,1% H2O2浸种能降低花生种子的MDA含量,从而提高种子的耐寒性,与本试验的研究结果一致,说明H2O2浸种预处理能降低MDA含量和减弱低温对细胞膜脂化程度,但是所选H2O2浓度的不同可能与花生品种或低温处理方式不同有关。
低温胁迫下植物能通过渗透调节物质保持细胞的渗透势平衡,维持细胞原有的正常生理代谢活动,其中最主要的渗透调节物质是可溶性糖和可溶性蛋白质[20]。在辣椒[21]、菜豆[22]和油菜[8]等作物的相关研究中发现,低温能诱导可溶性糖和可溶性蛋白的积累。通过增加内源渗透调解物质的方式,增加细胞内溶质含量,提高细胞内渗透势,提供生物合成所需能量,增加细胞内的结合水,降低凝固点,防止细胞被冻伤,从而增强抗寒性[18,23-24]。在前人[1]有关花生的研究中发现,低温胁迫条件下的种子发芽率、发芽指数等指标与可溶性糖和可溶性蛋白含量呈正相关。与此同时,H2O2也能影响可溶性糖和可溶性蛋白含量。任艳芳等[25]利用H2O2提高盐胁迫下小白菜种子内可溶性糖和可溶性蛋白的含量,以缓解盐胁迫对小白菜萌发的抑制作用。上述研究与本试验研究结果相似。在本研究中,低温浸种结束和萌发阶段,H2O2浸种处理的种子可溶性糖和可溶性蛋白含量、增长量均显著高于对照。由此可推测,H2O2处理可通过调控花生种子内可溶性糖和可溶性蛋白的含量,达到提高种子萌发期耐寒性的作用。
种子的萌发过程受多种激素的调控,其中ABA对萌发有抑制作用,而与其拮抗的激素GA有打破休眠和促进胚根突破种皮的作用[26-29]。研究[30-31]认为,种子的休眠与萌发主要受GA和ABA的动态平衡调控,种子中GA/ABA的比值升高促使种子由休眠向萌发阶段转变,而GA/ABA比例下降使种子进入休眠状态。此外ABA和GA还是植物对不同逆境产生响应的激素信号分子,可以广泛参与各种生理过程的调节[32]。在夏军等[33]的研究中,低温可诱导海岛棉种子内源激素GA的合成和GA/ABA升高,抑制ABA合成,进而有助于内源抑制物质的降低,促进海岛棉对低温环境的适应能力和促进种子萌发。此外,在前人[34-35]的研究中发现,在低温胁迫下,通过使用外源物质,进而可起到诱导种子降低ABA生成量,提高GA含量和GA/ABA的作用,从而达到提高植株抗寒性的效果。在本研究中,当低温浸种结束后,在萌发的过程中,ABA的含量呈现出先降低后增加的趋势,而GA含量和GA/ABA呈现出逐渐增加的趋势,这和前人研究的结果不太一致,可能与低温处理方式的不同或者是所选植物不同有关。由此推测,在5℃低温浸种时,H2O2促进花生种子ABA合成,降低GA含量,使种子维持休眠状态,减弱生理代谢活动,降低能量消耗,增强种子的耐低温胁迫能力;而在低温浸种结束后的常温萌发过程中,H2O2促使GA含量增加与ABA含量减少,从而维持种子正常的生理代谢活动,加快种子萌发。
4 结论
经吸胀冷害后种子发芽受到抑制,而H2O2浸种能减弱低温对种子萌发的抑制作用。H2O2处理可通过降低花生种子电导率和MDA含量以维持细胞膜的完整性,提高可溶性糖和可溶性蛋白的含量维持细胞渗透平衡,调控内源激素ABA和GA含量,激活种子的抗寒生理过程,从而提高花生种子萌发期的抗寒性。
